Похожие презентации:
Факторы, влияющие на скорость химической реакции
1.
2.
На основании теории столкновениячастиц при химической реакции,
рассмотреть и объяснить влияние
различных факторов на её скорость.
Развивать навыки решения
расчётных задач по вычислению
скорости химической реакции.
3.
ГИПОТЕЗА:ОПЫТ:
УРАВНЕНИЯ РЕАКЦИЙ:
ВЫВОД:
ЗАПОЛНИТЕ ТАБЛИЦУ:
ЗАКОНОМЕРНОСТИ
ИЗМЕНЕНИЯ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ
Факторы,
влияющие на
скорость
химической
реакции
Закономерности
изменения
скорости
Почему изменяется
скорость
химической
реакции
4.
Факторы, влияющие наскорость химической
реакции
Закономерности изменения
скорости
5.
Энергияактивации,
кДж / моль
Скорость
реакции
Примеры реакций
< 40
Очень
большая
Реакции ионного обмена
между электролитами,
взаимодействие щелочных
металлов с кислородом и
галогенами и др.
40-120
средняя
Гидролиз сахарозы,
взаимодействие металлов с
кислотами, натрия с водой
и металлами и др.
>120
Незначитель Разложение аммиака,
ная
гидрирование этилена и
др.
6.
Факторы, влияющие наскорость химической
реакции
Закономерности изменения
скорости
Природа
реагирующих
веществ
С уменьшением
Е акт скорость химической
реакции увеличивается
(с увеличением
реакционной способности
веществ скорость
химической реакции
увеличивается)
7.
Факторы, влияющие наскорость химической
реакции
Закономерности изменения
скорости
Концентрации
реагентов
Скорость химической
реакции пропорциональна
произведению
концентраций
реагирующих веществ,
взятых в степенях,
равных их
коэффициентам в
уравнении реакции(закон
действующих масс).
8. Температура
Факторы, влияющие наскорость химической
реакции
Закономерности изменения
скорости
Температура
С повышением
температуры
на 100 С скорость реакции
увеличивается в 2 – 4
раза
(правило Вант – Гоффа).
9.
10.
Факторы, влияющие наскорость химической
реакции
Закономерности изменения
скорости
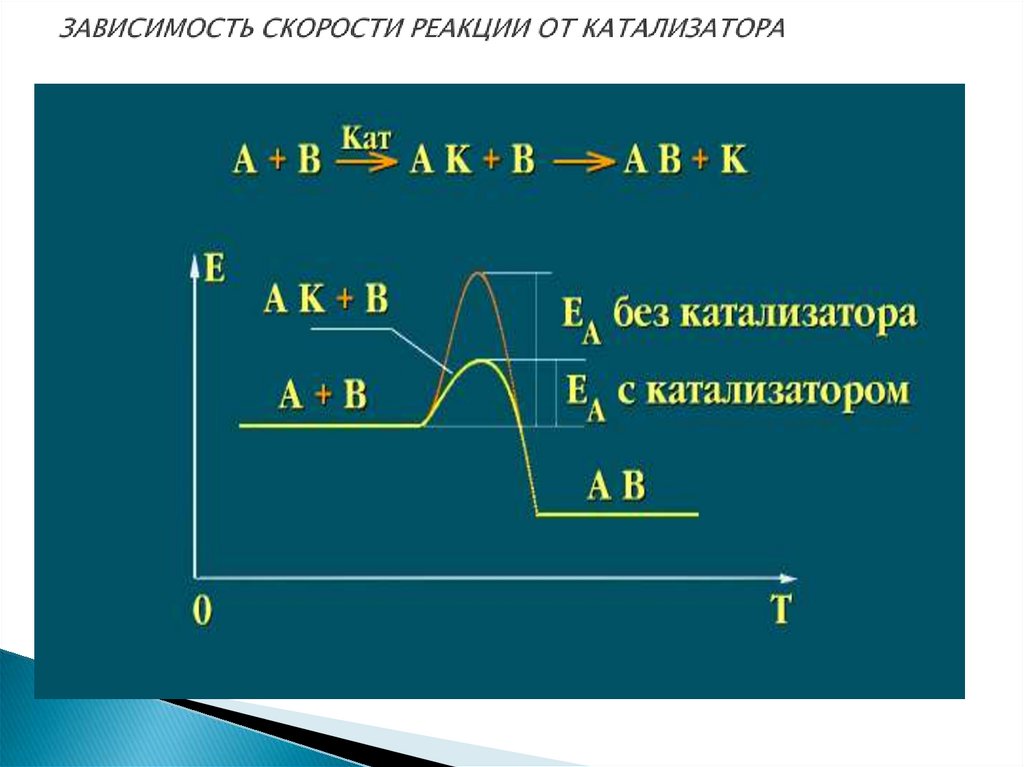
Катализатор
В присутствии
катализатора скорость
химической реакции
увеличивается.
11. Поверхность соприкосновения реагентов
Факторы, влияющие наскорость химической
реакции
Закономерности изменения
скорости
Поверхность
соприкосновения
реагентов
Чем больше площадь
поверхности
соприкосновения
веществ, тем больше
скорость химической
реакции.
12.
Факторы, влияющие наскорость химической
реакции
Закономерности изменения скорости
Природа реагирующих
веществ
С уменьшением энергии активации скорость
химической реакции увеличивается
(с увеличением реакционной способности веществ
скорость химической реакции увеличивается)
Концентрации
реагентов
Температура
Скорость химической реакции пропорциональна
произведению концентраций реагирующих
веществ, взятых в степенях, равных их
коэффициентам в уравнении реакции(закон
действующих масс).
С повышением температуры
на 10 С скорость реакции увеличивается
раза(правило Вант – Гоффа).
0
в2–4
Катализатор
В присутствии катализатора скорость химической
реакции увеличивается.
Поверхность
соприкосновения
реагентов
Чем больше площадь поверхности
соприкосновения веществ, тем больше скорость
химической реакции.
13.
Н.И.БекетовЯкобс Вант-Гофф
14.
№1Скорость химической реакции при 200 С
равна 1 моль /л▪с. Вычислите скорость этой
реакции при 600 С, если температурный
коэффициент равен 3?
№2
Во сколько раз увеличится скорость
химической реакции при увеличении
температуры от 500 до 1000 С, если
температурный коэффициент равен 2?
15.
№1Запишите кинетические уравнения для
реакций:
2Н2 (г)+ О2 (г)= 2Н2О(г)
С2Н 4(г)+Н 2(г)= С 2Н4(г)
№2
Запишите кинетические уравнения для
реакций:
2Си(т) + О2 (г)= 2СиО (т)
2NO (г) + О2 (г)= 2NO 2(г)














 Химия
Химия








