Похожие презентации:
Характерные свойства простых веществ-неметаллов
1.
ХАРАКТЕРНЫЕ СВОЙСТВА ПРОСТЫХВЕЩЕСТВ - НЕМЕТАЛЛОВ
Карташова Людмила Александровна,
учитель химии МАОУ «СОШ №27 с УИОП»
г. Балаково Саратовской области
2.
ОпределениеНемета́ ллы — химические элементы с типично неметаллическими
свойствами, которые занимают правый верхний угол Периодической
системы. Расположение их в главных подгруппах соответствующих
периодов следующее:
Период
I
II
III
IV
V
VI
VII
VIII
B
C
N
O
F
He
Si
P
S
Cl
Ne
As
Se
Br
Ar
Te
I
Kr
At
Xe
группа
1
2
3
4
5
6
Rn
3.
Химическая связьВ простых веществах атомы неметаллов связаны ковалентной
неполярной связью. Благодаря этому формируется более устойчивая
электронная система, чем у изолированных атомов. При этом
образуются одинарные (например, в молекулах водорода H2,
галогенов F2, Br2, I2), двойные (например, в молекулах кислорода O2),
тройные (например, в молекулах N2) ковалентные связи.
H H
O O
N N
одинарные
двойные
тройные
4.
Молекулярное строениеПри обычных условиях неметаллов представляют собой газы
или твёрдые вещества
графит
красный фосфор
кремний
йод
сера
и лишь один-единственный бром является жидкостью
бром
5.
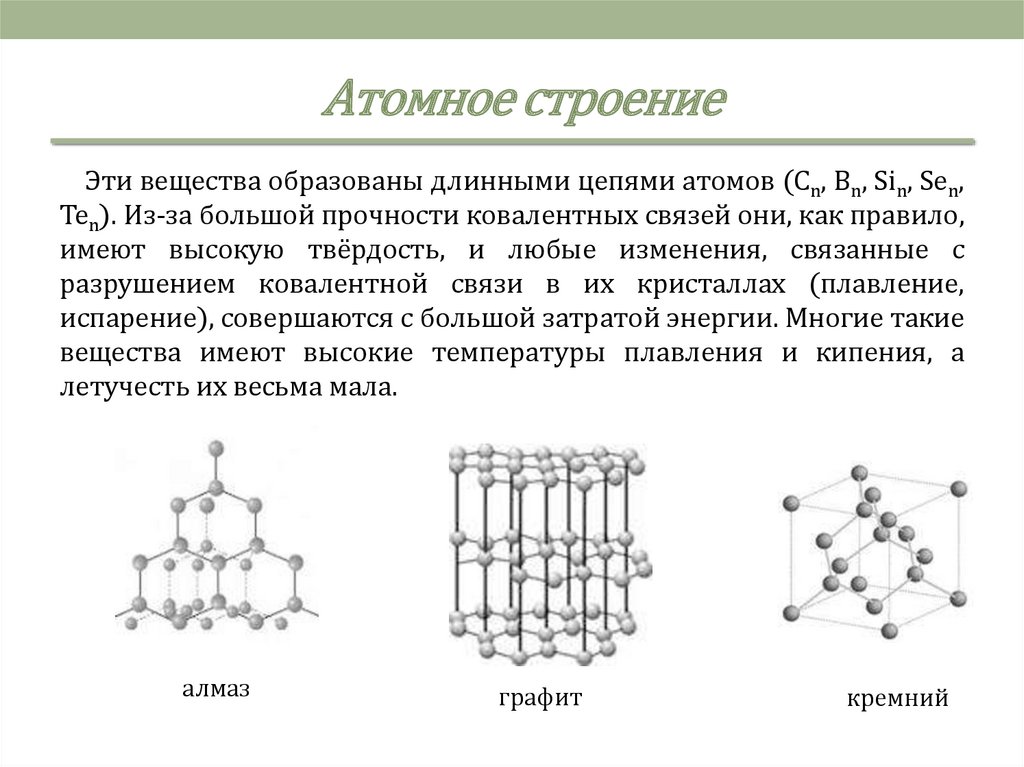
Атомное строениеЭти вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen,
Ten). Из-за большой прочности ковалентных связей они, как правило,
имеют высокую твёрдость, и любые изменения, связанные с
разрушением ковалентной связи в их кристаллах (плавление,
испарение), совершаются с большой затратой энергии. Многие такие
вещества имеют высокие температуры плавления и кипения, а
летучесть их весьма мала.
алмаз
графит
кремний
6.
Химические свойстваДля атомов неметаллов, а следовательно, и для образованных
ими простых веществ характерны как окислительные, так и
восстановительные свойства.
Увеличиваются окислительные свойства
F2 ˃ O3 ˃ Cl2 ˃ O2 ˃ I2 ˃ C ˃ Si ˃ P ˃ N2 ˃ S ˃ H2
Увеличиваются восстановительные свойства
7.
Окислительные свойстваОкислительные свойства неметаллов проявляются, в первую
очередь, при их взаимодействии с металлами (металлы всегда
восстановители):
2Na0+ S0 = Na+2S
2















 Химия
Химия








