Похожие презентации:
Электрохимические процессы и явления
1.
Электрохимическиепроцессы и явления
2.
Электрохимические процессы –процессы прямого превращения
химической энергии гетерогенных
окислительно-восстановительных
реакций
в
электрическую
и
обратно.
Электрохимическая
система
–
система, в которой осуществляется
взаимное превращение химической и
электрической форм энергии.
3.
Э/Х системы классифицируют на две группы:1. Химические источники тока (ХИТ), в которых
химическая энергия самопроизвольно идущих ОВР
превращается в электрическую.
В свою очередь ХИТ подразделяют на:
Первичные
(однократного
действия)
или
необратимые источники тока – гальванические
элементы (ГЭ);
Вторичные (многократного обратимого действия) –
аккумуляторы (перезаряжаемые ГЭ);
Топливные элементы (непрерывного действия) –
электрохимические генераторы тока.
2. Электролизные системы, в которых химические
реакции протекают под действием постоянного тока
от внешнего источника.
4.
Простейшая Э/Х система состоит из 2-хэлектродов, опущенных в электролит и
соединенных между собой металлическим проводником.
Электрод – Э/Х система, состоящая из
двух контактирующих фаз: материала с
электронной
проводимостью
–
проводника I рода (металл или
полупроводник) и ионного проводника –
проводника II рода (раствор или
расплав электролита).
5.
Электроды в э/х системах бывают:1. Инертные (нерастворимые), не способные
окисляться в ходе реакции: C, Au, Pt .
2. Активные (растворимые),
способные
окисляться в ходе реакции. В общем случае это
любой Ме, кроме благородного. В зависимости
от условий эксплуатации некоторые активные
металлы могут вести себя как инертные из-за
явления пассивации.
Пассивация
–
явление
образования
на
поверхности металлов оксидных или солевых
пленок. Например, Al в атмосферных условиях
покрывается оксидной пленкой:
4Al + 3O2 → 2Al2O3 .
6. Электродный потенциал и механизм его возникновения
Рассмотрим систему: металл – раствор электролита.Пластинка любого металла, опущенная в воду или
водный раствор своей соли, растворяется.
Под действием полярных молекул (диполей) воды
ионы поверхностного слоя металла отрываются и в
гидратированном состоянии переходят в жидкость.
Растворение металла – это процесс окисления.
Т.к. р-р не обладает электронной проводимостью, то
электроны, образовавшиеся при растворении Ме,
остаются на поверхности Ме. При этом пластина Ме
заряжается отрицательно, а слой электролита у ее
поверхности – положительно (гидратированные
катионы Ме).
7.
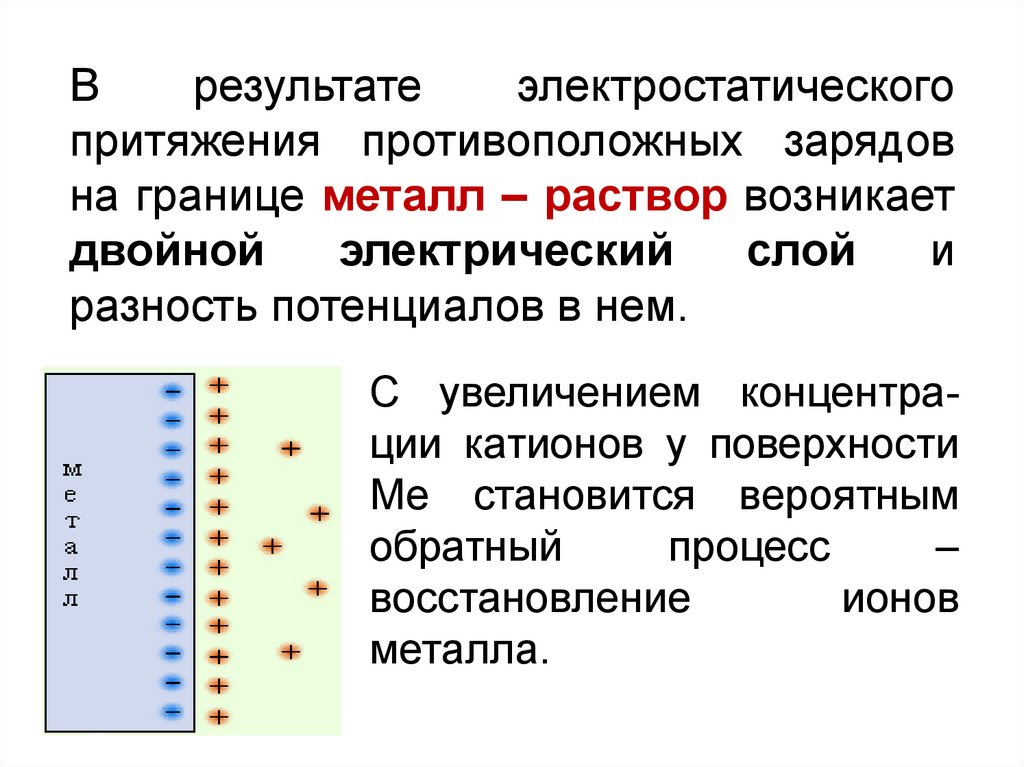
Врезультате
электростатического
притяжения противоположных зарядов
на границе металл – раствор возникает
двойной
электрический
слой
и
разность потенциалов в нем.
С увеличением концентрации катионов у поверхности
Ме становится вероятным
обратный
процесс
–
восстановление
ионов
металла.
8.
На границе раздела фаз этой сопряженной пары (единойОВ-ой системы) устанавливается равновесие гетерогенной
обратимой ОВР:
(пластинка)
(пластинка)
(раствор)
или
Me – nē ⇄
в-ль (ВФ)
n+
Me
(1)
ок-ль (ОФ)
ВФ – восстановленная форма,
ОФ – окисленная форма участников электродного процесса
9.
Количественнойхарактеристикой
равновесия
является
константа
равновесия. Для гетерогенной системы
(1) при P = const константа равновесия
равна:
K C СMen
Состояние равновесия зависит от
активности металла и концентрации его
ионов в растворе.
10.
Активные металлы (Zn, Fe, Cr…) легчерастворяются
в
воде
(окисляются),
равновесие (1) смещено вправо (KС > 1):
19
2+
Zn ⇄ Zn + 2ē (KC = CZn2+ = 10 ) .
При погружении таких Ме в
водный р-р собственной соли
для достижения равновесной
концентрации ионы Ме будут
переходить
в
раствор
и
поверхность Ме зарядится «–»,
р-р электролита – «+».
11.
Для малоактивных Ме (Cu, Ag, Hg…. )равновесная концентрация ионов Ме в
растворе очень мала и равновесие (1)
смещается влево (KC < 1):
Cu ⇄
Cu2+
+ 2ē (KС = CCu2+ =10
18
).
При погружении таких Ме в водный р-р
собственной
соли
для
достижения
равновесной концентрации ионы Ме из р-ра
будут переходить на поверхность Ме и она
зарядится «+», а р-р электролита – «–»
(избыток анионов соли).
12.
Электродный потенциал (φ, В)– это разность потенциалов,
возникающая
в
электрическом
слое
двойном
между
металлом и жидкой фазой.
13.
Схематическая запись электродаотражает участников электродного
равновесия.
Например:
Ме | Men+
Вертикальная черта обозначает
границу раздела фаз, на которой
протекает электродный процесс.
14.
Вовсех
случаях
причиной
возникновения двойного электрического
слоя на границе раздела фаз и скачка
потенциала в нем является ОВ-ный
процесс на поверхности электрода.
След-но, электродный потенциал
является
количественной
характеристикой
ОВ-ных
свойств
системы.
15.
Значение φ зависит от:природы электрода;
температуры;
концентрации
потенциалопределяющих
ионов.
16.
Абсолютное значение φ экспериментально определить невозможно. Можноопределить только разность потенциалов
между двумя электродами, одним из
которых является электрод сравнения,
потенциал
которого
условно
принимается равным нулю. В качестве
электрода сравнения, по отношению к
которому определяют потенциалы других
электродов,
принят
стандартный
водородный электрод.
17.
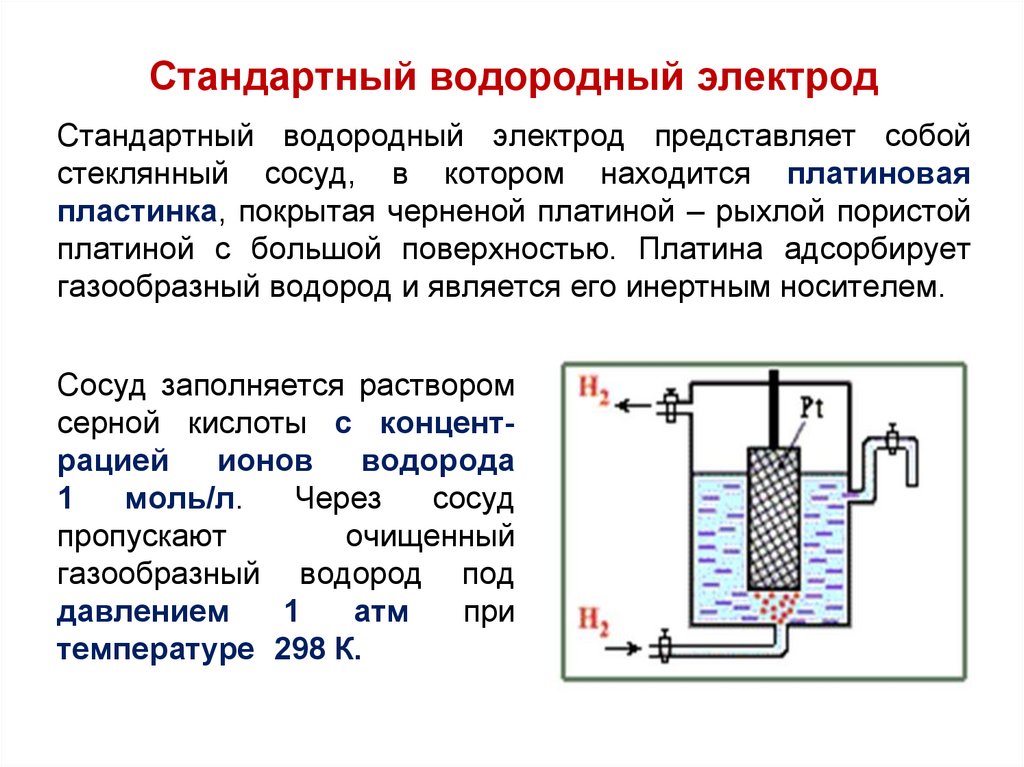
Стандартный водородный электродСтандартный водородный электрод представляет собой
стеклянный сосуд, в котором находится платиновая
пластинка, покрытая черненой платиной – рыхлой пористой
платиной с большой поверхностью. Платина адсорбирует
газообразный водород и является его инертным носителем.
Сосуд заполняется раствором
серной кислоты с концентрацией
ионов
водорода
1
моль/л.
Через
сосуд
пропускают
очищенный
газообразный водород под
давлением
1
атм
при
температуре 298 К.
18.
На границе платины и р-ра серной кислотыустанавливается равновесие между ионами
водорода в р-ре, образовавшимися за счет
диссоциации серной кислоты, и газообразным
водородом, адсорбированным платиной (Pt
является переносчиком электронов, но в
электродном равновесии не участвует):
2Н+ + 2ē ⇄ H2 .
Схема:
Pt, H2 | H2 SO4 или
φ
0
2Н + / Н 2
=0
Pt, H2 | 2H+
19.
Электродный потенциал, измеренный по отношению к стандартномуводородному электроду при стандартных условиях – концентрации
потенциалопределяющих
ионов
1 моль/л; Т = 298 K; Р = 101,325 кПа –
называется стандартным
электродным потенциалом (φ0, В).
20.
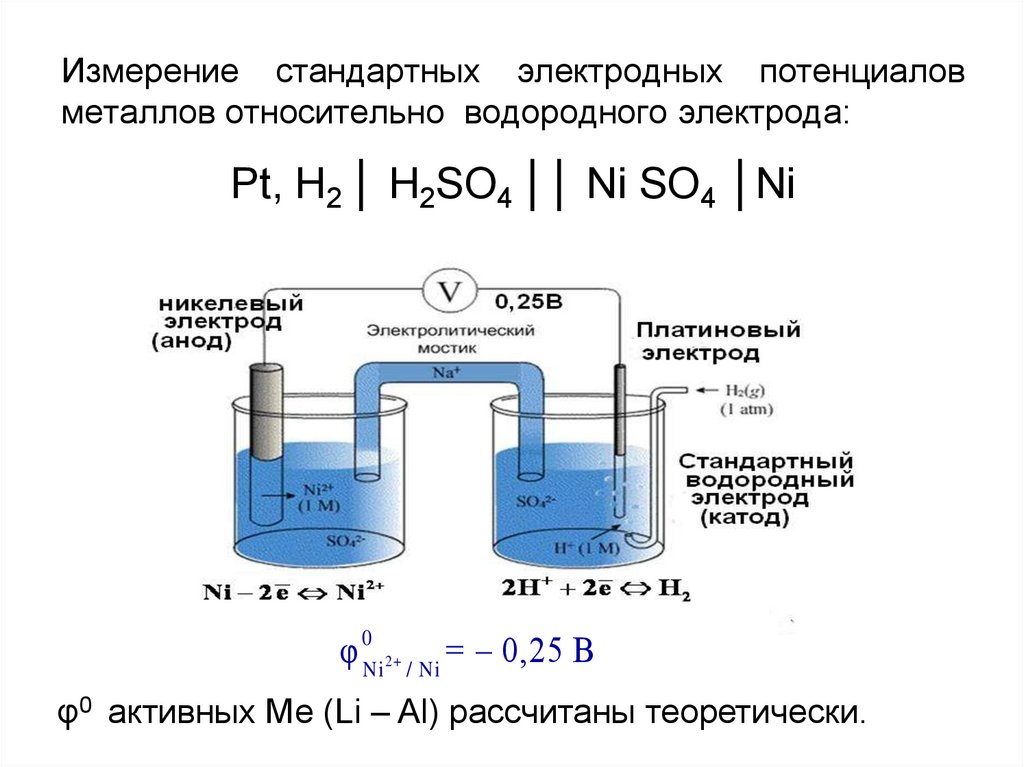
Измерение стандартных электродных потенциаловметаллов относительно водородного электрода:
Pt, H2 │ H2SO4 ││ Ni SO4 │Ni
φ 0Ni 2+ / Ni = 0,25 В
φ0 активных Ме (Li – Al) рассчитаны теоретически.
21.
Располагая металлыв
порядке возрастания их
φ0, получают ряд стандартных
электродных
потенциалов металлов
в водных растворах
(Э/Х ряд напряжений
Ме).
φ0 – табл. величина!
В Э/Х принято все электродные
равновесия
записывать
в
направлении
процесса
восстановления.
Электрод
Li+/Li
K+/K
Ca2+/Ca
Na+/Na
Mg2+/Mg
Al3+/Al
Mn2+/Mn
Zn2+/Zn
Cr3+/Cr
Fe2+/Fe
Cd2+/Cd
Co2+/Co
Ni2+/Ni
Sn2+/Sn
Pb2+/Pb
Fe3+/Fe
H+/½H2
Cu2+/Cu
Fe3+/Fe2+
Ag+/Ag
Hg2+/Hg
Au3+/Au
Электродные
реакции
Li+ + e– = Li
K+ + e– = K
Ca2+ + 2e– = Ca
Na+ + e– = Na
Mg2+ + 2e– = Mg
Al3+ + 3e– = Al
Mn2+ + 2e– = Mn
Zn2+ + 2e– = Zn
Cr3+ + 3e– = Cr
Fe2+ + 2e– = Fe
Cd2+ + 2e– = Cd
Co2+ + 2e– = Co
Ni2+ + 2e– = Ni
Sn2+ + 2e– = Sn
Pb2+ + 2e– = Pb
Fe3+ + 3e– = Fe
H+ + e– = ½ H2
Cu2+ + 2e– = Cu
Fe3+ + e– = Fe2+
Ag+ + e– = Ag
Hg2+ + 2e– = Hg
Au3+ + 3e– = Au
φ0, В
-3,045
-2,925
-2,866
-2,714
-2,363
-1,662
-1,179
-0,763
-0,744
-0,440
-0,403
-0,277
-0,250
-0,136
-0,126
-0,036
0,000
+0,337
+0,770
+0,799
+0,854
+1,498
22.
Критерии оценки активности Э/Х системВеличина φ0 указывает на меру восстановительной
способности
атомов
и
меру
окислительной способности ионов металла:
чем < φ0, тем Ме химически активнее, тем легче
атомы Ме окисляются;
чем > φ0, тем лучше ионы Ме восстанавливаются.
Каждый металл вытесняет все следующие за ним
Ме из растворов солей (кроме щелочных и
щелочно-земельных Ме), т.е. более активный Ме
вытесняет менее активный Ме из раствора соли.
23.
!!!Система с меньшим φ всегда
будет
восстановителем
по
отношению
к
системе
с
большим φ
и
условием
самопроизвольного протекания
ОВР в растворах
является
неравенство:
φок-ля > φвос-ля
24.
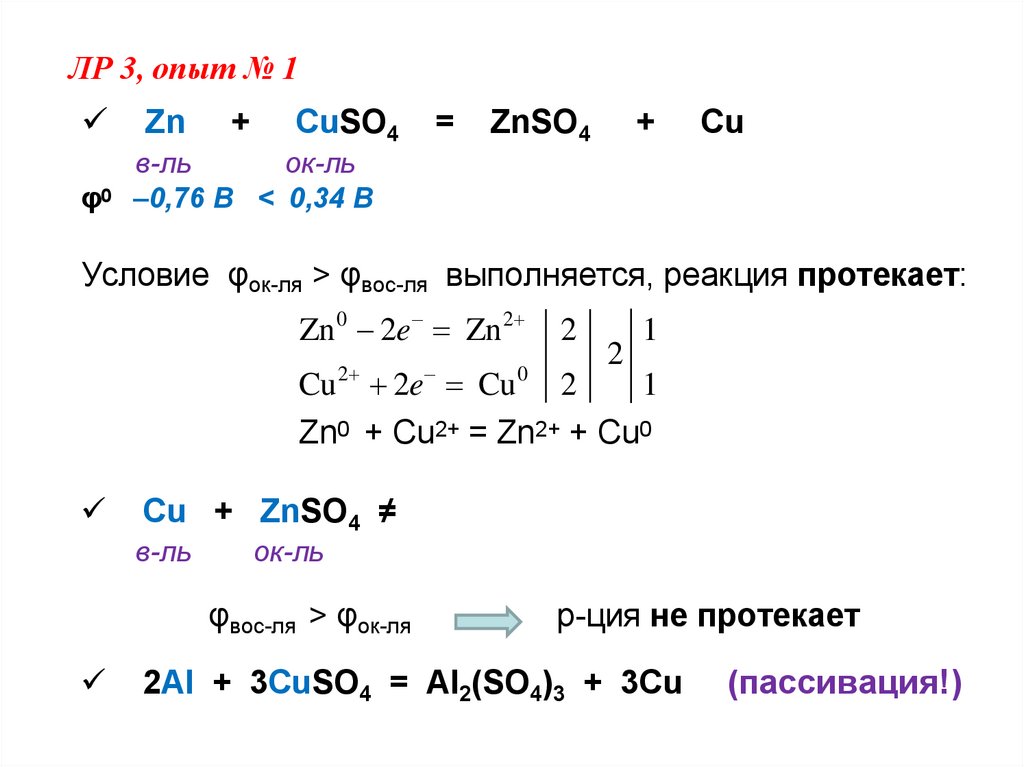
ЛР 3, опыт № 1φ0
Zn
+
CuSO4
=
ZnSO4
+
Cu
в-ль
ок-ль
–0,76 В < 0,34 В
Условие φок-ля > φвос-ля выполняется, реакция протекает:
Zn 0 2e Zn 2
2
2
2
1
1
Cu 2e Cu 2
Zn0 + Cu2+ = Zn2+ + Cu0
Cu + ZnSO4 ≠
в-ль
ок-ль
φвос-ля > φок-ля
0
р-ция не протекает
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
(пассивация!)
25.
Из 2-х, … и т.д. возможных реакцийпротекает та, для которой неравенство
φок-ля > φвос-ля выполняется в большей
степени.
Из
всех
возможных
окисления вероятнее тот,
которого меньше.
процессов
потенциал
Из
всех
возможных
процессов
восстановления вероятнее
тот,
потенциал которого больше.
26.
ЛР 3, опыт № 1Пример: Какая реакция протекает при станд-х условиях?
Zn + FeCl3 ZnCl2 + Fe
Zn + FeCl3 ZnCl2 + FeCl2
в-ль
ок-ль
Zn0 – 2ē ⇄ Zn2+
φ 0Zn 2+ / Zn = 0,76 B
Fe3+ +
3ē ⇄
Fe0
(полное восс-ние)
φ 0Fe3+ / Fe = 0,036 B
Fe3+ +
1ē ⇄
Fe2+
(частичное восс-ние)
φ 0Fe3+ / Fe2+ = 0,77 B
Из всех
вероятнее
возможных процессов восстановления
тот, потенциал которого больше.
Условие φок-ля > φвос-ля в большей степени выполняется
для второй реакции:
Zn + 2FeCl3 = ZnCl2 + 2FeCl2
27.
Электроды,обратимые
относительно своих ионов в растворе
электролита, наз-ся электродами
1-го рода.
К ним относятся:
металлические электроды;
газовые электроды:
водородный, кислородный.
28.
УРАВНЕНИЕ НЕРНСТАПотенциал электродов в условиях, отличных
стандартных, можно рассчитать по ур-нию Нернста:
φ эл-да φ
0
эл-да
от
Cаок
R T
ln в
n F
Cвос
где φ0эл-да – станд. электродный потенциал, В;
R – универс. газовая постоянная, 8,314 Дж/моль·К;
Т – температура, К;
F – постоянная Фарадея, 96500 Кл;
n – число электронов, участвующих в данной
электродной реакции;
Саок и Сввос – молярные конц-ции ОФ (Меn+, Н+, О2)
и ВФ (Ме0, Н2, ОН–) электрода в степени
коэффициентов в уравнении электродной реакции.
29.
Переходя от натурального логарифма кдесятичному (коэффициент перевода
2,3) и подставляя значения постоянных
R = 8,314 Дж/ моль·K и F = 96500 Kл
при T = 298 K, получим:
φ эл-да φ
0
эл-да
а
ок
в
вос
C
0,059
lg
n
C
30.
!!!Металлический электрод
Схема:
Ме |
Men+
ОФ: Меn+
ВФ: Ме
Уравнение электродной реакции:
Men+ + nē ⇄ Me
Уравнение Нернста:
φ Men+ / Me φ°Men+ / Me
в
С вос
0,059
lg CMen+
n
= СМе = соnst = 1
31.
!!!Водородный электрод
Схема:
ОФ: Н+
ВФ: Н2
Pt, H2 | 2H+
Уравнение электродной реакции:
2Н+ + 2ē ⇄ H2 , рН < 7
Уравнение Нернста:
φ 2H+ / H φ°2H+ / H
2
C2H +
2
0,059
lg
;
n
PH 2
φ°2H+ / H 0, n = 2, PH 2 = 1 атм, lgС Н + = рН;
2
φ 2H+ / H 0,059рН
2
32.
Можно создать водородный электрод, используя вкачестве жидкой фазы воду или раствор основания.
Схема:
Pt, H2 | 2H2О
ОФ: Н2О
ВФ: Н2
Уравнение электродной реакции:
2H2O + 2ē ⇄ H2 + 2OH–, рН ≥ 7
! Потенциал
уменьшается,
способность.
водородного электрода с ↑рН
растет его восстановительная
33.
!!!Кислородный электрод
Схема:
Pt, О2 | 4OH–
ОФ: О2
ВФ: ОН–
Уравнение электродной реакции:
О2 + 2H2O + 4ē ⇄ 4OH–, рН ≥ 7
Уравнение Нернста:
φО
2 /4ОН
φ°О
2 /4ОН
φ°О
2
/4ОН
PO2
0,059
lg 4 ;
n
CОН
0, 4 В, n = 4, PО2 = 1 атм,
рН = 14 рОН;
φО
2
/4ОН
1, 23 0,059рН
lgСОН = рОН;
34.
Можно создать кислородныйэлектрод,
используя в качестве жидкой фазы раствор
кислоты.
Схема:
Pt, О2 | 2H2О
Уравнение электродной реакции:
О2 + 4H+ + 4ē ⇄ 2H2O, рН < 7
ОФ: О2
ВФ: Н2О
35.
Гальванические элементыГальванический элемент – Э/Х
устройство, в котором самопроизвольно протекает ОВР и её энергия
преобразуется в электрическую.
ГЭ состоит из двух электродов и ионного
проводника
между
ними.
Электроды
замыкаются металлическим проводником.
Ионным проводником служат растворы или
расплавы электролитов, а также твердые
электролиты.
36.
Анод – электрод с меньшимзначением φ, на нем идут процессы
окисления.
Катод – электрод с бо́льшим
значением φ, на нем идут процессы
восстановления.
Возникновение
тока
в
ГЭ
обусловлено разностью потенциалов
электродов.
37.
ГЭ делятся на:химические;
концентрационные.
Химическим называется ГЭ, состоящий
из
двух
электродов
различной
химической природы.
Химические ГЭ бывают двух типов:
Даниэля-Якоби;
Вольта.
38.
ГЭ типа Даниэля-ЯкобиГЭ типа Д.-Я. состоит из двух
электродов
1-го
рода
–
цинкового и медного электродов
(цинковая и медные пластинки
погружены в 1М р-ры ZnSO4 и
CuSO4 соответственно).
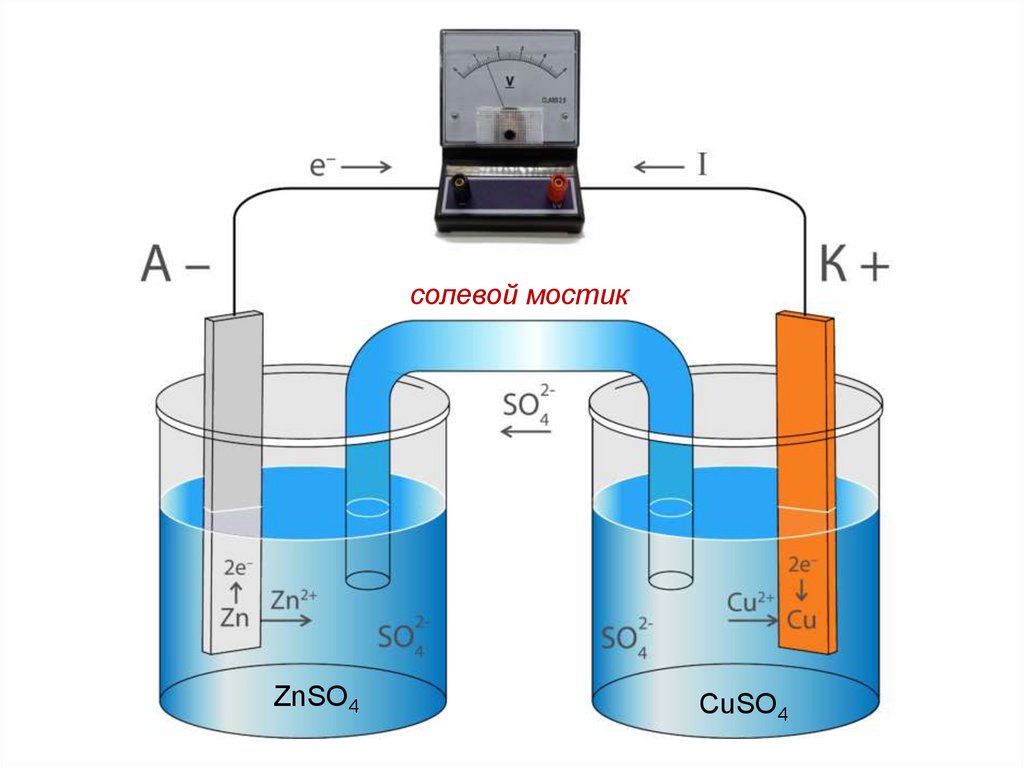
39.
солевой мостикZnSO4
CuSO4
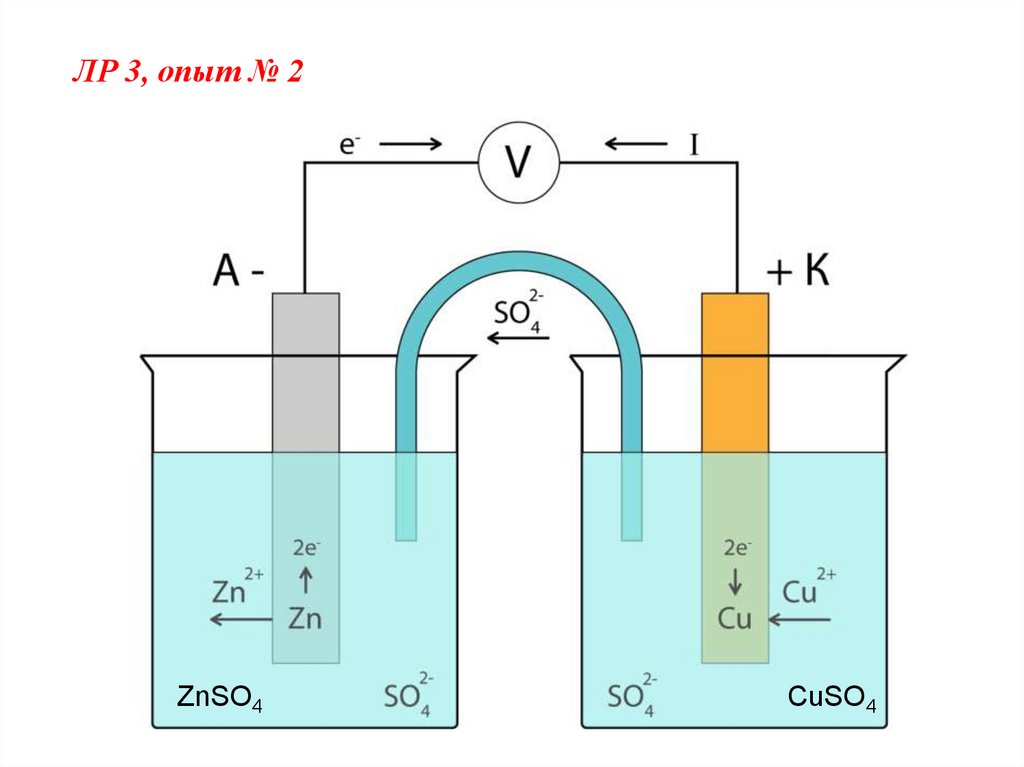
40.
ЛР 3, опыт № 2ZnSO4
CuSO4
41.
Для замыкания внутренней цепирастворы электролитов соединяются
проводником второго рода (электролитический или солевой мостик).
При соединении электродов металлическим проводником (внешняя
цепь)
вследствие
разности
потенциалов цинка и меди часть
электронов с цинковой пластины
перейдет на медную.
42.
При замыкании цепи на цинковомэлектроде происходит процесс окисления
металлического цинка: Zn0 – 2ē ⇄ Zn2+;
на медном электроде – восстановление
катионов меди: Cu2+ + 2ē ⇄ Cu0.
Этими процессами сохраняется разность
потенциалов пластинок, обеспечивающая
постоянный переход электронов по
внешней цепи от цинка к меди –
электрический ток в цепи.
43.
Во внутренней цепи сульфат-ионы,оказавшиеся в избытке в катодном
пространстве, переходят через солевой
мостик в анодное пространство, где
компенсируют заряды, образовавшиеся при
окислении цинка.
Т.о., в основе работы данного ГЭ лежит
реакция:
Zn0 + Cu2+ = Zn2+ + Cu0 ,
Zn + CuSO4 = Cu + ZnSO4.
Процессы, описывающие работу ГЭ, представляются в
виде схемы.
44.
Правила схематической записи ГЭ1. Одной строкой фазы записываются в той
последовательности,
в
которой
они
соединяются в реальном устройстве.
2. Для внешней цепи ГЭ электрод с меньшим
значением φ будет отрицательным полюсом,
электрод с большим
значением φ будет
положительным полюсом элемента.
Анод « – »
Катод « + »
3. Уравнения электродных реакций.
4. Суммарная токообразующая реакция ГЭ.
45.
Примечание:Прежде чем записывать схему ГЭ, необходимо
установить и
сравнить химическую
активность
предлагаемых электродов по их φ.
В стандартной цепи для этого используют
таблицу (φо):
φ 0Zn 2+ / Zn = 0,76 В
АНОД
φ 0Cu 2+ / Cu = 0,34 В
КАТОД
В табл. (φо) «анод» расположен выше «катода» !
В условиях, отличных от стандартных, φ
рассчитывают по уравнению Нернста.
46.
!!!Критерий
определения
нальной роли электродов
тающем ГЭ:
φK > φA .
функциов рабо-
Критерий работы ГЭ – положительное
значение
ЭДС,
соответствующее
самопроизвольному
протеканию
токообразующей реакции ГЭ:
Е = φK – φA > 0
47.
Схема ГЭ типа Д.-Я.А (–) Zn│1 М ZnSO4 ║ 1 М CuSO4 │Cu (+) K
А (–) Zn│Zn2+ ║ Cu2+ │Cu (+) K
А: Zn – 2ē = Zn2+
K: Cu2+ + 2ē = Cu
Zn0 + Cu2+ = Zn2+ + Cu0 (токообразующая р-ция)
Zn + CuSO4 = Cu + ZnSO4
Е0 = φ0K – φ0A = 0,34 – (–0,76) = 1,1 В
Е0 - стандартная электродвижущая сила (ЭДС)
элемента, В.
48.
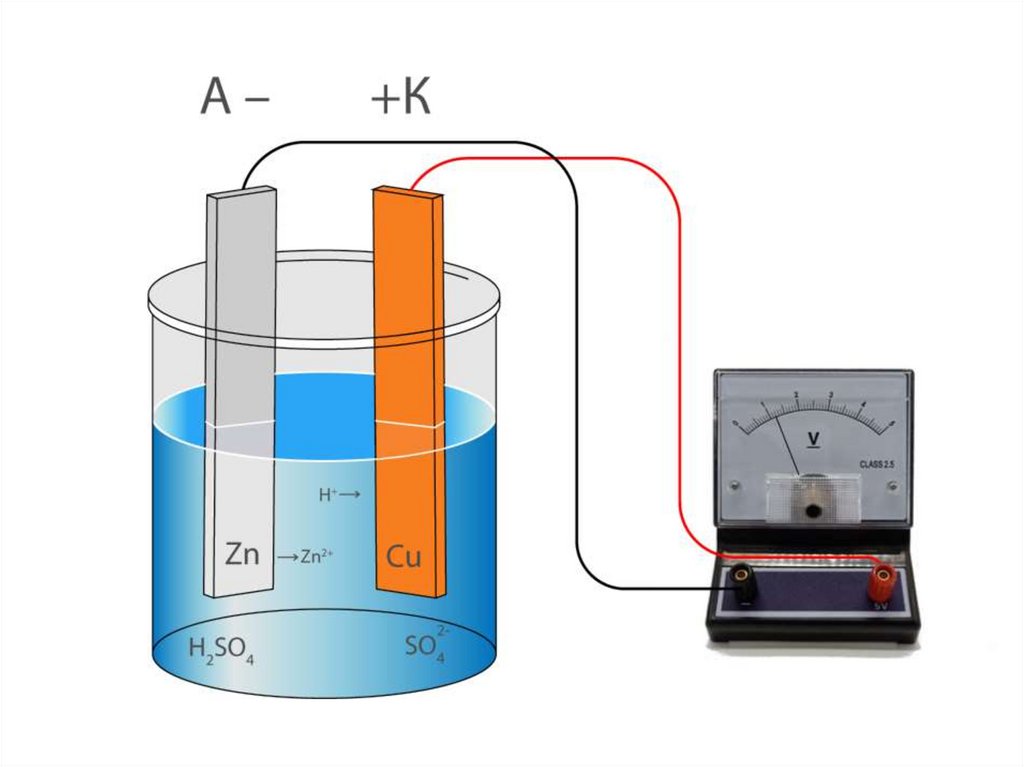
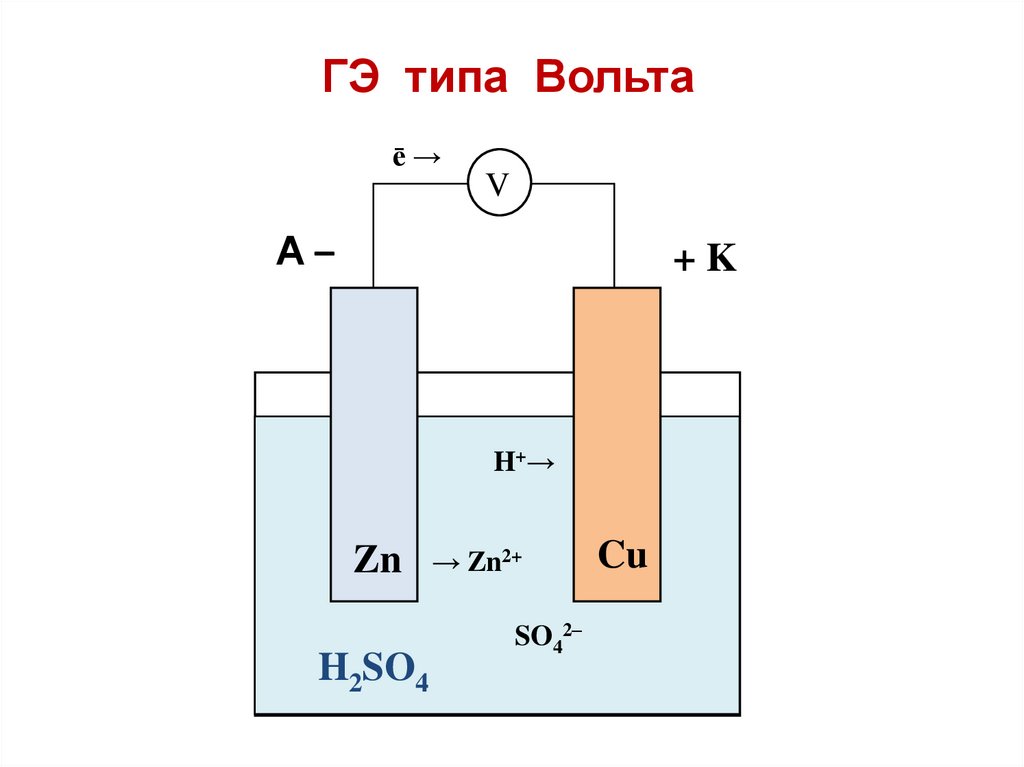
ГЭ типа ВольтаГЭ типа Вольта состоит из двух
электродов различной природы
в одном и том же электролите
(из медного и цинкового электродов в растворе серной кислоты).
49.
50.
ГЭ типа Вольтаē→
V
A–
+K
H+→
Zn
H2SO4
→ Zn2+
SO42–
Cu
51.
При замыкании цепи на цинковомэлектроде
происходит
процесс
окисления металлического Zn:
Zn0 – 2ē ⇄ Zn2+;
на медном электроде – восстановление
катионов водорода:
2Н+ + 2ē ⇄ H20.
Нет ионов Cu2+!
52.
Схема ГЭ типа ВольтаА (–) Zn│Н2SO4 , H2O│Cu (+) K
А (–) Zn│Н+, H2O│Cu (+) K
А: Zn – 2ē =
Zn2+
φ 0Zn 2+ / Zn = 0,76 B
K: 2Н+ + 2ē = H2
φ 02Н + / Н = 0
Zn0 + 2Н+ = Zn 2+ + H2
(токообразующая р-ция)
2
Zn + Н2SO4 = ZnSO4 + H2
Е0 = φ0K – φ0A = 0 – (–0,76) = 0,76 В
53.
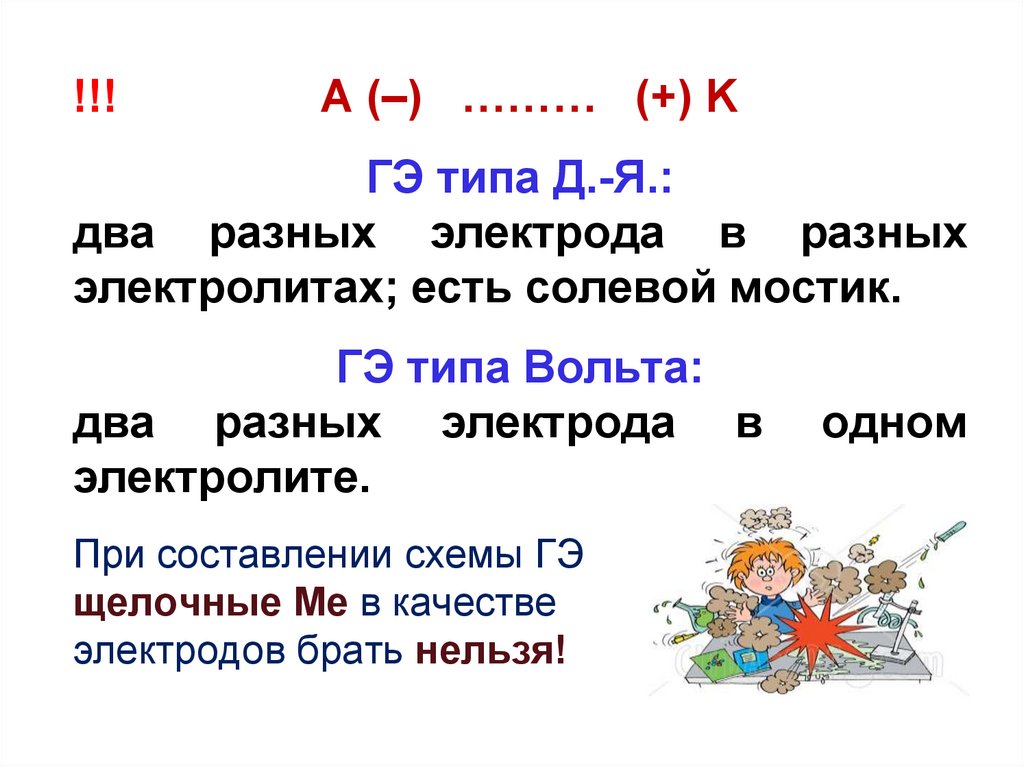
!!!А (–) ……… (+) K
ГЭ типа Д.-Я.:
два разных электрода в разных
электролитах; есть солевой мостик.
ГЭ типа Вольта:
два разных электрода в
электролите.
При составлении схемы ГЭ
щелочные Ме в качестве
электродов брать нельзя!
одном
54.
Концентрационным называется ГЭ, состоящийиз двух электродов 1-ого рода одинаковой
природы, опущенных в раствор электролитов с
различной концентрацией потенциалопределяющих ионов.
ГЭ работает за счет выравнивания конц-ции
ионов в растворах электролитов.
Электрод в р-ре с меньшей концентрацией
ионов, имеющий меньшее φ – анод.
Электрод в р-ре с большей концентрацией
ионов, имеющий большее φ – катод.
55.
Схема концентрационного ГЭA( ) Ag | AgNO3 || AgNO3 | Ag ( )K
C1 <
C2
A: Ag e = Ag +
K: Ag + + e = Ag
ЭДС элемента определяется
концентраций ионов:
соотношением
C2
0,059
E=
lg
n
C1
где С1 и С2 – молярные концентрации ионов у анода
и катода (C1 < C2).
56.
Характеристики ГЭ: АМ, ∆GВ результате самопроизвольных процессов (перенос ē в ходе ОВР) ГЭ
совершает максимально
полезную
электрическую работу АМ (Дж):
АМ = n·F·E ,
где n – НОК числа электронов обеих
электродных реакций элемента;
n·F –
количество прошедшего
электричества.
57.
Работасовершается за счет самопроизвольно
протекающей реакции, при этом изменение энергии
Гиббса ∆G (Дж) системы уменьшается:
АМ = – ∆G ,
∆G = – n·F·E .
!!! Для ответа на вопрос о т/д возможности
протекания
процесса
и
его
направлении
необходимо рассчитать ∆G. Если ∆G < 0 – процесс
возможен и протекает в прямом направлении.
Константа равновесия, определяющая
самопроизвольно протекающей реакции ГЭ:
K P 10
n E
0,059
глубину
58.
Пример:ГЭ состоит из металлического цинка,
погруженного в 0,1 н. раствор нитрата цинка,
и металлического свинца, погруженного в
0,02 М раствор нитрата свинца (II).
Рассчитайте ЭДС, ∆G, АМ, KP. Составьте
схему ГЭ, запишите уравнения электродных
процессов,
уравнение
токообразующей
реакции.
59.
Алгоритм решения задач(ГЭ в реальных условиях)
1. Рассчитаем φ электродов по ур-нию Нернста:
0,059
φ Men+ / Me φ°Men+ / Me
lg CMen+ , где n заряд Ме
n
CMen+ = n α CМ , где n число ионов Ме
2. Сравним φ и определим анод и катод:
φK > φA .
3. Составить схему ГЭ, написать уравнения.
4. Е = φK – φA
5. ∆G = – n·F·E
6. АМ = – ∆G
7. K P 10
n E
0,059
60.
Явления поляризации в ГЭЭДС работающего ГЭ всегда меньше
теоретически рассчитанной. Это явление
обусловлено поляризацией электродов.
Поляризация – смещение
электродных
потенциалов
равновесных значений.
Два типа поляризации:
концентрационная;
химическая.
величин
от
их
61.
В элементе Д.-Я. растворение (окисление)приводит к увеличению концентрации ионов Zn2+
в приэлектродном слое. В результате потенциал
анода увеличивается. У медного электрода
(катода) концентрация ионов Cu2+ уменьшается,
что приводит к снижению потенциала катода.
Изменение потенциала электрода по
сравнению с равновесным значением,
вызванное изменением концентрации
потенциалопределяющих ионов в
растворе, называется концентрационной поляризацией.
62.
В ГЭ Вольта первоначальное значение ЭДС равноразности стандартных потенциалов цинкового и медного
электродов, т.е. 1,1 В.
φ анода увеличивается за счет возрастания в р-ре
концентрации ионов при окислении анода. Анод
поляризуется концентрационно. В то же время
поверхность медного катода насыщается водородом,
образуется «водородный электрод», φ которого имеет
более отрицательное значение по сравнению с медным,
и ЭДС падает до минимального значения 0,76 В.
Поляризация,
вызванная
изменением
химической природы электрода, называется
химической.
63.
При эксплуатации ГЭ важное значение имеетпроцесс устранения поляризации – деполяризация.
Для
уменьшения
поляризации
используется
физическая деполяризация – перемешивание
раствора, механическое удаление газа; а также
химические
деполяризаторы
–
вещества,
вступающие
в
реакцию
с
продуктами,
обусловливающими поляризацию.
Например, химическая поляризация, вызванная
выделением водорода, снижается под действием
сильных окислителей. В элементе Вольта при
добавлении в катодное пространство K2Cr2O7
протекает ОВР, в результате которой водород
окисляется и выводится из сферы электродной
реакции, что приводит к увеличению ЭДС.






















































 Химия
Химия