Похожие презентации:
Агрегатное состояние вещества. Газообразные вещества
1.
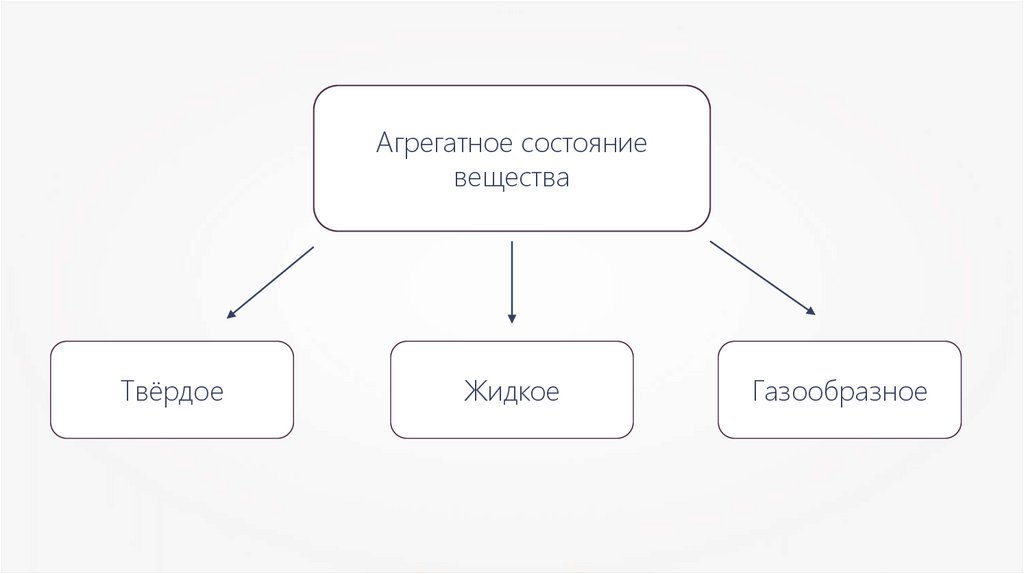
Агрегатное состояниевещества
Твёрдое
Жидкое
Газообразное
2.
Испарение — переход из жидкогосостояния в газообразное.
Жидкое
Конденсация — переход из
газообразного в жидкое или твёрдое
состояние.
Сублимация (возгонка) — переход из
твёрдого состояния в газообразное,
минуя жидкую фазу.
сублимация
Твёрдое
Газообразное
десублимация
3.
Расстояние между молекуламив разных агрегатных состояниях
Газообразное
Жидкое
Твёрдое
4.
Объём, который занимают молекулы газа(при одинаковых условиях), зависит только
от числа молекул газа, а не от конкретного
вида этих молекул. Поэтому одинаковые
количества молекул разных газов должны
занимать одинаковые объёмы при данных
температуре и давлении.
Амедео Авогадро
1776–1856 гг.
5.
Закон Авогадро:В равных объёмах различных газов
при постоянных температуре и
давлении содержится одинаковое
число молекул.
Амедео Авогадро
1776–1856 гг.
6.
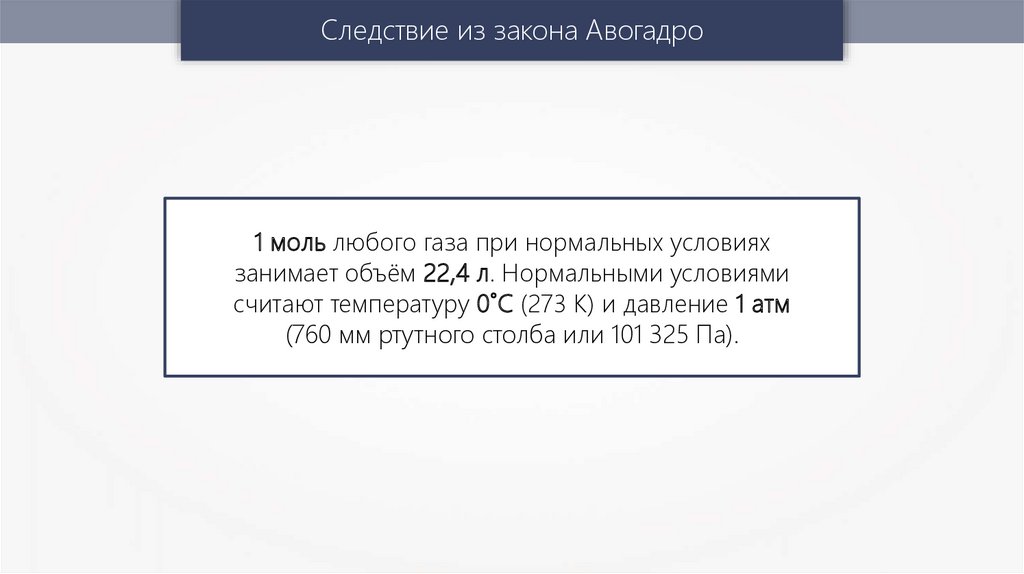
Следствие из закона Авогадро1 моль любого газа при нормальных условиях
занимает объём 22,4 л. Нормальными условиями
считают температуру 0˚С (273 K) и давление 1 атм
(760 мм ртутного столба или 101 325 Па).
7.
Разные газы могут легко смешиваться другс другом в любых соотношениях. Наиболее
важные природные смеси газов — воздух
и природный газ.
8.
Состав воздуха9.
Состав природного газа, которыйобразуется в недрах Земли, не так
постоянен и зависит от месторождения,
но всё же основными его компонентами
являются предельные углеводороды:
метан и его гомологи (этан, пропан,
бутан).
10.
Природный газ является дешёвым,экологически чистым, энергетически
и экономически выгодным топливом.
11.
12.
Применение водорода– использование в химической промышленности в
процессе производства аммиака, хлороводорода;
– получение маргарина;
– водородная резка и сварка металлов;
– топливо для двигателей космических кораблей;
– экологически чистое топливо будущего.
13.
Лабораторный способ получения водородаZn + 2НСl = ZnСl2 + Н2↑
14.
15.
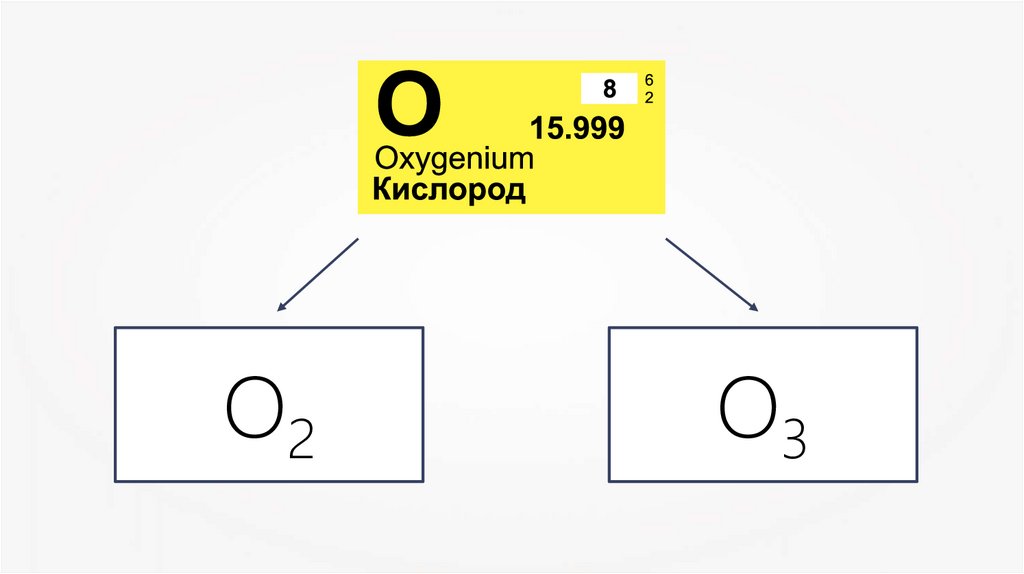
О2О3
16.
Лабораторный способ получения кислородаРазложение перманганата калия:
2KMnO4 → K2MnO4 + MnO2 + O2↑
Разложение пероксида водорода:
2H2O2 → 2H2O + O2↑
MnO2
17.
Главные особенности кислорода —это поддержание процессов дыхания
и горения, на чём и основано его
применение.
18.
Озон (О3) — газ голубого цвета соспецифическим запахом. Слой,
находящийся на высоте от 12 до 50 км,
защищающий Землю от воздействия
ультрафиолетовых солнечных лучей,
состоит из озона.
19.
20.
21.
Парниковый эффект — нагревание внутренних слоёватмосферы Земли, обусловленное прозрачностью
атмосферы для основной части излучения Солнца и
поглощением атмосферой части теплового излучения
поверхности планеты, нагретой Солнцем.
22.
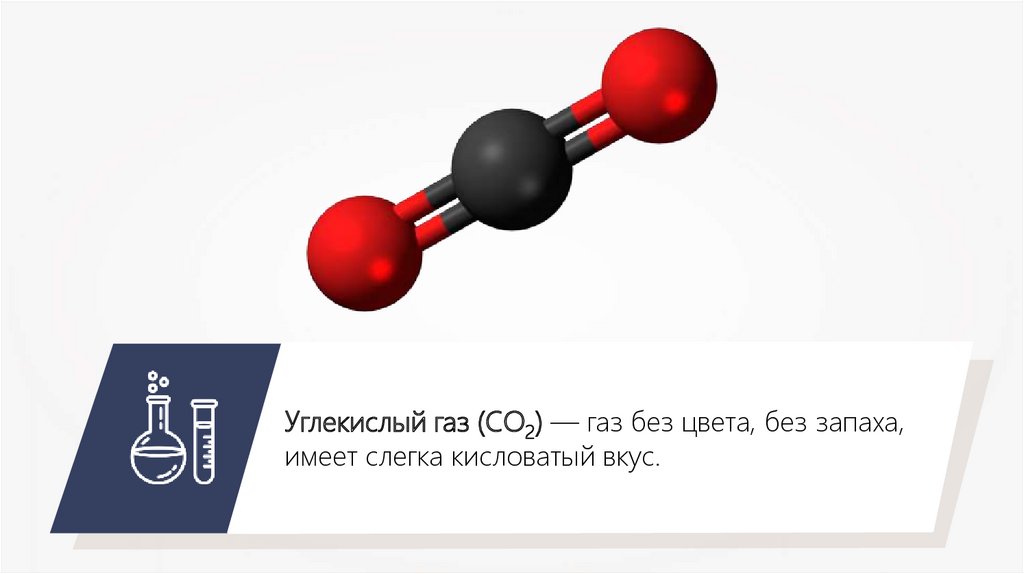
Углекислый газ (СО2) — газ без цвета, без запаха,имеет слегка кисловатый вкус.
23.
Получение углекислого газаВ промышленности:
CaCO3 → CaO + CO2↑
t
В лаборатории:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
24.
Качественная реакция на углеродCa(OH)2 + CO2 → CaCO3↓ + H2O
25.
Углекислый газ не поддерживает процессгорения, поэтому он активно используется
в тушении пожаров. С использованием
углекислого газа делают газированные
напитки, получают «сухой лёд»,
используемый для охлаждения и хранения
продуктов питания.
26.
Лабораторный способ получения аммиакаNH4Cl + NaOH → NH3↑ + NaCl + H2O
2NH4Cl + CaOH2 → CaCl2 + 2NH3↑ + 2H2O
27.
Аммиак — бесцветный газ с резким характернымзапахом, легче воздуха (из-за этого его собирают
методом вытеснения воздуха, располагая сосуд
дном вверх).
28.
Способы распознавания аммиака1. По характерному запаху (запах нашатырного спирта).
2. По изменению окраски влажной лакмусовой
бумажки с красного цвета на синий.
3. По появлению дыма при поднесении стеклянной
палочки, которую предварительно окунули в соляную
кислоту.
29.
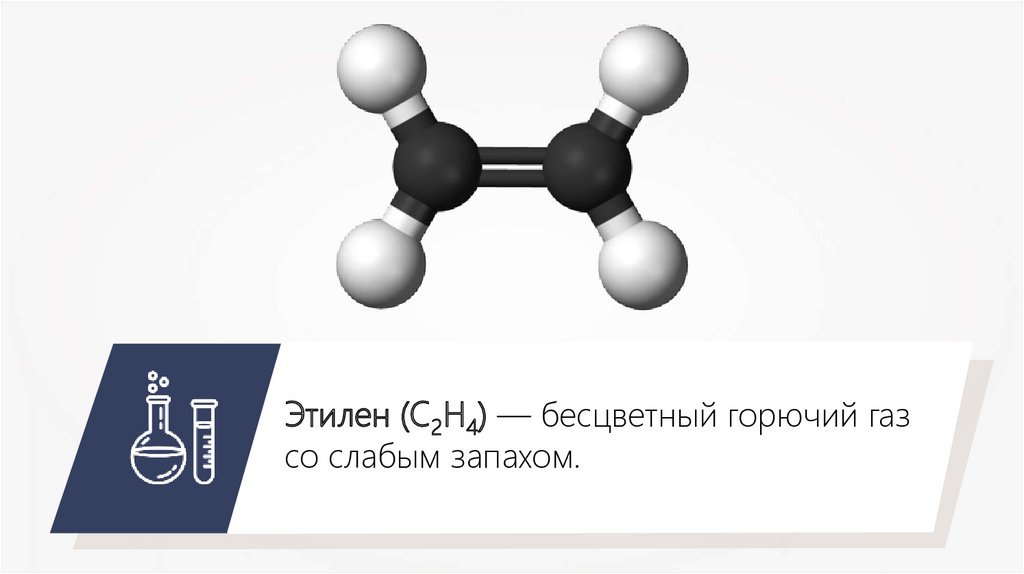
Этилен (С2Н4) — бесцветный горючий газсо слабым запахом.
30.
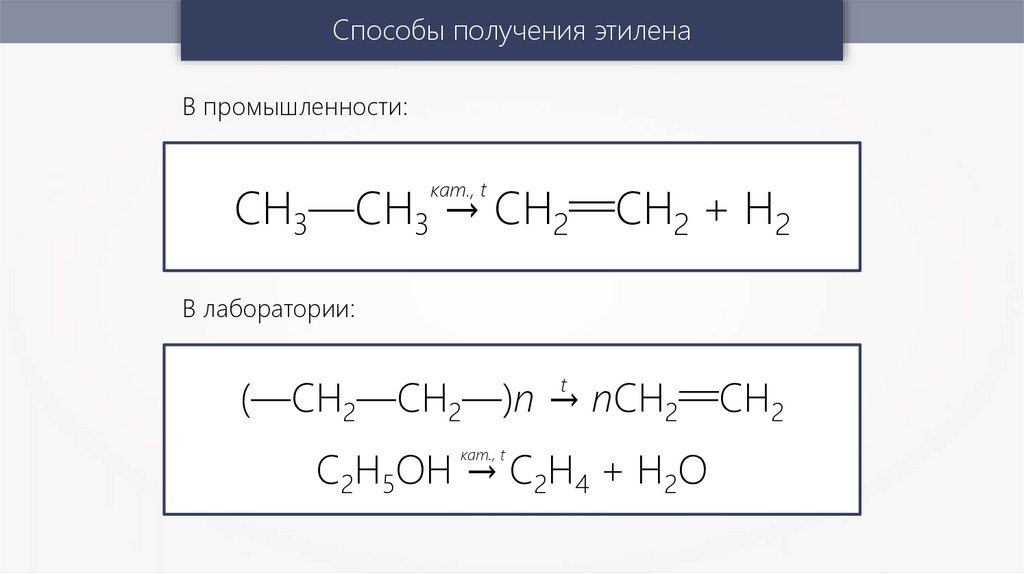
Способы получения этиленаВ промышленности:
СН3—СН3 → СН2—
—СН2 + Н2
кат., t
В лаборатории:
— 2
(—СН2—СН2—)n → nСН2—СН
t
С2Н5ОН → С2Н4 + Н2О
кат., t
31.
Реакция распознавания этиленаC2H4 + Br2 → C2H4Br2
























 Химия
Химия








