Похожие презентации:
Газообразные вещества
1.
ГАЗООБРАЗНЫЕ ВЕЩЕСТВА2.
Агрегатные состояния веществаБольшинство веществ в зависимости от условий
могут находиться в одном из трех агрегатных
состояний: газообразном, жидком или твердом.
Например, вода встречается в трех фазовых
состояниях: водяной пар, жидкость, лед.
3.
Слово «газ» происходит от греческого «хаос», этоттермин ввел в XVII веке нидерландский
естествоиспытатель Ян Баптист Ван Гельмонт.
Свойства газов
Характерная особенность газового состояния заключается
в том, что частицы газа не удерживаются вместе, а
свободно движутся в объеме, значительно превышающем
объем самих частиц.
Слабое межмолекулярное взаимодействие определяет
малую плотность газа и его основные характерные
свойства – стремление к безграничному расширению и
способность оказывать давление на стенки сосуда,
препятствующее этому стремлению.
Газы легко сжимаются. При этом изменяется
межмолекулярное состояние.
Состояние газа полностью характеризуется его
температурой, давлением, объемом, массой и молярной
массой.
4.
Закон Гей-ЛюссакаПервые количественные исследования реакций
между газами принадлежат французскому ученому
Гей-Люссаку, автору известного закона о тепловом
расширении газов.
Измеряя объемы газов, вступающих в реакцию и
образующихся в результате реакции, Гей-Люссак
пришел к обобщению, известному под названием
закона простых объемных отношений или
«химического» закона Гей-Люссака.
5.
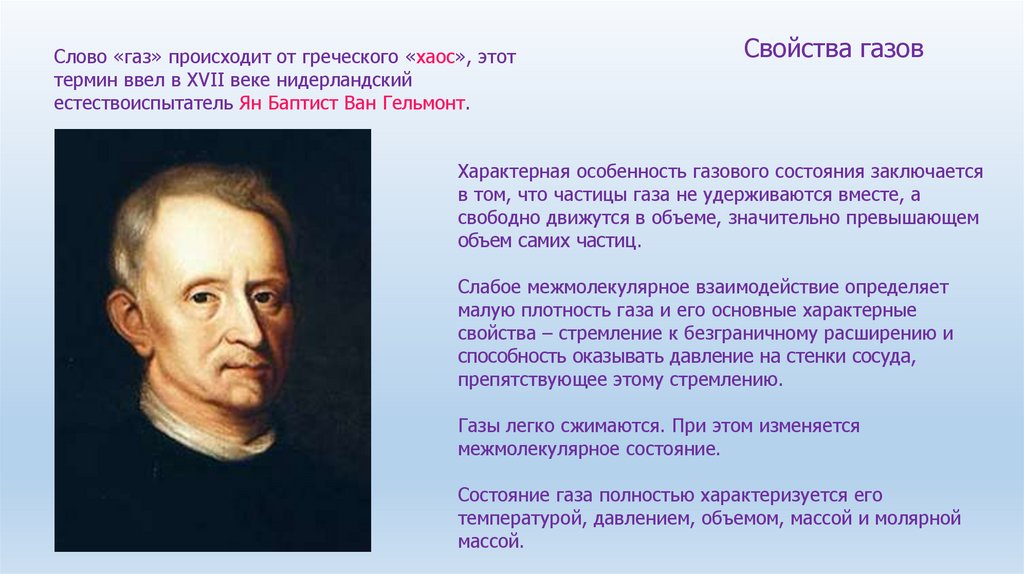
Закон объемных отношений (Закон Гей-Люссака) гласит:Объемы вступающих в реакцию газов относятся друг к другу и у объемам образующихся
газообразных продуктов реакции как небольшие целые числа.
Например, при взаимодействии 2 объемов водорода и 1 объема кислорода образуются 2
объема водяного пара. Конечно, при этом предполагается, что все измерения объемов
проведены при одном и том же давлении и при одной и той же температуре.
6.
В 1811 г. итальянский физик Авогадро объяснил простые отношениямежду объемами газов, наблюдающиеся при химических реакциях.
Закон Авогадро гласит:
В равных объемах любых газов, взятых при одной и той же
температуре и при одинаковом давлении, содержится одно и то же
количество молекул.
Именно закон Авогадро позволил сделать выводы о числе атомов в
молекулах газов. В частности, на его основе было предположено, что
молекулы таких газов, как водород, хлор, кислород, азот состоят из
двух атомов.
Из этого закона вытекает важное следствие: 1 моль любого газа при
нормальных условиях (760 мм.рт.ст. и 0°С) занимает объем 22,4 л. Этот
объем называют молярным объемом газов:
VM=22,4 л/моль
Молярный объем вещества —отношение объема, занимаемого
веществом, к его количеству.
Закон Авогадро
7.
ВодородВодород Н2 – самый легкий газ. Его используют для производства аммиака,
хлороводорода, получения маргарина, водородной резки и сварки металлов, в
качестве топлива для двигателей космических кораблей.
Водород – это перспективное экологически чистое автомобильное топливо. В
лаборатории водород получают чаще всего в аппарате Киппа взаимодействием
цинка с соляной кислотой:
Так как водород самый легкий из
газ, его собирают в перевернутый
вверх дном сосуд.
Смесь двух объемов водорода и
одного объема кислорода называют
гремучим газом, так как она при
поджигании взрывается.
8.
Кислород О2 составляет 21%атмосферы, в верхних слоях которой
содержится аллотропное
видоизменение кислорода – озон О3.
Атмосферный озон активно поглощает
ультрафиолетовые лучи. Атмосфера,
благодаря содержащемуся в ней озону,
углекислому газу и водяному пару,
малопроницаема для инфракрасного
излучения Земли. Состав атмосферы
может изменяться в результате
антропогенного загрязнения.
Оксиды серы и азота образуют
азотную и серные кислоты, которые
выпадают в виде кислотных дождей и
вызывают гибель растений, животных,
наносят вред архитектурным
памятникам и разрушают
металлические крыши и мосты.
Кислород
9.
Парниковый эффект – нагревание внутреннихслоев атмосферы Земли, обусловленное
прозрачностью атмосферы для основной части
излучения Солнца и поглощением атмосферой
части теплового излучения поверхности
планеты, нагретой Солнцем.
Парниковый эффект приводит к глобальному
потеплению климата.
10.
Основные области применения кислорода – этодыхание и горение.
В лаборатории кислород получают разложением
перманганата калия:
или пероксида водорода:
В лаборатории кислород получают разложением перманганата калия или
пероксида водорода.
Собирают кислород в сосуд методом вытеснения воздуха или методом
вытеснения воды, так он в ней малорастворим.
11.
Углекислый газУглекислый газ СО2 широко применяют для изготовления
шипучих напитков, тушения пожаров и получения
«сухого льда», который используют для охлаждения и
хранения продуктов питания.
В промышленности углекислый газ получают обжигом
известняка:
В лаборатории оксид углерода получают действием
соляной кислоты на мрамор:
Собирают углекислый газ в сосуд методом
вытеснения воздуха, т.к. оксид углерода
почти в 1,5 раза тяжелее
Распознать углекислый газ можно или с
помощью горящей личинки, которая гаснет в
атмосфере, или по помутнению известковой
воды
12.
Этилен (С2Н4, или СН2=СН2) применяютдля получения других органических
соединений: в овощехранилищах для
ускорения созревания плодов,
производство полиэтилена,
растворителей, уксусной кислоты,
спиртов
13.
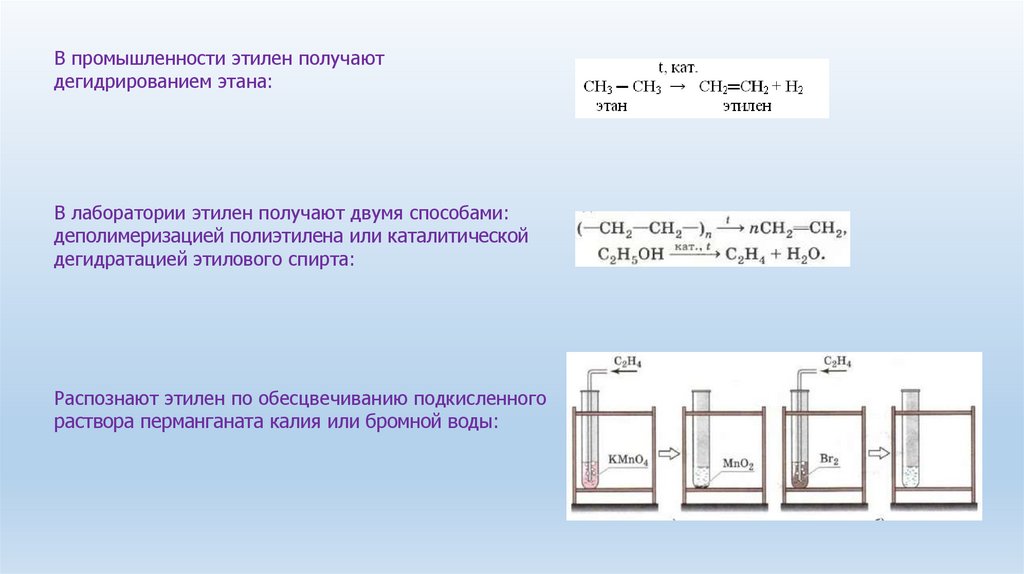
В промышленности этилен получаютдегидрированием этана:
В лаборатории этилен получают двумя способами:
деполимеризацией полиэтилена или каталитической
дегидратацией этилового спирта:
Распознают этилен по обесцвечиванию подкисленного
раствора перманганата калия или бромной воды:










 Химия
Химия