Похожие презентации:
Информационное письмо для студентов дистанционного обучения фармацевтического факультета по дисциплине «Аналитическая химия»
1.
Информационное письмо длястудентов дистанционного обучения
фармацевтического факультета по
дисциплине «Аналитическая химия»
Весенний семестр
2. Титульный лист
Федеральное государственное бюджетное образовательное учреждение высшего образования«Оренбургский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
ФГБОУ ВО ОрГМУ Минздрава России
Кафедра фармацевтической химии
Контрольная работа по дисциплине «Аналитическая химия»
Студента (номер группы)
ФИО
Модуль 2,3. Количественный анализ. Инструментальные (физико-химические) методы анализа
Вариант № (номер варианта)
Проверил доцент к.б.н. Шостак Е.И.
Оренбург, 2022
3. Оформление контрольной работы
ФИО, номер группыДата выполнения контрольной работы
Формулировка вопросов
33. Перманганатометрическое титрование. Титрант, его приготовление, стандартизация. Установление конечной
точки титрования. Применение перманганатометрии.
или
33. Перманганатометрическое титрование. Титрант, его приготовление, стандартизация. Установление
конечной точки титрования. Применение перманганатометрии.
или
33. Перманганатометрическое титрование. Титрант, его приготовление, стандартизация. Установление
конечной точки титрования. Применение перманганатометрии.
Нумерация и формулировка вопросов даны в информационном письме, которые сохраняются в вашей работе. При
оформлении вопросов могут быть другие варианты, но оформление должно быть одинаково во всей контрольной
работе.
4. Оформление расчетов в окислительно-восстановительных реакциях
Оформление расчетов в окислительновосстановительных реакцияхОпределить молярную массу эквивалентов окислителя и
восстановителя в реакции:
5Н2С2О4 + 2МnО4- + 6Н+ =2Мn2+ + 10СО2 + 8Н2О
Запишем соответствующие полуреакции и суммарную реакцию в
молекулярной и ионной формах:
5Н2С2О4 + 2КМnО4 + 3H2SO4 = 2MnSO4 + 10CO2 + 8H2O + K2SO4
MnO4- + 5e + 8H+ = Mn2+ + 4H2O……5….2 f э(КМnО4) = 1/5
Н2C2O4 – 2e = 2CO2 + 2Н+ …………….2….5 fэ (H2C2O4) = 1/2
5Н2С2О4 + 2МnО4- + 6Н+ =2Мn2+ + 10СО2 + 8Н2О
Молярная масса эквивалента для реагента в ОВ процессе равно его
молярной массе, деленной на число электронов в соответствующей
полуреакции:
M(1/2 H2C2O4) = М(Н2С2О4)/2 =45 г/моль
М (1/5 КМnO4) = M(КMnO4)/5 =31,608 г/моль
5. Оформление расчетов в задачах
Расчет по закону эквивалентов при прямом титрованииПри аргентометрическом определении хлорид-ионов на титрование 20,00 мл раствора
хлорида натрия затрачено 18,00 мл стандартизованного раствора нитрата серебра с
молярной концентрацией 0,0459 моль/л. Рассчитайте молярную концентрацию, титр
раствора хлорида натрия и массу хлорида натрия в растворе.
NaCl + AgNO3 = AgCl↓ + NaNO3
n(NaCl ) = n( AgNO3 )
C( NaCl ) ∙ V( NaCl ) = С(AgNO3) ·V(AgNO3)
C( NaCl ) = С(AgNO3) ·V(AgNO3 )/ V( NaCl )
C( NaCl ) = 0,0459 моль/л · 18,00 мл/ 20,00 мл = 0,0413 моль/л
Т (NaCl) = С( NaCl ) ∙ M( NaCl ) ∙10-3 = 0,0413 моль/л · 58,5 г/моль· 10-3 =
0,002416 г/мл
m(NaCl) = C(NaCl) ∙ M(NaCl) ∙ VК = 0,0413 моль/л ∙ 58,5 г/моль ∙ 0,02 л = 0,0483г
6. Оформление расчетов в задачах
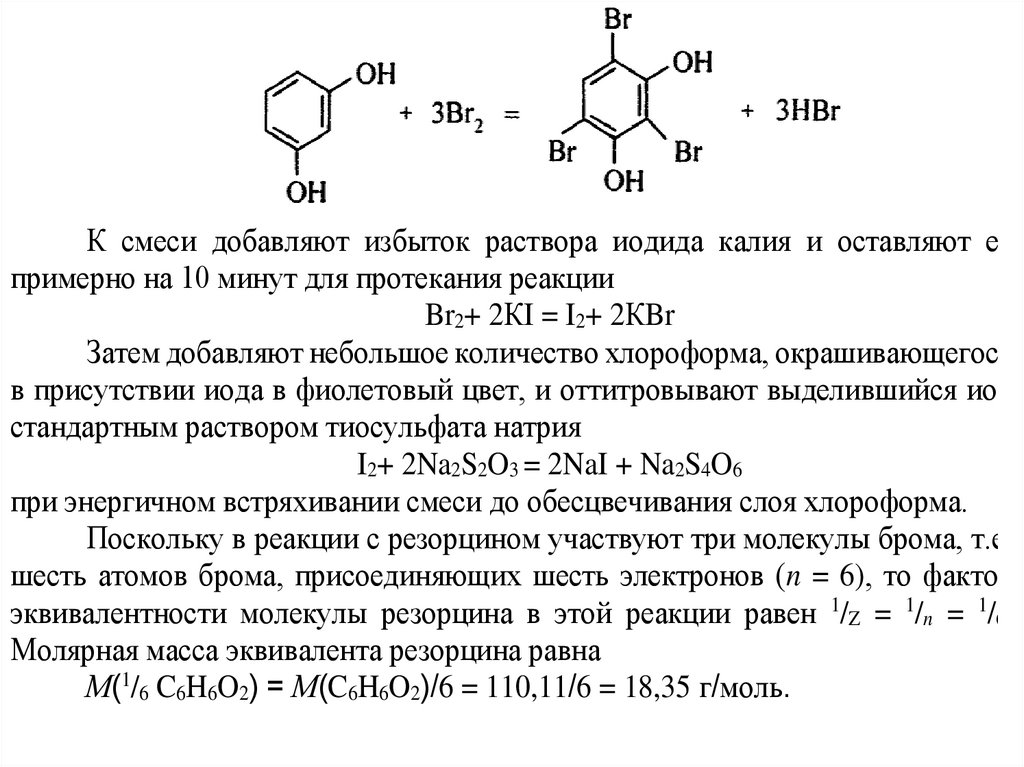
При бромометрическом определении резорцина С6Н6О2 (молярная масса110,11) с иодометрическим окончанием исходную навеску анализируемого
препарата массой 0,1842 г растворили в 100 мл воды. Из полученного
раствора отобрали аликвоту 20 мл, прибавили 40 мл стандартного раствора
бромата калия с молярной концентрацией эквивалента 0,1 моль ̸ л, раствор
бромида калия, серную кислоту и через ̴ 15 минут – раствор иодида калия.
Выделившийся иод через ̴ 10 минут оттитровали стандартным 0,1 моль ̸ л
раствором тиосульфата натрия. На титрование израсходовано 36,67 мл
раствора тиосульфата натрия. Рассчитайте массу и массовую долю
резорцина в исходной навеске препарата.
Решение:
КВr+5O3 + 5КВr - + 3Н2SO4 = 3Br02+ 3К2SO4 + 3Н2O
BrO3- + 6е + 6Н+ = Вr -+ 3Н2O, fэ(КВrO3) = 1/6, в полуреакции пишем
Вr - потому что бром реагирует по реакции 2 с образованием аниона
2Вr- - 2е =Вr02
7.
К смеси добавляют избыток раствора иодида калия и оставляют еепримерно на 10 минут для протекания реакции
Br2+ 2КI = I2+ 2КBr
Затем добавляют небольшое количество хлороформа, окрашивающегося
в присутствии иода в фиолетовый цвет, и оттитровывают выделившийся иод
стандартным раствором тиосульфата натрия
I2+ 2Na2S2O3 = 2NaI + Na2S4O6
при энергичном встряхивании смеси до обесцвечивания слоя хлороформа.
Поскольку в реакции с резорцином участвуют три молекулы брома, т.е.
шесть атомов брома, присоединяющих шесть электронов (n = 6), то фактор
эквивалентности молекулы резорцина в этой реакции равен 1/Z = 1/n = 1/6.
Молярная масса эквивалента резорцина равна
М(1/6 C6H6O2) = М(C6H6O2)/6 = 110,11/6 = 18,35 г/моль.
8.
Выделившийся иод оттитровывают стандартным раствором тиосульфатанатрия:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Расчеты проводят, исходя из закона эквивалентов с учетом полуреакций:
I2 + 2е = 2I-; z = n = 2, fэ(I2) = ½
2S2O32- ‒ 2е = S4O62-; z = n/2 = 2/2 = 1, fэ(Na2S2O3) = 1
В последней полуреакции два тиосульфат-иона отдают вместе два
электрона, поэтому для одного тиосульфат-иона z = n/2 = 2/2 = 1.
9.
Расчетыконцентрации
и
массы
резорцина
в
анализируемом растворе проводятся обычным способом на
основе закона эквивалентов:
n(1/6 КВrO3) = n(1/2 Вr2) = n(1/6 C6H6O2) + n(1/2 I2), по
реакциям 1, 2, 3
n(1/2 I2) = n(Na2S2O3), по реакции 4
n(1/6 КВrO3) = n(1/6 C6H6O2) + n(Na2S2O3), по реакциям 1-4
с(1/6 КВrO3)V (КВrO3) = с(1/6 C6H6O2)V (C6H6O2) + с(Na2S2O3)V (Na2S2O3),
с(1/6 C6H6O2) = [с(1/6 КВrO3)V (КВrO3) - с(Na2S2O3)V (Na2S2O3)]/V (C6H6O2),
10.
C(1/6C6H6O2)=
C(1/6 C6H6O2) =
C(1/6 KBrO₃) · V(KBrO₃) − C(Na₂S₂O₃) · V(Na₂S₂O₃)
V(C₆H₆O₂)
0,1 моль ̸ л · 40 мл − 0,1 моль ̸ л · 36,67мл
20 мл
= 0,0167 моль ̸ л
m(C6H6O2) = C(1/6 C6H6O2) · M(1/6 C6H6O2) · V к (C6H6O2)
m(C6H6O2) = 0,0167 моль ̸ л · 18,352 г ̸ моль · 0,1 л = 0,0306 г
w(C6H6O2) =
m(пр)
m(теор)
· 100%
w(C6H6O2) =
0,0306 г
0,1842 г
· 100% = 15,6%
Ответ: w(C6H6O2) = 16,6%
m(C6H6O2) = 0,0306 г










 Химия
Химия








