Похожие презентации:
Карбоновые кислоты. Тема 7
1. Карбоновые кислоты
2.
Карбоновые кислоты – производные углеводородов , всостав молекул которых входит одна или несколько
карбоксильных групп.
2
3.
Классификация1. По числу карбоксильных групп.
Одноосновные
Двухосновные
3
4.
НоменклатураСистематическая номенклатура - два способа построения названий
карбоновых кислот:
Способ I. Названия карбоновых кислот образуют от названия
родоначальных углеводородов с тем же числом атомов углерода, считая
атом углерода карбоксильной группы, суффикса –ов-, окончания –ая и
слова «кислота».
Способ II. Названия карбоновых кислот образуют от названия
родоначальных углеводородов считая карбоксильную группу
заместителем. Таким образом к названию углеводородного радикала
прибавляют окончание –карбоновая и слово «кислота».
4
5.
Способ I.2,2-диметилпропановая кислота
Способ II.
2, 2-метилпропан-карбоновая кислота
5
6.
Случайная номенклатураПри образовании названий карбо-новых кислот положение радикалов
обо-значают буквами греческого алфавита (α, β, γ, δ, ε т.д.) начиная с атома
углерода, соседнего с карбоксильной группой.
α,α-диметилпропановая кислота
6
7.
ИзомерияИзомерия насыщенных карбоновых кислот
определяется строением углеводородного радикала
(структурная изомерия).
Кислоты с числом углеродных атомов меньше четырех не
имеют изомеров.
7
8.
Реакции окисления.Окисление алканов. Практическое значение имеет каталитическое
окисление метана до муравьиной кислоты. Другие алканы при окислении
претерпевают разрыв углеводородной цепи примерно посередине.
Практическое значение имеет окисление твердых алканов – парафинов.
При этом алканы с длинной цепью (более 25 атомов С) под действием О2
воздуха в присутствии солей тяжелых металлов превращаются в смесь
карбоновых кислот с длиной цепи С12 – С18. Эти кислоты затем
используются для изготовления мыла.
8
9. Способы получения
Окисление алкенов. Алкены с неразветвленной углеродной цепочкойокисляются по месту двойной связи с образованием карбоновых кислот:
В качестве окислителя используется кипящий раствор KMnO4 или кислород
воздуха в присутствии катализатора и при нагревании.
9
10. Способы получения
1011.
Способы полученияОкисление первичных спиртов и альдегидов. Первичные спирты при
окислении первоначально превращаются в альдегиды и далее в карбоновые
кислоты:
В качестве окислителей используются растворы перманганата или
бихромата калия (КМnO4 или К2Сr2O7), раствор оксида хрома (VI) в
серной кислоте.
11
12.
- гидролиз сложных эфиров и других функциональных производныхкарбоновых кислот
12
13.
- карбоксилирование алкенов и алкинов13
14.
Химические свойства.Электронное строение карбоксильной группы.
В карбонильной группе связь С=О полярная. Электронная плотность
от атома С смещена к атому О, поэтому на карбонильном С появляется
частично «+» заряд.
Стремясь компенсировать свой заряд, атом С притягивает к себе
неподеленную электронную пару атома О группы ОН.
В свою очередь атом О оттягивает электронную плотность связи О-Н,
в результате чего атом Н становится подвижным и его отрыв в виде протона
облегчается.
Поэтому карбоновые кислоты имею кислотные свойства.
14
15. Химические свойства
В молекулах карбоновых кислот p-электроны атомов кислородаОН-группы взаимодействуют с электронами -связи
карбонильной группы С=О, в результате упрочняется -связь в
карбонильной группе.
Упрочнение -связи в карбонильной группе С=О приводит к тому,
что реакции присоединения для карбоновых кислот
нехарактерны.
15
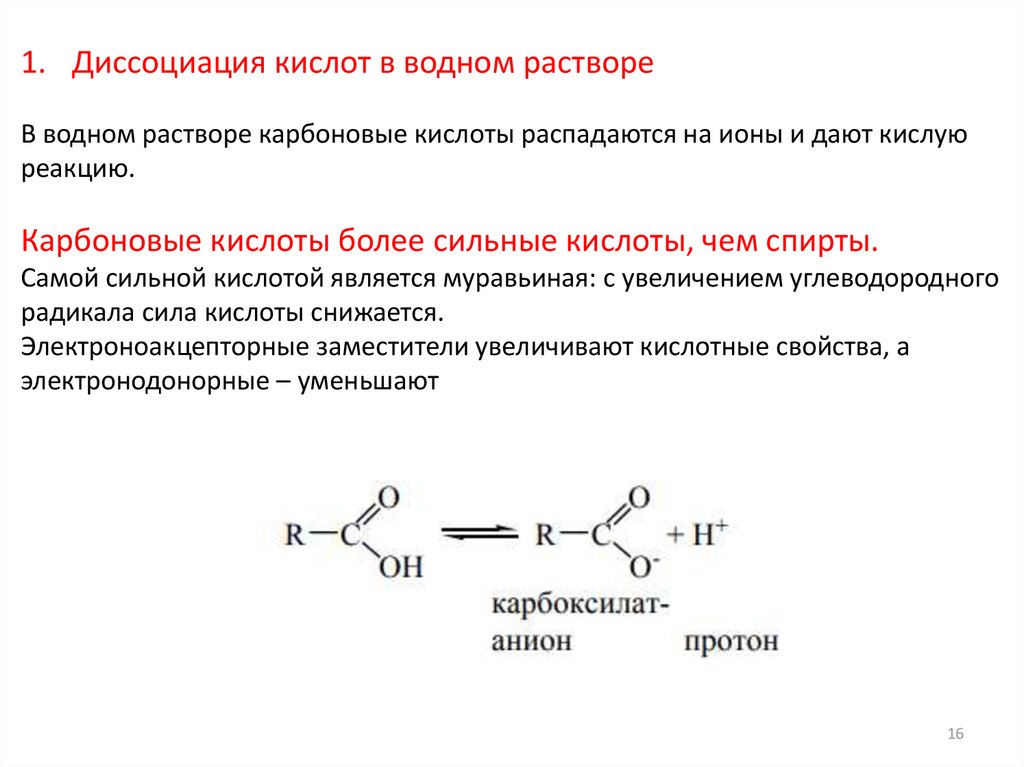
16.
1. Диссоциация кислот в водном раствореВ водном растворе карбоновые кислоты распадаются на ионы и дают кислую
реакцию.
Карбоновые кислоты более сильные кислоты, чем спирты.
Самой сильной кислотой является муравьиная: с увеличением углеводородного
радикала сила кислоты снижается.
Электроноакцепторные заместители увеличивают кислотные свойства, а
электронодонорные – уменьшают
16
17.
2. Кислотные свойства - образование солей с активнымиметаллами, щелочами, оксидами металлов, солями слабых
кислот
17
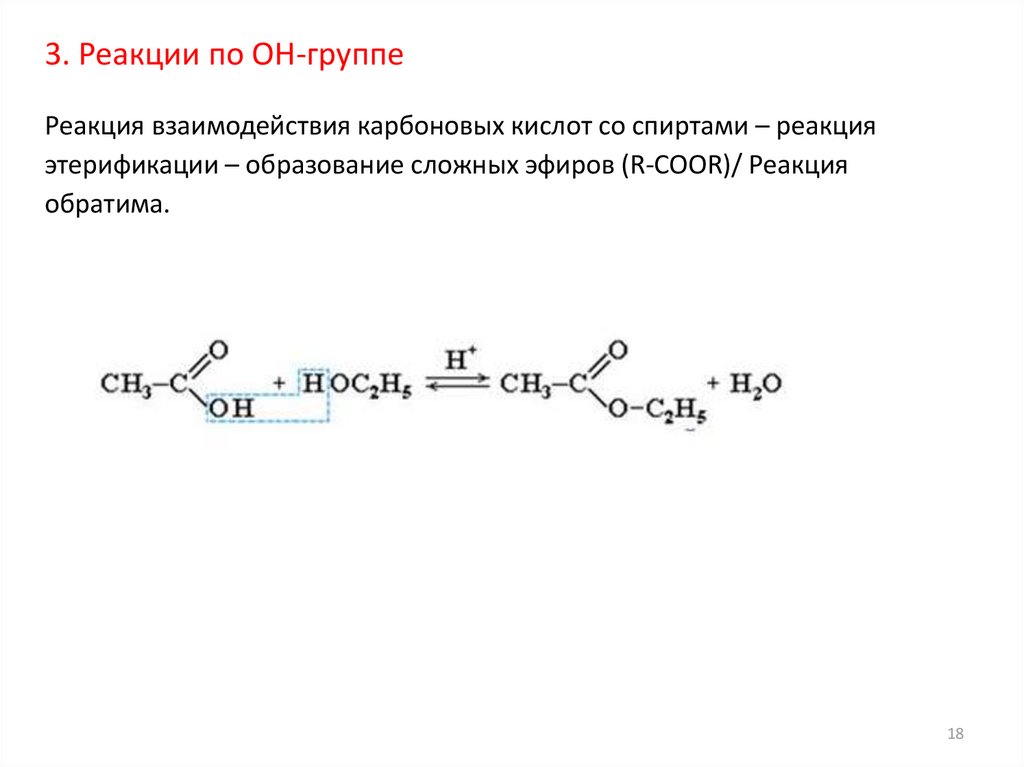
18.
3. Реакции по ОН-группеРеакция взаимодействия карбоновых кислот со спиртами – реакция
этерификации – образование сложных эфиров (R-COOR)/ Реакция
обратима.
18
19.
4. Реакции по углеводородному радикалу- замещениеводорода у -углеродного атома
19
20.
5. Окисление карбоновых кислотГорение
20
21.
Способы получения⚫1.
Из галогенкарбоновых кислот (дегидро-галогенирование).
⚫2. Окисление непредельных альдегидов.
21
22.
Химические свойстваНенасыщенные одноосновные кислоты вступают во все реакции,
характерные для кислот.
В связи с наличием кратной связи вступают в реакции
присоединения, окисления, полимеризации.
α-ненасыщенные кислоты отличаются особенностями в
химическом поведении. Например: присоединение галогеноводородов и
воды протекает против правила Марковникова.
22
23.
⚫Реакции присоединения (воды, спиртов, аммиака).Окисление
23
24.
Полимеризация24
25. Химические свойства
⚫Реакции карбоксильной группы.Для аренкарбоновых кислот характерны все реакции насыщенных
карбоновых кислот в карбоксильной группе.
⚫Реакции в углеводородном остатке.
Карбоксильная группа является заместителем второго рода и направляет
вхождение второго заместителя в метаположение.
метанитробензойная
кислота
25
26.
Дикарбоновые кислоты26
27.
Изомерия⚫1. Структурная изомерия насыщенных алифатических
двухосновных карбоновых кислот.
⚫2. У ненасыщенных кислот имеет место геометрическая
изомерия.
⚫3. У ароматических двухосновных кислот изомерия также
изомерия положения карбоксильных групп.
27
28.
Способы получения⚫ Для получения двухосновных кислот используют те же
методы, что и для одноосновных. Например:
28
29. Химические свойства
⚫Все дикарбоновые кислоты более сильные кислоты,
чем одноосновные с тем же числом атомов углерода.
⚫
Кислотность 2-х основных кислот тем выше, чем
короче цепь атомов углерода, связывающих
карбоксильные группы.
⚫
Щавелевая кислота – самая сильная.
29
30.
Химические свойстваДвухосновные кислоты вступают во все химические
реакции, характерные для одноосновных кислот:
Например: образование солей.
⚫ Декарбоксилирование.
30
31. Отличительные реакции характерные только для двухосновных кислот
Отношение к нагреванию.Декарбоксилирование (отщепление СО2):
31
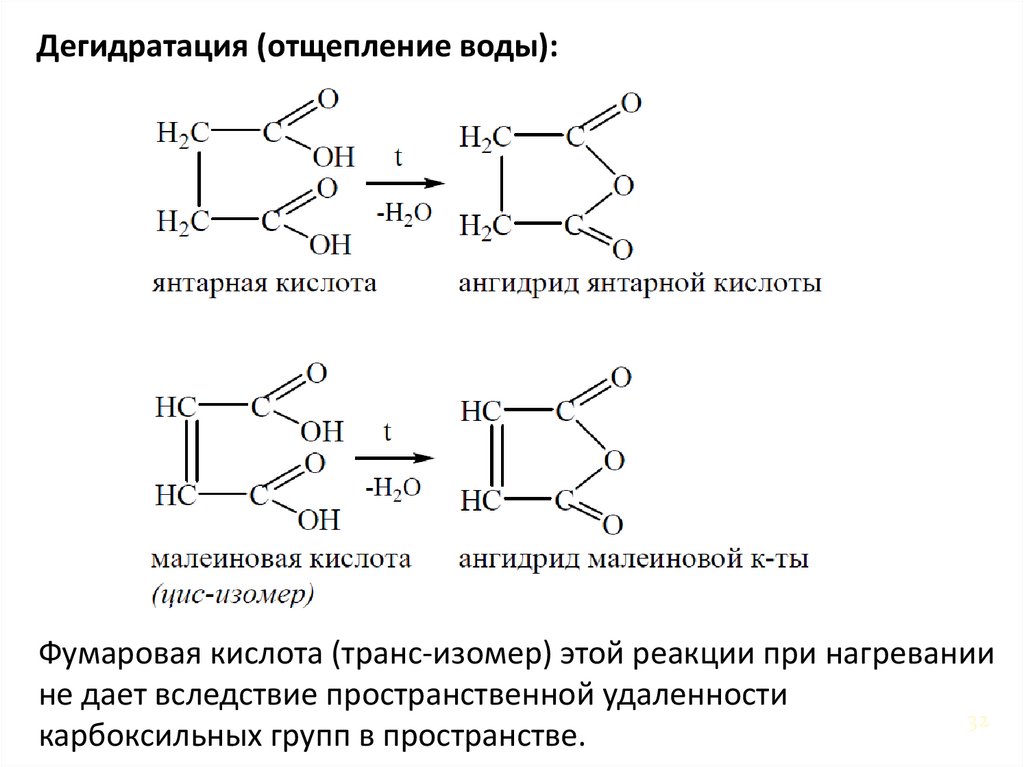
32.
Дегидратация (отщепление воды):Фумаровая кислота (транс-изомер) этой реакции при нагревании
не дает вследствие пространственной удаленности
32
карбоксильных групп в пространстве.
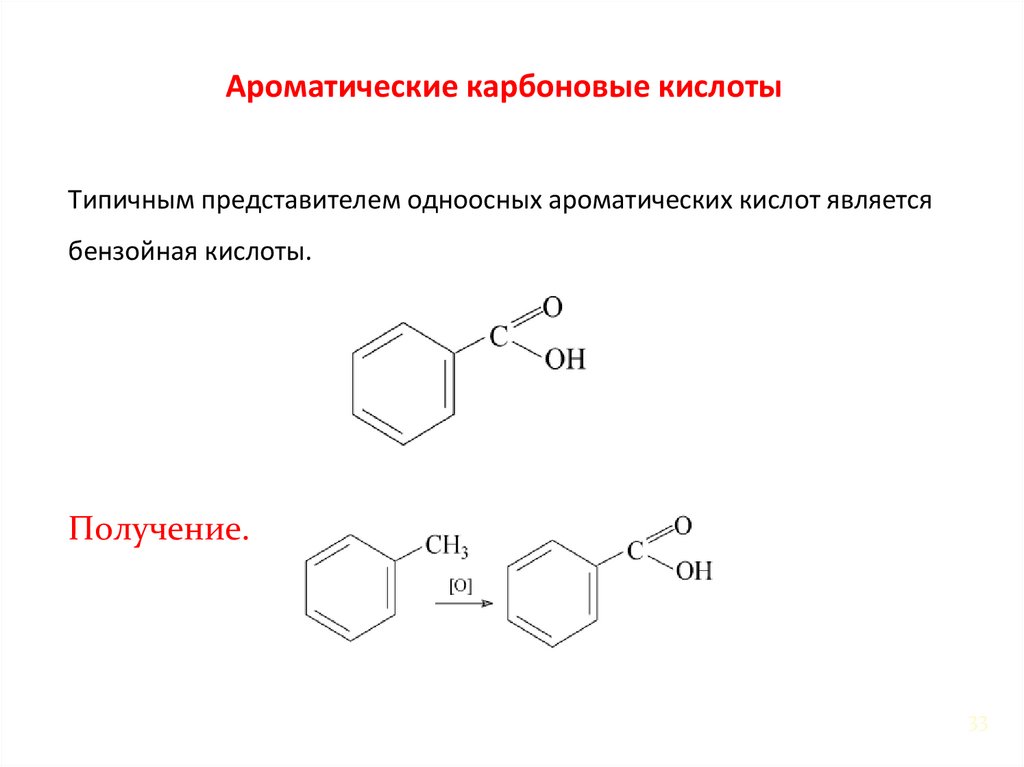
33.
Ароматические карбоновые кислотыТипичным представителем одноосных ароматических кислот является
бензойная кислоты.
Получение.
33
34.
Химические свойства⚫Реакции карбоксильной группы.
Для аренкарбоновых кислот характерны все реакции насыщенных
карбоновых кислот в карбоксильной группе.
⚫Реакции в углеводородном остатке.
Карбоксильная группа является заместителем второго рода и направляет
вхождение второго заместителя в метаположение.
34






























 Химия
Химия








