Похожие презентации:
Буферные растворы
1. Буферные растворы
2.
• Расчет рН растворов электролитов проводится по следующим(упрощенным) формулам:
• сильных одноосновных кислот
• pH = – lgC кислоты
(1)
• слабых кислот (одноосновных или по 1-й ступени)
• pH = 1/2pK кислоты – 1/2 lgC кислоты
(2)
• сильных однокислотных оснований
• pH = 14 + lgC основания
(3)
• слабых оснований (однокислотных или по 1-й ступени)
• pH = 14 – 1/2pKоснования + 1/2 lgC основания
(4)
• солей слабых кислот
• pH = 7 + 1/2pKкислоты + 1/2 lgC соли
(5)
• солей слабых оснований
• pH = 7 – 1/2 pK основания – 1/2 lgC соли
(6)
3.
• Буферные растворы (смеси) - это растворы, рН которыхмало изменяется при добавления небольших количеств
сильной кислоты или щелочи и почти не зависит от
разбавления
• Буферные растворы применяют в химическом анализе в
том случае, когда по условиям опыта химическая
реакция должна протекать при соблюдении точного
значения рН, не меняющейся при разбавлении раствора
или при добавлении к нему других реагентов.
4.
Роль буферных систем в живых организмахВ процессе метаболизма в нашем организме выделяется
много кислот – соляная, пировиноградная, молочная. Но в
организме строго сохраняется рН. Постоянство рН
биологических сред поддерживается с помощью различных
механизмов. Поддержание на заданном уровне кислотноосновного равновесия обеспечивается на молекулярном
уровне действием буферных систем.
5.
•Виды буферных смесей :•слабая кислота и ее соль,
•слабое основание и его соль,
•кислая и средняя соль;
•две кислые соли.
6.
Классификация:а) кислотные
1. Ацетатный буфер:
CH3COOH
CH3COONa
pK=4.75
3. Фосфатный буфер:
NaH2PO4
Na2HPO4
pK=7.21
2. Бикарбонатный буфер:
H2CO3
NaHCO3
pK=6.37
б) основные
Аммиачный буфер:
NH4OH
NH4Cl
pK=9.25 (14-4.75)
6
7.
Растворы амфолитов (аминокислот, белков) такжепроявляют буферное действие, при добавлении
некоторого количества кислоты или щелочи:
+ Н+
R–СН–СОО–
NH3+
R–СН–СООН
NH3+
белок-соль
белок-кислота
относят к кислотным буферным системам
26.07.2022
8.
Механизм поддержания рН буферными растворами• Например, ацетатная буферная система состоит из
СН3СООН и СН3СООNa.
• В результате полной диссоциации соли в растворе находится большое количество
анионов СН3СОО-, которые практически полностью подавляют диссоциацию слабой
кислоты:
• СН3СООNa = СН3 СОО- + Na+
• В результате в системе устанавливается химическое равновесие между сопряженной
кислотой СН3СООН и сопряженным основанием СН3 СОО, которому соответствует
определенная концентрация ионов водорода Н+ в данной буферной системе с
соответствующим значение рН среды:
• СН3СООН = СН3 СОО- +Н+
• Если к такому раствору добавить сильную кислоту, то ионы водорода будут
соединяться с анионами СН3СОО- с образованием слабо диссоциирующих молекул
СН3СООН (слабой кислоты) и реакция среды почти не изменится.
• СН3СОО- + Н+ = СН3СООН
Или
• СН3СООН
• СН3СООNa + НС1= NaС1 + СН3СООН
9.
• Если к раствору добавить сильное основание, то гидроксид-ионы будутнейтрализоваться слабой кислотой с образованием молекул воды:
• СН3СООН + ОН- = Н2О + СН3СООили
• СН3СООН + NaОН = Н2О + СН3СООNa
• Добавляемая щелочь заменяется эквивалентным количеством соли,
которая влияет на реакцию среды в меньшей степени, чем NaОН.
Образование небольшого количества воды также не влияет на реакцию
среды. Пошедшие на реакцию с гидроксид-ионами ОН- ионы водорода Н+
пополняются за счёт смещения равновесия реакции диссоциации
СН3СООН вправо:
• СН3СООН → СН3 СОО- +Н+
• В результате рН раствора почти не изменяется.
10.
Или этот процесс можно представить схематично.В ацетатном буферном растворе устанавливается равновесие:
СH3COOH ↔ H+ + СH3COOМожно схематически представить, что буферная способность
данной системы обусловлена наличием двух больших
резервуаров, в одном из которых находится кислота СH3COOH,
а в другом — основание СH3COO- :
Когда в буферный раствор приливают небольшое количество
сильного основания (ОН–), из левого резервуара поступает
кислота,
нейтрализуя
добавленное
основание.
Правый
11
резервуар срабатывает при добавлении кислот (Н+).
11.
Буферная смесь поддерживает рН постоянным только при условии,что количество прибавляемых к раствору сильной кислоты или
щелочи не превышает определенной величины. Предел, в котором
проявляется буферное действие, называется буферной емкостью
C эл ·Vэл
B
pH·Vбуф
Буферная
ёмкость
выражает
количество
молей
эквивалента
сильной кислоты или щелочи,
которое следует добавить к одному
литру буферного раствора, чтобы
сместить его рН на единицу.
где Vэл – объем электролита (добавленных кислоты или щелочи), л.;
Сэл.– молярная концентрации эквивалента электролита (кислоты или щелочи);
Vбуф - объем исходного буферного раствора, л.;
∆рН – изменение рН буферного раствора до и после добавления кислоты или щелочи (по модулю).
После этого раствор практически утрачивает буферное
действие. Дальнейшее добавление сильной кислоты или
щелочи вызывает резкое изменение рН раствора.
12.
Буферная емкость по отношению к кислоте (Вкисл.)определяется
концентрацией
(количеством
эквивалентов)
компонента
с
основными
свойствами;
буферная емкость по отношению к основанию
(Восн.) определяется концентрацией (количеством
эквивалентов)
компонента
с
кислотными
свойствами в буферном растворе.
13.
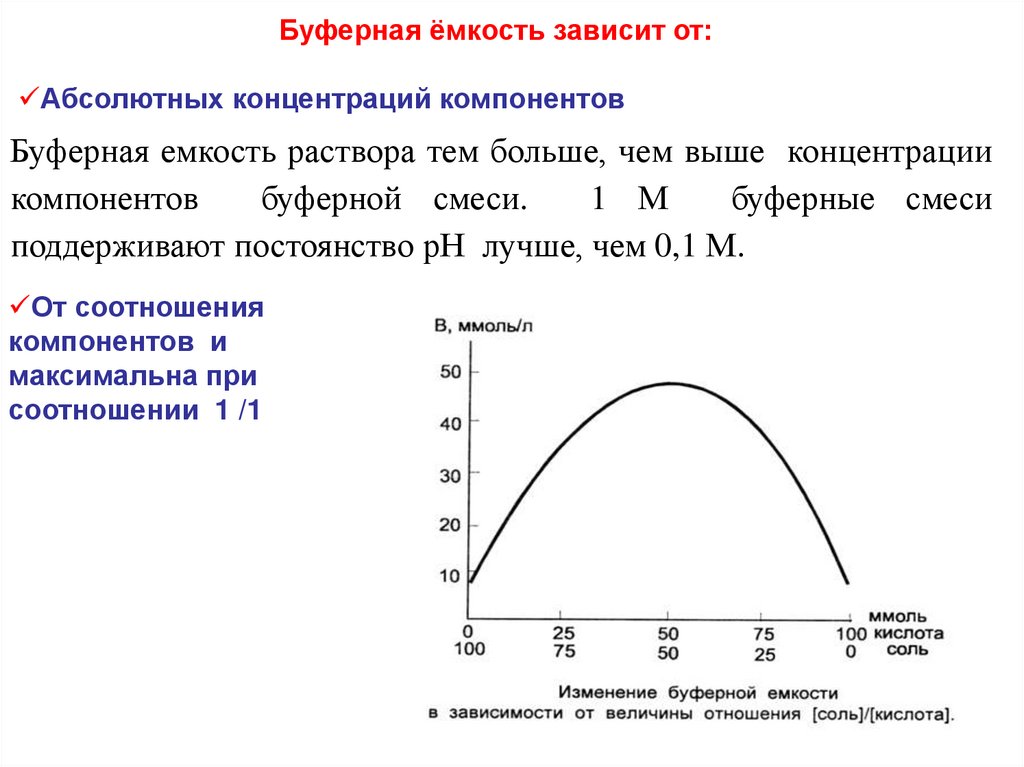
Буферная ёмкость зависит от:Абсолютных концентраций компонентов
Буферная емкость раствора тем больше, чем выше концентрации
компонентов
буферной смеси.
1 М
буферные смеси
поддерживают постоянство рН лучше, чем 0,1 М.
От соотношения
компонентов и
максимальна при
соотношении 1 /1
14.
Буферные растворы можно приготовить двумяспособами:
1. Частичной
нейтрализацией
слабого
электролита сильным электролитом:
СН3СООН(избыток) + NaOH;
NaOH(избыток) + HCl
2.
Смешиванием
растворов
слабых
электролитов с их солями (или двух солей):
СН3СООН и СН3СООNa;
NH3 и NH4Cl; NаН2РО4 и Nа2НРО4
15.
Расчет рН буферных растворовпроизводят по уравнению
Гендерсона-Гассельбаха
для кислотных буферных растворов:
[соли ]
рН рKa lg
[к ты]
Ссоли Vсоли
рН рK a lg
Ск ты Vк ты
26.07.2022
16.
где рК а – показатель константыдиссоциации кислоты рКа lg Ka ,
[соли] и [кислоты] – молярные
равновесные концентрации соли и
кислоты соответственно,
Ссоли, Скислоты, Vсоли, Vкислоты – концентрации
и объемы соли и кислоты, взятых для
приготовления буферного раствора
26.07.2022
17.
для основных буферных растворов:[соли ]
рН 14 рKb lg
[осн]
Ссоли Vсоли
рН 14 рKb lg
Сосн Vосн
26.07.2022
18.
где рК b – показатель константыдиссоциации основания рК b lg K b ,
[соли] и [осн] – молярные равновесные
концентрации соли и основания
соответственно,
Ссоли, Сосн, Vсоли, Vосн – концентрации и
объемы соли и основания, взятых для
приготовления БР
26.07.2022
19.
Буферные растворы, состоящие из двухсолей, одна из которых (более кислая)
выполняет роль сопряженной кислоты,
относят
к
кислотным
буферным
растворам, рН рассчитывают по формуле
для кислотных буферных растворов.
26.07.2022
20.
Уравнение нельзя применять :если концентрации компонентов отличаются более
чем в 100 раз;
если кислота (основание) слишком сильные - рКа<3
(нельзя пренебрегать диссоциацией);
если кислота (основание) слишком слабые - рКа>11
(нельзя пренебрегать гидролизом ).
21.
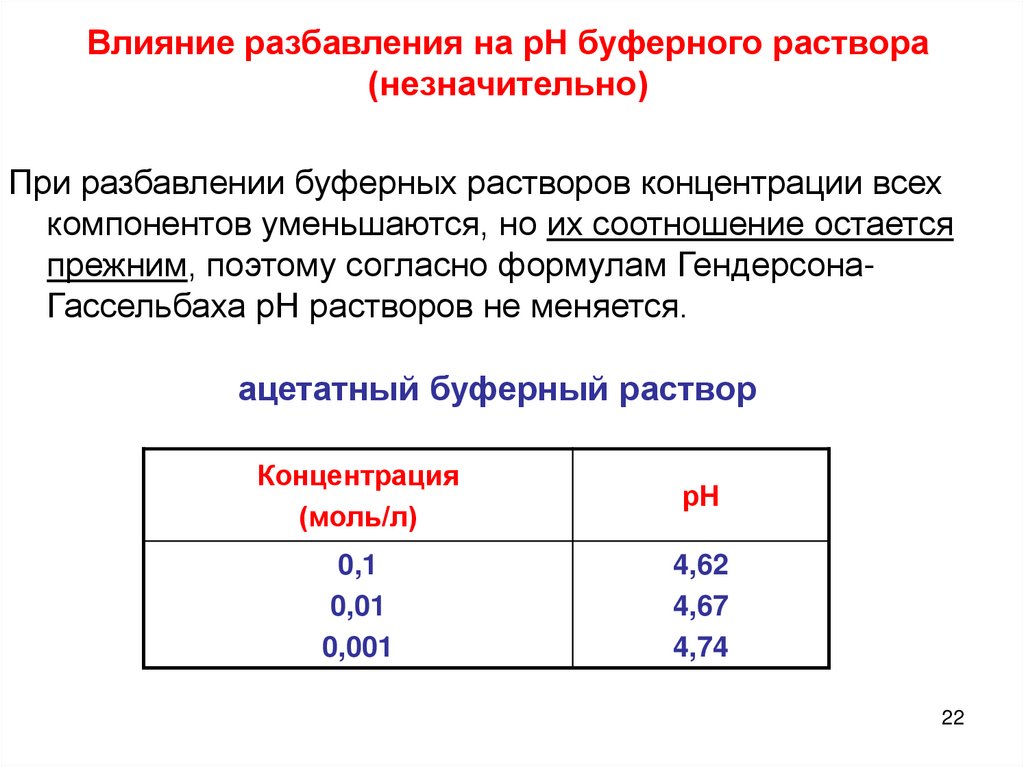
Влияние разбавления на рН буферного раствора(незначительно)
При разбавлении буферных растворов концентрации всех
компонентов уменьшаются, но их соотношение остается
прежним, поэтому согласно формулам ГендерсонаГассельбаха рН растворов не меняется.
ацетатный буферный раствор
Концентрация
(моль/л)
рН
0,1
0,01
0,001
4,62
4,67
4,74
22
22.
[CH3COONa ]4 моль / л
рН рKa lg
4,76 lg
4,76
[CH3COOH ]
4 моль / л
[CH3COONa ]
2 моль / л
рН рKa lg
4,76 lg
4,76
[CH3COOH ]
2 моль / л
26.07.2022
23.
Зона буферного действияpH pК д кисл
pH pК д кисл
10
lg
1
Сc
lg
Ск
pH pК д кисл
pH pK 1
ацетатный
4,75
7
1
lg
10
фосфатный
7,21
6,37
бикарбонатный
рН
9,25
амиачный
24
24.
Приготовление буферных растворов с заданнымзначением рН
Задача. Приготовить раствор с рН = 7,36.
Выбираем фосфатный буфер, поскольку
рН попадает в зону действия 6.21 – 8.21
ацетатный
4,75
7
фосфатный
7,21
6,37
бикарбонатный
рН
9,25
амиачный
Необходимо изменить соотношение компонентов в пользу соли
(т.к. значение рН находится в более щелочной области, чем рК)
25
25.
Рассчитаем, во сколько раз концентрация соли должна быть больше:[ Na 2HPO4 ]
7,36 7,21 lg
[ NaH 2PO4 ]
[соль]
0,15 lg
[кислота]
[соль]
[ Na 2 HPO 4 ]
1,41
0.15
10
[кислота ] [ NaH 2 PO 4 ]
1
26
26.
Буферные системы кровиИз кишечника и тканей в кровь при обмене веществ постоянно
поступают различные кислоты: угольная, молочная, масляная…
и, в меньшей степени, основания: аммиак, креатин.
Благодаря наличию буферных систем, рН крови остается
постоянным
7.4 ± 0.04
В организме человека в спокойном состоянии ежесуточно
образуется количество кислоты, эквивалентное ≈ 30 л 1 н НСI !!!!
27
27.
• ЗАДАЧИ28
28.
Задача 1. Определить рН раствора, получившегося врезультате смешения равных объемов растворов 0,12 М
СН3СООН и СН3СООК.
Решение: После смешения Скис= Ссоль= 0,12/2=0,06 моль/л
Пользуясь уравнением:
рН = рК + ℓg
,
Получим:
рН = 4,76 + lg1 = 4,76 + 0 = 4,76.
29.
Задача 2. Сколько миллилитров 0,25М раствора ацетата калия СН3СООКследует прибавить к 50 мл 1,0 М раствора уксусной кислоты СН3СООН,
чтобы получить буферную систему с рН=3,0?
Решение:
Ссоли Vсоли
рН рK a lg
Ск ты Vк ты
lg (Cсоли / Скислоты )= рН - рКкислоты = 3 - 4,76 = -1,76;
Cсоли / Скислоты = 10-1,76 = 1/ 101,76 =1/57,5
Это означает, что после в полученном растворе концентрация кислоты в 57,5
раза должна быть выше, чем концентрация соли.
Cсоли / Скислоты = nсоли / nкислоты = Cсоли V соли / Скислоты V кислоты =1/57,5
0,25· V соли /0,05·0,1 = 1/57,5
Vсоли = 0,00348л = 3,48 мл.



























 Химия
Химия








