Похожие презентации:
Кремний и его соединения. Химия. 9 класс
1.
Кремний и его соединенияХимия
9 класс
2.
План характеристика:Положение в ПСХЭ. Строение атома.
Нахождение в природе.
Физические свойства и применение.
Химические свойства.
Оксид кремния.
Силикаты.
2
3.
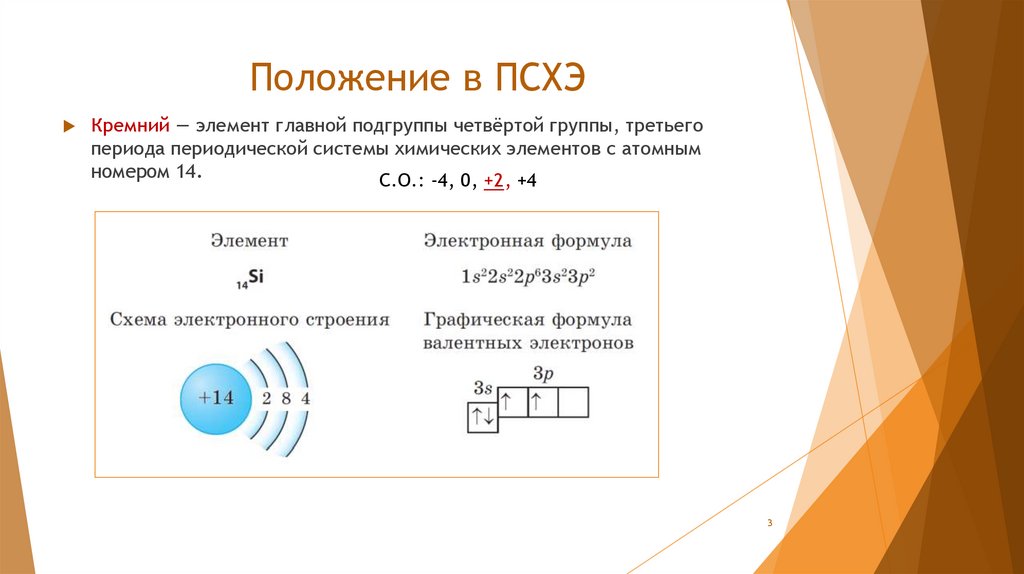
Положение в ПСХЭКремний — элемент главной подгруппы четвёртой группы, третьего
периода периодической системы химических элементов с атомным
номером 14.
С.О.: -4, 0, +2, +4
3
4.
Нахождение в природеВ природе кремний второй элемент по распространенности после
кислорода. Наиболее распространенным является оксид кремния (IV) SiO2,
другое название – кремнезем. В природе образует минерал кварц, и
многие другие разновидности, такие как горный хрусталь, аметист. Оксид
кремния (IV) SiO2 – это также обычный песок.
4
5.
Кристаллическаярешетка
Аллотропные
модификации
Кристаллический
кремний
Аморфный
кремний
5
6.
Физические свойства и применениеПростое вещество кремний представляет собой темно-серое
кристаллическое вещество с металлическим блеском, обладающее
полупроводниковыми свойствами.
Применение:
для получения полупроводниковых материалов, а также кислотоупорных
сплавов;
для затачивания резцов металлорежущих станков и шлифовки
драгоценных камней;
для изготовления химической посуды;
соединения кремния служат основой для производства стекла и цемента
6
7.
Химические свойства:Окислительные свойства:
1.С металлами (образуются силициды)
2Mg + Si = Mg2Si
Восстановительные свойства:
1.С кислородом:
Si + O2 = SiO2
2. С водородом не взаимодействует! Но водородное
соединение кремния (силан) можно получить косвенным
путем:
Mg2Si + 4HCl = 2 MgCl2 + SiH4↑ (на воздухе воспламеняется)
3. С растворами щелочей:
Si + NaOH + H2O = Na2SiO3 + 2H2↑
4. С галогенами
Si + 2F2 = SiF4
7
8.
Оксид кремния (IV)SiO2 – кислотный оксид.
Химические свойства:
1. С водой не взаимодействует!
2. С щелочами:
SiO2 + 2NaOH = Na2Si + H2O
Н2SiO3
Кремниевая кислота
Слабая, нерастворимая,
нестабильная.
При нагревании разлагается:
H2SiO3 = H2O + SiO2
3. С основными оксидами:
SiO2 + CaO = CaSiO3
4. С карбонатами:
SiO2 + CaCO3 = CaSiO3 + CO2↑
5. Восстанавливается Mg и C:
SiO2 + 2Mg = 2MgO + Si
SiO2 + 2C = Si + 2CO
6. С плавиковой кислотой:
4HF + SiO2 = SiF4 + 2H2O
8
9.
Это интересноДополнительно по теме
Ежедневно с пищей в организм человека поступает менее 1 грамма
кремния в виде разнообразных химических соединений.
Кремний обеспечивает нормальный обмен веществ, а также этот элемент
способствует усваиванию порядка 70 разнообразных соединений.
Оказывается, что в крови человека содержится — 3,9 мг/л кремния.
Если воду настоять на кремнии, то она обретет особые свойства и станет
более очищенной. Ее называют структурированной, и она значительно
лучше усваивается организмом человека по сравнению с обычной изпод крана.
Важным моментом при изготовлении структурированной лечебной воды
является то, что кремний должен постоянно в ней содержаться, и его
нельзя подвергать кипячению. Из-за термической обработки произойдет
полное разрушение полезных человеку свойств воды.
9
10.
УпражненияЗадание 1. Вставьте пропущенные слова.
1. В природе кремний занимает _________ место.
2. Наиболее распространенным соединением кремния является ______.
3. Кремний с металлами образует соединения, которые называются ______.
4. Степень окисления кремния в соединении с магнием равна ______.
5. Кремний реагирует с водными растворами щелочей, образуя соли - _____.
6. Относительная атомная масса кремния равна ________.
7. На внешнем энергетическом уровне находится ______ электрона.
8. При взаимодействии с металлами кремний проявляет ________ свойства.
9. Кремний горит в кислороде, образуя __________.
10. Силициды, кремний образует взаимодействуя с ________.
11. Число электронов в атоме кремния - _____.
12. Заряд ядра атома кремния равен _________.
13. В атоме кремния _______ энергетических уровня.
Задание 2. Реши задачу. Вычислить массу кремния, обработанного концентрированным раствором гидроксида натрия, если
при этом выделился водород объемом 22,4 л.
Задание 3. Реши задачу. Какую массу кремния можно получить при взаимодействии 60 г оксида кремния с углеродом?
10
11.
УпражненияНапишите уравнения реакций, с помощью
которых можно осуществить следующие
превращения:
а)SiO2 → Si → Ca2Si → SiH4→ SiO2→ Si
б) Si → SiO2→ Na2SiO3→ H2SiO3→ SiO2→ Si
11
12.
Домашнее заданиеВыучить записи в тетради, изучить параграф 24. Решить цепочку реакций.
12











 Химия
Химия








