Похожие презентации:
Поверхностные явления, имеющие место в живом организме. Адсорбция. Лекция №3
1. Тема: Поверхностные явления, имеющие место в живом организме. Адсорбция. Дисциплина «Химия» Для студентов 1 курса
специальности: “Общаямедицина”, “Стоматология”
Лектор: ассоциированный профессор кафедры
биохимии и химических дисциплин, кандидат
химических наук
Болысбекова Салтанат Манарбековна
2. Цель и задачи:
• Сформировать знания о физико-химииповерхностных явлений.
• Установить их медико-биологическое
значение.
• Ознакомить с методами хроматографии
и их применением в медицинской
практике.
3. Актуальность:
• Поверхностные явления играют важнуюроль прежде всего на клеточном и на
молекулярном уровнях организации
живых организмов.
• Знание поверхностных явлений лежит в
основе понимания избирательной
адсорбции ядов и токсинов различными
тканями и клетками в организме
человека; адсорбционной терапии.
4. План лекции:
Поверхностные явления
Сорбция
Поверхностно-активные и
поверхностно-неактивные вещества
Медико-биологическое значение темы
Избирательность адсорбции
Хроматография
Обратная связь
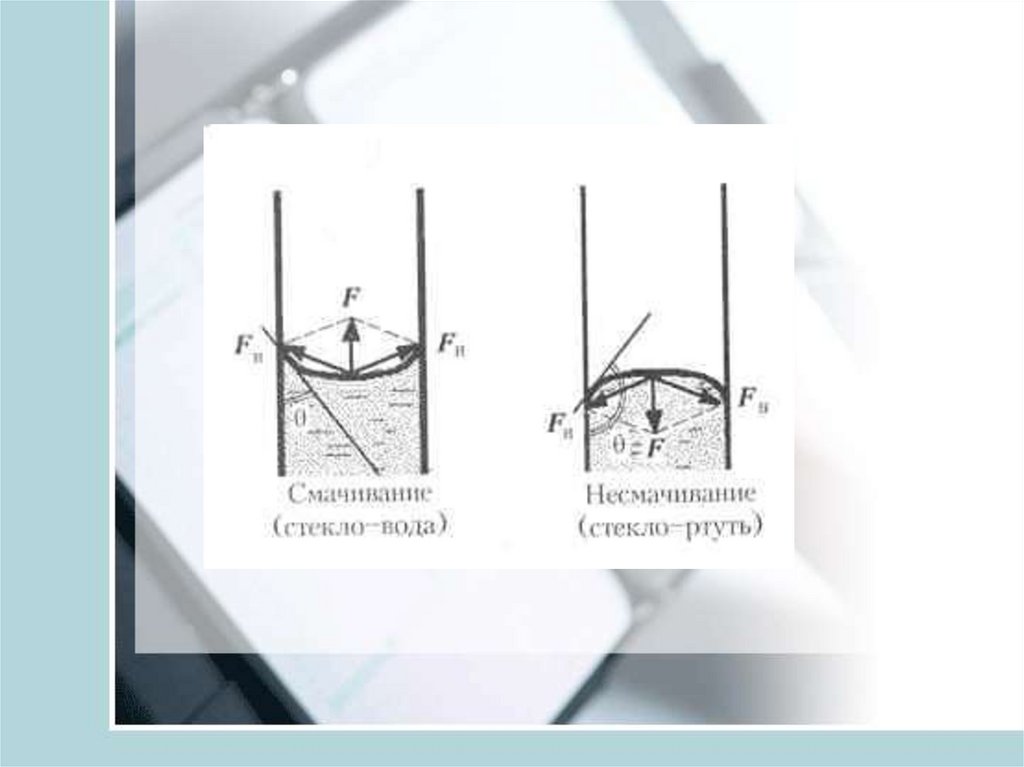
5.
6.
7.
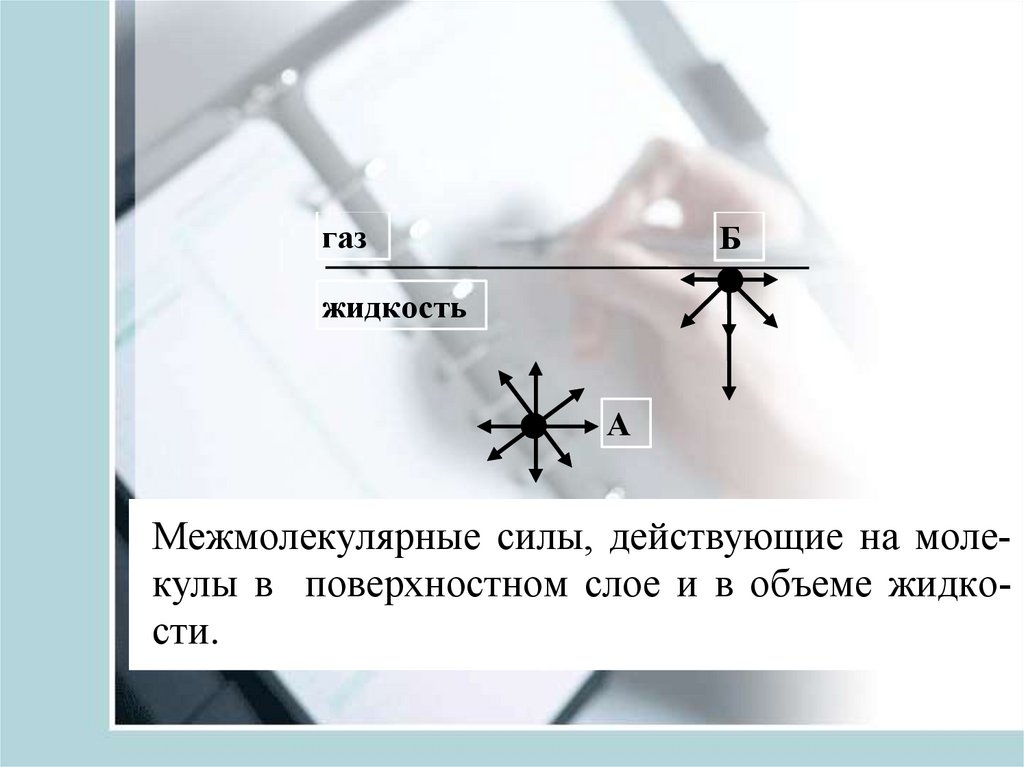
газБ
жидкость
А
Межмолекулярные силы, действующие на молекулы в поверхностном слое и в объеме жидкости.
8. К поверхностным явлениям относят те эффекты и особенности поведения веществ, которые наблюдаются на поверхностях раздела фаз.
9. Особенности поверхностных слоев обусловлены наличием избытка поверхностной энергии
10. Основные понятия
• Сорбент – поглотитель• Сорбтив (сорбат) – поглощаемое
вещество
• Сорбция – процесс поглощения одного
вещества другим
• Адсорбция – поглощение
поверхностью сорбента
• Абсорбция – поглощение всем
сорбентом
11. Поверхностное натяжение
Поверхностное натяжение (σ) равно работе,которую нужно совершить для создания
единицы поверхности [Дж/м2].
Поверхностное натяжение зависит от:
– природы жидкости
– температуры (↑t ↓σ , при tкип σ =0).
– давления (↑p ↓σ ).
– концентрации растворенного вещества.
12.
Поверхностное натяжение различныхжидкостей на границе с воздухом при 293 К
Жидкость
Поверхностное
натяжение
Жидкость
, Дж/ м
Поверхностное
натяжение
, Дж/ м
Вода
72,8
Хлороформ
27,1
Глицерин
64,7
Этанол
22,3
Уксусная
кислота
Оливковое
масло
Бензол
27,6
Метанол
22,6
33,0
Сыворотка крови
45,4
29,4
Фенол
42,3
13.
σ биологических жидкостейзначительно ниже, чем воды. Поэтому
гидрофобные вещества будут
накапливаться у стенок сосудов,
клеточных мембран, что облегчает их
проникновение сквозь эти мембраны.
14. Поверхностная активность
Способность растворенного вещества изменятьповерхностное натяжение – поверхностная
активность (g)
Мера поверхностной активности:
g
c
15. ПАВ, ПИВ, ПНВ
1.Поверхностно-активные вещества (ПАВ): уменьшают
σ растворителя.
σ раствора < σ растворителя; g > О.
ПАВ: спирты, органические кислоты, сложные эфиры,
белки, холестерин, жиры, липиды, мыла.
2.
Поверхностно-инактивные вещества (ПИВ):
увеличивают σ растворителя.
σ раствора > σ растворителя; g < О.
ПИВ: неорганические кислоты, основания, соли, глицерин,
Поверхностно-неактивные вещества (ПНВ):
не изменяют поверхностное натяжение растворителя.
σ раствора = σ растворителя; g = О.
ПНВ: сахароза.
16.
Не последнее место в спискебытовой химии занимают
стиральные порошки.
Стирка – самый
трудоемкий процесс в
нашем быту. А
помощниками в стирке
являются поверхностноактивные вещества
(ПАВ).
17. Изотерма поверхностного натяжения
Зависимость σ от концентрациирастворенного вещества при постоянной
температуре – изотерма поверхностного
натяжения.
σ
ПИВ
ПНВ
ПАВ
с
18. Строение молекулы ПАВ:
Молекула ПАВ состоит из:неполярной гидрофобной углеводородной
группы (“хвост”)
полярной гидрофильной группы (“голова”):
-ОН, -СООН, -С(О)-О,-NН2; -SО3H.
“хвост”
“голова”
19.
20. Правило Траубе-Дюкло:
При удлинении цепи на группу -СН2 - вгомологическом ряду
способность к
адсорбции возрастает в 3,2 раза.
σ
НСООН
СН3СООН
СН3СН2СООН
СН3СН2СН2СООН
с
21. Правило Панета- Фаянса:
• на твердой поверхности адсорбируютсялучше ионы, входящие в состав
адсорбента или имеющие общую с
адсорбентом группу (родственные
ионы).
• Многовалентные ионы адсорбируются
быстрее и больше, чем одновалентные.
22.
Ионы одинаковой валентности поспособности к адсорбции
образуют лиотропные ряды:
Cs+ > Rb+ > K+ > Na+ > Li+
CNS- > I- > NO3- > Br- > Cl-
23. Уравнение Гиббса
CГ
c RT
Г - количество адсорбированного вещества [моль/м2]
С - молярная концентрация раствора [моль/л]
R - универсальная газовая постоянная = 8,31
Дж/моль.град(К)
- поверхностная активность растворенного вещества.
c
>0
Г < 0, т.е. ↑с ↑σ (ПИВ)
c С вещества в поверхностном слое < С вещества в
объёме фазы
<0
Г > 0, т.е. ↑с ↓σ (ПАВ)
c С вещества в поверхностном слое > С вещества в
объёме фазы
24. Изотерма адсорбции Гиббса
Г1. Низкие С
газ
2 Г
вода
2. Высокие С
«частокол Лэнгмюра»
1
газ
вода
c
25. Адсорбция твердыми телами
Величина адсорбции зависит от:1. Размера поверхности адсорбента
чем > Sповерхности, тем > адсорбция.
2. Температуры (↑t ↓Г ).
3. Типа сорбента, его сродства к растворителю.
- гидрофильные сорбенты (силикагель SiO2, глина,
пористое стекло) для адсорбции полярных веществ из
неполярных (неводных) растворителей.
- гидрофобные сорбенты (активированный уголь,
графит, тальк) для адсорбции неполярных веществ из
полярных растворителей.
4. Заряда адсорбента и адсорбтива.
5. Концентрации адсорбтива.
26. Уравнение Ленгмюра
Г=ГС
К+С
для газов: Г = Г _Р_
К+Р
С – концентрация
Р - давление газа
К - константа адсорбционного равновесия =
при С << К
при С > К
адсорбции.
Кдесорбции
Кадсорбции
Г = Г С, линейная зависимость Г от С
К
Г = Г , дальнейшее увеличение концентрации не
влияет на величину
Изотерма адсорбции:
а) по Фрейндлиху (парабола) Г
б) по Ленгмюру.
c
27. Медико-биологическое значение темы:
1. Усвоение питательных и лекарственных веществ2. Перенос О2 и СО2 из лёгких к тканям
3. Действие ферментов
4. Детоксикация организма:
а) Гемосорбция - очистка крови
б) Лимфосорбция - очистка лимфы.
5. Поглощение ядовитых веществ в желудочно-кишечном
тракте.
6. Хроматография:
- разделение смесей аминокислот;
- очистка лекарственных препаратов;
- количественное определение витаминов, гормонов;
- диагностика заболеваний
28.
Избирательность адсорбциипроявляется в человеческом
организме. Некоторые яды
адсорбируются на активных центрах
металлоферментов. Цианистые
соединения адсорбируются на Fe2+
дыхательных ферментов и вызывают
смерть через несколько секунд после
введения в организм.
29.
Хроматогра́фия (от др.-греч. χρῶμα —цвет) — динамический сорбционный метод
разделения и анализа смесей веществ, а
также изучения физико-химических свойств
веществ. Основан на распределении
веществ между двумя фазами —
неподвижной (твердая фаза или жидкость,
связанная на инертном носителе) и
подвижной (газовая или жидкая фаза,
элюент).
30. По механизму процесса:
• адсорбционная• ионообменная
• осадочная
• распределительная
• окислительно-восстановительная
• адсорбционнокомплексообразовательная
хроматография.
31. По технике выполнения:
• Колоночная• Бумажная
• Восходящая
• Нисходящая
32.
Хроматографический анализиспользуется при анализе белков,
витаминов, ферментов,
лекарственных веществ,
биологических жидкостей с целью
диагностики заболеваний.
33. Вопрос:
• Расположите в порядке увеличенияадсорбционной способности на
алюмогеле ионы: Cu2+, Na+, Fe3+, Li+
































 Химия
Химия








