Похожие презентации:
Полиэлектролиты (классификация) по степени диссоциации
1.
• В МГУ ( по крайней мере на химфаке) (физфаке и мехмате)• студентам одновременно дают знания ( их множество, они
мобильные) и учат когнитивности (cognition – познание).
(использование непонятных слов стимулирует расшифровку их содержания).
• Высшее образование – это не выученные методички и даже
учебники, содержание которых иногда меняется, а
• - способность к умственному восприятию, сравнению и
переработке информации,
• - умение познавать, анализировать и суммировать знания,
• - умение усваивать знания и на этой базе формулировать
верные ответы и принимать решения .
• Инженерия (конструирование) – внутренняя
способность творить (креативность) на основе фундаментальных
• знаний
1
2.
Полиэлектролиты – это полимеры, мономерные звенья макромолекулкоторых содержат функциональные группы, способные либо к
электролитической диссоциации, либо к приёму протонов (катионов). При
этом в растворе образуются макроионы (полианионы или поликатионы) и
низкомолекулярные противоионы (катионы или анионы)
H2O
2
Полиэлектролиты (классификация)
по степени
диссоциации
по природе выделяемых в
раствор противоионов
Поликислоты
Сильные
(диссоциируют
нацело)
Слабые
(диссоциируют
частично)
генерируют H+
Полиамфолиты
генерируют и H+, и
OH-
Полиоснования
генерируют OHПолисоли
НЕТ ни H+, ни OH-
3.
Где применяются полиэлектролиты?HOOC-
-COOH
-COOH
HOOC-
HOOC-
-OOC-
-COO-COOH
HOOC-
H2O
HOOC-
Сшитая полиакриловая кислота – суперадсорбент (очень хорошо
«захватывает» и удерживает воду) – наполнитель для подгузников,
одноразовые пеленки и др.
Na+
HOOCHOOC-
Ca2+
-COOH
-COOH
HOOC-
Mg2+
H2O
-OOC- Na
2+
+Mg
-COO-COOH
HOOC- 2+
Ca Mg2+
HOOC-
H2O H+
+
H+
H2O
H2O
H+
Сшитые полиэлектролиты – ионообменные
смолы (иониты) – опреснители и очистители
воды
3
4.
Где применяются полиэлектролиты?Дисперсия
Чистая вода
4
++
+ ++ +
+ +
++
+ ++ +
+ +
Осадок
++ ++ + ++
+
+ ++ + + ++ +
Полиэлектролиты – коагулянты и флокулянты – очистка сточных и
промышленных вод, обогащения минерального сырья и др.
Полиэлектролитное набухание высокая вязкость водных растворов
полиэлектролиты - загустители и гелеобразователи водных сред шампуни,
пасты, гели, мази и др.
5.
ПоликислотыCH3
-[CH2-CH]p-
COOH
Полиакриловая
кислота
(слабая)
H
-[HN-C-CO]p(CH2)x
COOH
-[CH2-CH]pCOOH
+
O
-[CH2-C]p-
O-P
COOH
Полиметакриловая
кислота
(слабая)
х=1
Полиаспарагиновая
кислота (слабая)
O-H p
Полифосфорная
кислота
(сильная)
х=2
Полиглутаминовая
кислота (слабая)
H2O
-[CH2-CH]pCOO-
+ H3+O
5
6.
Поликислоты-[CH2-CH]p-
-[CH2-CH]p-
SO3H
Поливинилсульфоновая кислота
(сильная)
SO3H
Полистирол-сульфоновая
кислота
(сильная)
-[CH2-CH]p-
CH3
O=C-NH
-[CH2-C]p-
H3C-C-CH3
CH2
SO3H
Поли-2-акриламидо-2метилпропансульфоновая
кислота (сильная)
O=C-O
(CH2)2
SO3H
Поли-2метакрилоксиэтансульфоновая
кислота
6
7.
Полиоснования-[CH2-CH]p-
6
NH2
Поливиниламин
(слабое основание)
CH3
-[CH2-CH]p5
1
-[CH2-C]p-
2
4N
O=C-O
3
CH2-CH2-N(CH3)2
Поли-4-винилпиридин
(слабое основание)
-[CH2-CH]p-
Поли-N,Nдиметиламиноэтилметакрилат
(слабое основание)
-[CH2-CH2-NH]p [CH2-CH2-N]q-[CH2-CH2-NH]k~
O=C-NH
CH2-N(CH3)2
Поли-N,Nдиметиламинометилакриламид
(слабое основание)
-[CH2-CH2-NH]p-
Полиэтиленимин разветвлённый
и линейный
(слабое основание)
7
8.
Все полисоли – сильные полиэлектролиты-[CH2-CH]p-
-[CH2-CH]p-
+
COO Na
Полиакрилат
натрия
NH3+ClПоливиниламмоний
хлорид
-[CH2-CH]p1
6
2
5
3
4N
Br
C2H5
Поли-N-этил-1винилпиридиний
бромид
8
9.
Все полисоли – сильные полиэлектролитыCH3
-[CH2-C]pO=C-O
Cl
CH2-CH2-N(CH3)3
Поли-2-метакрилоилэтил- N-триметиламмоний хлорид
CH2 HC
CH CH2
H2 C
CH2
N
CH3
CH3
Br CH3 Br
(CH2)x N-(CH2)y-N
CH3
CH3
Cl
CH3
p
p
N,Nдиметилдиаллиламмоний хлорид
Ионен-x,y (x,y = 2 – 10)
9
10.
Полиамфолиты – это СОПОЛИМЕРЫ, содержащие и кислотные, иосновные звенья в цепи. Поэтому полиамфолиты могут диссоциировать и по
кислотному, и по основному механизму.
Полиамфолиты
CH3
-[CH2-CH]p [CH2-C]q-
COOH
N
-[CH2-CH]p [CH2-C]q-
H+
(CH2)2
(CH2)4
COOH
NH2
CH3
-[CH2-CH]p [CH2-C]q-
OH-
CH3
-[CH2-CH]p [CH2-C]q-
COO-
COOH
N
H
-[HN-CH-CO]p-
К природным полиамфолитам
относят белки, которые содержат как
кислотные (например, глутаминовая
кислота), так и основные (например,
лизин) мономерные звенья.
Статистический сополимер 4винилпиридина и метакриловой
кислоты
CH3
-[HN-CH-CO]p-
N
H
COO-
10
N
Изоэлектрическая точка – значение рН, при котором суммарный заряд полиамфолита
равен нулю, т.е.количество отрицательных и положительных зарядов на макромолекуле
одинаково.
11.
Полисахариды6
6
CH2O-CH2-COO-Na+
5
H
4 OH H
3
2
H
P
6
3
H
P
CH2OSO3H
5
O
NH2
6
COOH
...
H
Хитозан
Карбоксиметилцеллюлоза,
натриевя соль
4 OH H
2
H
O
1
H
3
H
OH
H
O
4 OH H
O
1
H
5
H
O
CH2OH
O H
1
H
2
5
H
4 OH H
O
3
OH
H
O H
1
H
O
2
...
NHSO3H
Гепарин
Полипептиды
Природные
полипептиды
–
полиамфолиты: в их цепях есть
кислотные (R = Asp, Glu) и основные (R =
Lys, Arg, His) функциональные группы.
O
O
O
O
-C-CH-NH- C-CH-NH-C-CH-NH-C-CH-NHR1
R2
R3
R4
11
12.
Природные полиэлектролитыНуклеиновые кислоты
ДНК = Фосфат+ Сахар
(дезоксирибоза) + Основания;
РНК = Фосфат + Сахар (рибоза) +
Основания;
Аденин (A) – Тимин (T);
Аденин (A) – Урацил (U);
Гуанин (G) – Цитозин (C)
Гуанин (G) – Цитозин (C)
NH2
N
N
O
N
NH2
N
Аденин
N
N
5
CH2 O
1
4 H 3 H Дезоксирибоза
O
H
H
O 2H
N
NH
O P O
Фосфат
O
N
O
O
CH2 O
Гуанин
H
H
H
H
O
H
O P O
O
Тимин
H3C
NH
Аденин
N
5
CH2 O
1
4 H 3 H Рибоза
H
H
O 2 OH
N
O P O
Фосфат
NH2
N
N
O
NH
N
NH2
N
CH2 O
Гуанин
H
H
H
H
O
OH
O P O
O
NH
N
N
O
ДНК
CH2 O
H
H
H
H
O
H
O P O
O
HO
Цитозин
NH2
N
O
РНК
N
CH2 O
H
H
H
H
O
H
O P O
O
O
CH2 O
H
H
H
H
O
OH
O P O
Урацил
O
NH2
N
N
O
Цитозин
O
CH2 O
H
H
H
H
O
OH
O P O
O
12
13.
Макромолекула ДНК состоит из повторяющихсямономерных единиц четырех основных видов.
При химическом синтезе фрагментов ДНК необходимо
соединить эти мономерные единицы (синтоны) в
специфическом порядке с образованием между ними
фосфодиэфирной связи.
Относительно короткие
фрагменты ДНК (до 50-70
нуклеотидов) называются
олигодезоксирибонуклеотидами
14.
Рибо- и дезоксирибонуклеозиды – полифункциональныемолекулы
Структура нуклеозидов
ДНК
dC
РНК
T
NH2
H3C
N
N
HO
OH
N
N
O
OH
H
N
HO
N
O
OH
H
NH2
G
N
N
NH
N
NH2
HO
N
O
OH
OH
N
HO
N
O
OH
O
O
OH
N
N
N
N
HO
OH
A
O
O
O
OH
H
NH
N
HO
O
dG
NH2
O
N
O
H
dA
HO
N
HO
U
NH2
NH
O
O
OH
C
O
OH
OH
O
NH
N
NH2
15.
АЦ
Г
Нуклеиновые кислоты (РНК, ДНК)
Дезоксирибонуклеиновая кислота (ДНК)
Т
Рибонуклеиновая кислота (РНК)
ДНК
UТ
Т
Аденин
гуанин
тимин
цитозин
15
16.
UДезоксирибонуклеиновая кислота (ДНК)
Рибонуклеиновая кислота (РНК)
РНК
Нуклеиновые кислоты (РНК, ДНК)
16
17.
April 1953The publications in
Nature on the structure of the DNA
double helix
Watson and Crick
Franklin and Gosling
Wilkins, Stokes and Wilson
18.
Гель-электрофорез – самый распространенный методразделения нуклеиновых кислот
Отрицательный
электрод
Источник тока
Образцы ДНК
Положительный
электрод
ПАА Гель
Раствор,
проводящий
ток
Большая ДНК движется медленнее, маленькая - быстрее
Нуклеиновые кислоты имеют отрицательный заряд. Они движутся
в направлении положительного электрода.
Чем больше размер нуклеиновой кислоты, тем медленнее она
движется через поры геля.
19.
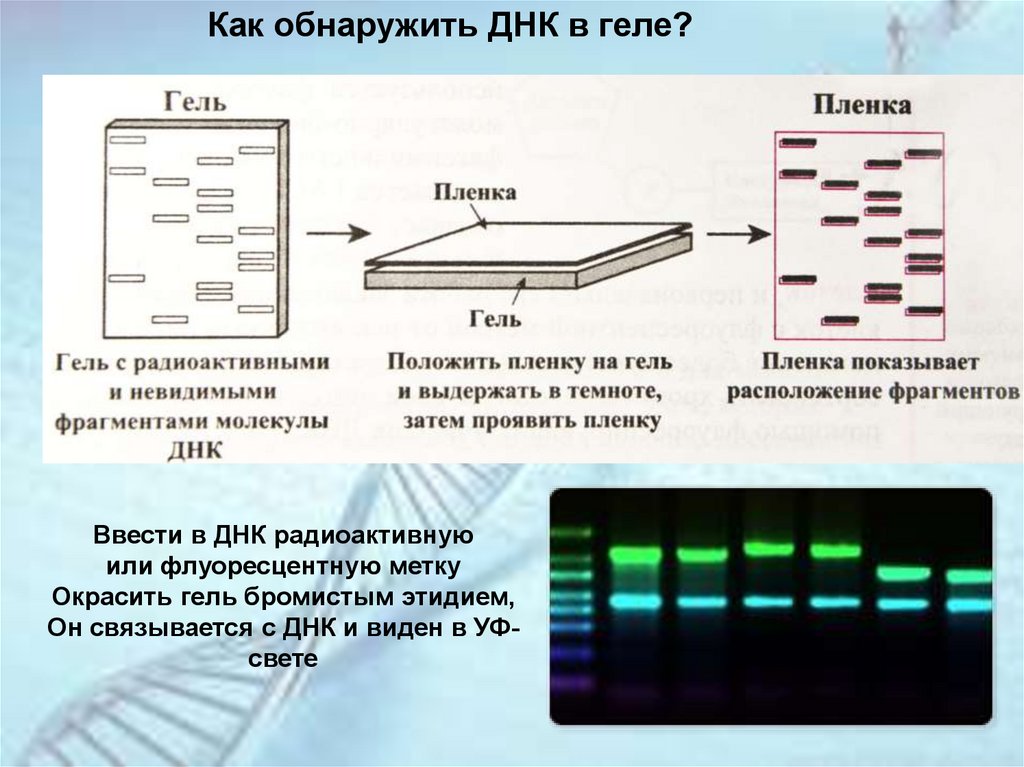
Гель-электрофорез нуклеиновых кислотКак это выглядит?
Камера для вертикального
гель-электрофореза
Образцы
ДНК
Длинные
ДНК
Гель
Короткие
ДНК
20.
Как обнаружить ДНК в геле?Ввести в ДНК радиоактивную
или флуоресцентную метку
Окрасить гель бромистым этидием,
Он связывается с ДНК и виден в УФсвете
21. Ван-дер-Ваальсовы взаимодействия (силы) – силы межмолекулярного ( и межатомного) взаимодействия с энергией порядка 10 – 20
кДж\моль, возникающие при поляризации молекул и+ образовании (появлении) диполей.
+
+
+
- +
Рассматривают и учитывают три основных типа таких слабых
электромагнитных взаимодействий:
- ориентационные силы (диполь-дипольное притяжение)
между молекулами, являющимися постоянными диполями.
НСl в твердом и жидком состоянии . Е ~ 1/ r3
- дисперсионное притяжение – взаимодействие между
мгновенным и наведенным диполями. Е ~ 1/ r6
- индукционное притяжение – взаимодействие между
постоянным диполем и наведенным (индуцированным) Е ~ 1/ r6
Гидрофобные, водородные…..
21
22.
Ионизационное равновесиеКак связаны между собой рК, рН и степень диссоциации ( ) в случае
слабого низкомолекулярного электролита (слабой кислоты)?
[ H ][ A ]
HA
K
[ HA]
К – константа равновесия
(через равновесные мольные
концентрации)
– степень диссоциации; доля
продиссоциировавших
молекул
кислоты от максимально возможного
H+ + A-
СН3 СООН
[ A ]
[ HA] [ A ]
[ A ] [ A ] [ HA]
[ HA] 1 [ A ] [ HA]
lg K lg[ H ] lg
1
[H ]
K
1
pK pH lg
1
Уравнение Хассельбаха Гендерсона
22
23.
кривая потенциометрического титрования длянизкомолекулярного электролита
титрование
низкомолекулярной кислоты СН3 СООН
щелочью (NaOH).
Н+ OH- = 10-14_
Ионное произведение воды
рН
o
o
o
o
o
o
α=0
o
o
α=1
VNaOH - объём добавленной щелочи
VNaOH(total) - объём щелочи, необходимый
для полной нейтрализации кислоты. Есть
выраженный скачок титрования.
VNаOH/VNaOH(total).
Объем
добавленной
щелочи, мл
K = e - ∆Gдисс / RT
логарифмируем это
выражение
- lg K = ( 2,3 / RT ) * ∆Gдисс
pK pH lg
1
Согласно уравнению Хассельбаха строим
зависимость рК от α
(Следующий слайд)
23
24.
зависимость pK от для низкомолекулярного электролитаСН3 СООН
pK
рК не зависит от степени диссоциации α
S1 – площадь под прямой pK ( ).
Gдисс - свободная энергия диссоциации
S1
кислоты
Gдисс 2.3 RT S1 2.3 RT pK ( )d
0
2.3 RT * pK *
рК = (0.434 ∆Gдисс..) / RT
24
25.
Кривые потенциометрического титрования различных кислотK
pH
-COO- + H+
-COOH
ПАК
пропионовая
кислота (слабая)
[A]
B
СН3 СН2 СООН
HCl
α=0
α=1
V, мл
Кислоты взяты в одинаковых концентрациях и объёмах
ПАК – более слабый электролит, чем её низкомолекулярный аналог
пропионовая кислота
полиэлектролиты
Согласно уравнению Хассельбаха, так же ( как это делали для
низкомолекулярного электролита) строим зависимость рК от α
25
26. Полиэлектролит (слабая поликислота) - ПАК
количество COO? групп вмакромолекуле
K
][ B] P [H ] Если Z – велико (при 0 и при P>>1),
[
H
K
[ A](1 )P 1 то [A] и [B] неразличимы.
COOН
В
[A]
количество COOH групп
в макромолекуле
pK pH lg
1
-COO- +
H+
pK=pK0 + pK( )
pK
ПолиЭлектролит
0
Gэл
. 2,3RT pKd
0
pK0
н/м электролит
С увеличением степени
диссоциации рК растёт( константа
дисс.уменьшается)
G0ион. – изменение энергии Гиббса при удалении 1-го
протона от нейтральной макромолекулы.
G0эл.( ) – изменение электростатической
составляющей энергии Гиббса (в расчете на
ионогенную группу) полиэлектролита при удалении
моля протонов от моля частично ионизованных
макромолекул степени диссоциации - работа против
электрического поля
pK=0.434 ( G0ион. + G0эл.) / RT
26
27.
Специфика – образование вторичной структуры вводном растворе
Полиметакриловая
кислота
CH3 Гидрофобные
взаимодействия
-[CH2-C]p-OOC-
COOH
H+
-COO-
Диссоциация
-OOC-
-COOH
HOOC-OOC-
pK
-COO-COOH
HOOC-OOC-COOH
I
S3
-OOC-
Х
III
pKкажущ.
S2
-COOH
HOOC- -COOH
HOOC- -COOH
II
-OOC-
-OOC-OOC-
H+
Gконф 2.3RT * S3
pK0
I – область заряжения компактной конформации поликислоты
II – область конформационного перехода «компактная конформация клубок»
III – область заряжения клубка; Gконф – свободная энергия Гиббса
конформационного перехода «компактная конформация клубок»
27
28.
pKI
II
III
S3
S2
pK0
Участки I и II на кривой (в узком интервале
степени ионизации макромолекул)
Gконф – свободная энергия Гиббса
конформационного
перехода
«компактная конформация клубок».
pK0
Gконф 2.3 * R * T * S 3
Разрушение ( и формирование) вторичной структуры в полимерах
всегда кооперативный процесс. Освобождение 1 – 2-х
контактов вторичной структуры требует затраты энергии , но не
дает при этом выигрыша в энтропии.
Термодинамика требует одновременного освобождения
из вторичной структуры полимера больше, чем 1-2-х
контактов,
чтобы получить выигрыш в энтропии и соответственно
G
28
29.
• Константа диссоциации полимерной слабойкислоты в водных растворах
• зависит:
• От ионной силы раствора ( легко регулировать !!!!)
• От конфигурации макромолекул (синтез)
• От конформационного состояния макромолекул (Кулон и
т\дин. качество)
Gдисс ( ) Gион G эл ( ) Gконф
• не зависит
от молекулярной массы полимера
29
30.
Из чего складывается осмотическое давление( бессолевого ) водного раствора
полиэлектролита?
H+
-OOC-
= gh
Растворитель
- вода
Полупроницаемая мембрана
Малые ионы ( Н+ Н2О)
макроионы – нет
-[CH2-CH]p-
-OOC-OOC-
h
-OOC-
-OOC-
H+
COOH
a (безПЭ )
E M RT ln i
zF
ai (сПЭ)
z – заряд иона,
F – число Фарадея
аi - осмотическая
активность ионов
могут проникать через мембрану,
Перенос малых ионов приводит к нарушению электронейтральности
раствора,
разделению макро- и малых противоионов и, как следствие, к
возникновению на мембране электрохимического потенциала (Ем),
препятствующего диффузии ионов. Малые противоионы фактически
перестают проходить через мембрану и являются осмотически активными
30
как и макроионы .
31.
В чем причина «аномального» поведенияполиэлектролитов?
А
HA
HA
A-
AH
AH
Fel.
HA
H+
K1
А) - Первая
группа диссоциирует аналогично низкомолекулярному
электролиту с константой диссоциации К1. В процессе диссоциации
уходящий Н+ преодолевает притяжение противоположно заряженной
группы –А-.
31
32.
ВБ
H+
AHA
AH
H
A-
A-
Fel.
HA
A- F
A-
F
+ el.
AH
Fel.
AH
H+
H+
el.
HA
Fel.
H+ HA
32
H+
H+
Так не
бывает.
Осмос и
Кулон
работают
H+
K3 < K 2 < K 1
K2 < K 1
Б) – Так как все заряды связаны в цепь, то при диссоциации второй
группы второй протон попадает в поле электростатического притяжения
уже двух групп А-. Электростатическая работа по разделению зарядов
возрастает, поэтому вторая группа диссоциирует “труднее”, т.е. с меньшей
константой ( K1 > К2 ) .
В) – Из-за возрастающей силы электростатического притяжения ( Fel )
диссоциация каждой последующей группы происходит всё “труднее”, т.е. с
ростом степени диссоциации
константа диссоциации монотонно
уменьшается ( Кn < …< K3 < K2 < K1) , а соответствующая ей величина рК –
монотонно возрастает.
33.
Конденсация (связывание) противоионов при диссоциацииполиэлектролита за счёт электростатических
взаимодействий.
A
Чем больше заряд клубка, тем
больше доля сконденсированных
(связанных) противоионов,
Б
Gдисс ( ) Gион G эл ( ) Gконф
G0ион. – изменение энергии Гиббса при
удалении 1-го протона от нейтральной
макромолекулы.
G0эл.( ) – работа против эл.поля - изменение
электростатической составляющей энергии
Гиббса (в расчете на ионогенную группу
полиэлектролита) при удалении моля протонов
от моля частично ионизованных макромолекул
степени диссоциации .
pK=0.434 ( G0ион. + G0эл.) / RT
33
34.
Константа диссоциации полимерной слабой кислоты
зависит:
От ионной силы раствора ( легко регулировать !!!!)
От конфигурации макромолекул (синтез)
От конформационного состояния макромолекул (Кулон и
т\дин. качество)
Gдисс ( ) Gион G эл ( ) Gконф
• не зависит
от молекулярной массы полимера
34
35.
Изотонический физиологический раствор - водный раствор NаСl 0.9%-ной конц.Гипертонический физиологический раствор -- «
«
Гипотонический физиологический раствор – «
«
« NаСl 2,0%-ной конц
« NаСl 0,1 – 0,2 %-ной
осмотический шок
Зависимость рК от для полимерной кислоты
pK
Без соли
pK
ПЭ
СН3 СООН
в присутствии
NaCl (конц.?)
низкомолекулярный электролит
pK0
35
36.
Для идеального случаяид. RTnm
Осмотическое давление определяется количеством противоионов, которых в растворе
существенно больше, чем макроионов из данных осмометрии бессолевых
водных растворов определить Мол.Массу полиэлектролита нельзя!
Уравнение состояния водного бессолевого раствора полиэлектролита
ni – концентрация противоионов (моль/л)
np – концентрация ПЭ (моль/л)
nm = np. P – концентрация ПЭ (осново-моль/л)
- степень диссоциации ПЭ
Реальное (экспериментально определяемое) осмотическое
давление всегда меньше идеального: ид.= Ф<1
Ф (осмотический коэффициент) – доля свободных (несвязанных с
макроионом) противоионов, вносящих вклад в осмотическое давление
раствора полиэлектролита.
ФRTnm
Для реального раствора
полиэлектролита
36
37.
Как сделать диссоциацию полиэлектролита похожей на диссоциациюнизкомолекулярного электролита?
H+
H+
AHA
A-
A-
AH H+
Введение низкомолекулярной соли (например,
NaCl) приводит к «встраиванию» ионов Na+ в
клубок и ослаблению притяжения между ионами
Н+ и –СОО- (это называется «экранированием»
электростатических взаимодействий).
В результате Gэл понижается и диссоциация
поликислоты становится похожей
на диссоциацию низкомолекулярной кислоты.
HA
Соль
Кривая титрования полимерной
кислоты щелочью (NaOH)
pH
Без соли
рН
СН3 СООН
в присутствии
NaCl
VNaOH
VNaOH(total)
VNaOH
α=0
α=1
37
38.
Что такое эффект Доннана?= gh
h
NaCl
Растворитель
Н2 О
nS ’
Рассмотрим
для
равновесная
электролита
NaCl
мембрана
простоты
случай
концентрация
(например,NaCl)
nS
псевдоидеального
раствора;
низкомолекулярного
ns
–
в
ячейке
полиэлектролитом; ns‘–в ячейке без полиэлектролита;
38
с
39. ВОДНЫЙ СОЛЕВОЙ РАСТВОР ПОЛИЭЛЕКТРОЛИТА
ионы низкомолекулярного электролита(соли) могут проникать через мембрану,
макроионы - нет!
При равновесии устанавливается равенство
химических потенциалов всех компонентов по обе
стороны мембраны, фактически равенство
Если заряд полиэлектролита Z > 0,
активностей диффундирующего электролита
то условие электронейтральности
(соли).
растворов:
[n-]=[n+] + [npZ]
[n-]=[n+]
a+.a-= a+.a-
( )2n+.n-=( )2n+.n-
Несложные выкладки приводят к выражению
равновесия Доннана (rД):
отношение концентраций соли по обе стороны мембраны
равно отношению концентраций ионов одного знака с
макроионом (коионов) или обратному отношению
концентраций противоионов.
[ns]/ [ns] =rД=[n+]/[n+]=[n-]/[n-]
39
40.
Cl- (n0s)Cl- (nm)
Cl-(n0s-x)
Cl-(nm+x)
Na+ (n0s)
Pn+ (nm)
Na+ (n0s-x)
Pn+ (nm)
Na+ (x)
НАЧАЛО
РАВНОВЕСИЕ
Условие равенства химических
потенциалов приводит к:
отсюда находим [ x ]
Выводы:
[ns0 ]
[nm ] 2[ns0 ]
[n0s-x]2= [x][nm+x]
[nm]
, это значение подставляем в уравнение равновесия Доннана:
rД= [n0s] /[n0s]= [n+] /[n+]= [n0s-x] /[x]= 1
[ nm ]
[ns0 ]
1.Если [n0s]>>[nm] rД 1 ионы равномерно распределены
2.[ n0s]> [n0s] полиэлектролит "вытесняет" соль из своей ячейки
3.[n+]>[n+]
концентрация коионов больше в ячейке без макроионов, а
концентрация противоионов больше в ячейке с макроионами
[n-]<[n-]
и как следствие на мембране возникает разность электрохимических
потенциалов Ем:
z – заряд иона,
a
(
безПЭ
)
F – число Фарадея
E M RT ln i
zF
ai (сПЭ)
40
41.
Что такое эффект Доннана?n n n n
' 2
S
n
' 2
S
2
S
n
S
S
m
ns – в ячейке с полиэлектролитом;
ns‘–в ячейке без полиэлектролита
rD – отношение Доннана
n'S
rD
nS
nm
1
nS
nm
1
1
nS
- Концентрация соли в ячейке без полиэлектролита ( ns‘)
-
всегда выше.
- Эффект Доннана – эффект вытеснения макромолекулами
полиэлектролита низкомолекулярной соли из ячейки с
раствором полиэлектролита.
- Чем выше заряд на полиэлектролите и чем меньше общая
концентрация соли в системе, тем сильнее выражен этот
эффект.
41
42.
Что такое полиэлектролитное набухание макромолекулы?Чем оно вызвано?
С – концентрация полимера в г/дл
1 – Зависимость приведенной
вязкости от концентрации в
растворе
для
«обычного»
полимера – неполиэлектролита.
пр.
2
1
2 – Аномальное поведение
раствора полиэлектролита
– возрастание приведенной
вязкости при разбавлении –
соон
это явление получило
название
«полиэлектролитного
набухания
макромолекулы».
-
HOOC
-
C
COOH
42
43.
Причины полиэлектролитного набухания:при уменьшении концентрации раствора:
- степень диссоциации полиэлектролита растёт.
- количество конденсированных(связанных
с макроионом) противоионов уменьшается
- заряд клубка растёт
- усиливается электростатическое
отталкивание звеньев внутри клубка
- клубок разворачивается и приведенная
вязкость увеличивается
- Рисунок на следующем слайде
43
44.
При введении низкомолекулярной соли подавляется эффект полиэлектролитногонабухания
44
соль
пр
соль
C = const
соль
При введении соли в раствор
происходит подавление полиэлектролитного
набухания:
- количество конденсированных
противоионов увеличивается
- эффективный заряд клубка
уменьшается
- уменьшается электростатическое
отталкивание звеньев внутри клубка
[NaCl]
-
- клубок сворачивается
приведенная вязкость уменьшается.
45.
Что такое изоионное разбавление?45
-[CH2-CH]p-
COO- Na+
пр
Полиакрилат
натрия
1
2
3
4
5
C
1 – [NaCl] = 0 (эффект полиэлектролитного набухания);
2 - [NaCl] < [Na+]полимер; (концентрация соли меньше мольной концентрации
противоионов полиэлектролита в растворе);
3 - [NaCl] = [Na+]полимер –изоионное разбавление (концентрация соли РАВНА
мольной концентрации противоионов полиэлектролита в растворе)
4 - [NaCl] > [Na+]полимер; (концентрация соли больше мольной концентрации
противоионов полиэлектролита в растворе)
5 - [NaCl] >> [Na+]полимер; (полное подавление полиэлектролитного эффекта в
избытке соли)
46. ГИДРОДИНАМИКА (вискозиметрия) РАСТВОРОВ ПОЛИЭЛЕКТРОЛИТОВ
[ ] (или мол. массу) полиэлектролитов вискозиметрически можноопределять или в условиях изоионного разбавления или в растворителях, в
которых нет ионизации макромолекул.
Jр-ра=JПЭ + JНМЭ
JПЭ=nm
Условие изоионного
разбавления:
JПЭ = JНМЭ
- доля свободных противоионов
полиэлектролита, < 1
- степень диссоциации
полиэлектролита
nm - осново-мольная концентрация
полиэлектролита
ns – концентрация соли
ns=nm
46
47.
Как влияет диссоциация на размеры макромолекул?Полиэлектролит без вторичной структуры – полиакриловая кислота
-[CH2-CH]p-
47
COOH
Ионизация
Полиакриловая
кислота
пр.
2 - Конденсация
противоионов
Ионизация
пр. ~
Vмакромолекула
M макромолекула
M ~ const
пр. ~ V макромолекула
1 - Ионизация
1 – ионизация отталкивание зарядов на
цепи клубок разворачивается пр растёт
конденсация
противоионов
преобладает
над
ионизацией
отталкивание зарядов уменьшается
клубок сворачивается пр падает
2
–
48.
CH2CH
COOH
CH2
CH
Na OH
n
COOH
CH2
CH
CH2
COO Na
CH
n
COO Na
• увеличение концентрации NaOH увеличение числа
одноименных зарядов в цепи и силы отталкивания между
ними. Макромолекулы разворачиваются приведенная
вязкость возрастает
• после =0.5 – 0.8 ионная сила раствора увеличивается и заряды
на цепи экранируются приведенная вязкость падает
• при увеличении концентрации ПЭ (С2>С1) ионная сила раствора
повышается заряды на цепи экранируются кривая
зависимости приведенной вязкости от pH понижается
48
49.
Как влияет диссоциация на размеры макромолекул?Полиэлектролит со вторичной структурой – полиметакриловая кислота
CH3
пр
-[CH2-C]p-
Конденсация
противоионов
COOH
Ионизация
-OOC-
-COO-COOH
HOOC-OOC-
Гидрофобные взаимодействия,
компактная конформация сохраняется
-COOH
HOOCHOOC-
-COOH
-COOH
49
50.
Полиэлектролит со вторичной структурой –полиглутаминовая кислота
Б – Поли(Glu)
H
-[HN-C-CO]p-
пр.
(CH2)2
-Спираль
COOH
Полиаглутминовая
кислота,
поли(Glu)
Клубок
рН ( )
α-спираль
мало заряженный клубок
HOOC
COOH
HOOC
сильно заряженный клубок H+
H-COOH
-COO-
COOH
-COO-
-COOH
-COOH
NaOH
HOOC
COOH
-OOC-
HOOC
NaOH
HOOC-
H+
-COOH
-COOH
COOH
-COO-
+
-OOC-
-COO-COO-
H+
COOH
пр . ~ M 1.8
H+
пр . ~ M 0.5
пр. ~ M 0.7
50
51. ПОЛИАМФОЛИТЫ
макромолекулы, содержащие одновременно кислотные и основныегруппы, в зависимости от pH среды могут вести себя либо как поликислоты,
либо как полиоснования.
ИЭТ (изоэлектрическая точка) –
значение pH раствора
полиамфолита, при котором средний
суммарный заряд макромолекулы
равен нулю. ИЭТ не зависит от
концентрации полиамфолита и
определяется только его химической
природой.
51
52.
ИИТ (изоионная точка) – значение pH водного раствораполиамфолита (в отсутствие посторонних ионов), которое
определяется только диссоциацией собственных
ионогенных групп.
В изоионном растворе: npZ + [H+] = [OH-]
при Z=0
[H+]=[OH-] при pH=7
ИИТ=ИЭТ
52
53.
Взаимосвязь изоионной и изоэлектрических точекИзоионная точка (ИИТ) – рН водного бессолевого раствора
полиамфолита.
справедливо уравнение электронейтральности:
Zn p [ H ] [OH ] 0
[OH ] [ H ]
Z
np
1. Если значение ИИТ в щелочной области, то ИЭТ – правее
на шкале рН (если ИИТ= 9, то ИЭТ > 9 )
2.Если значение ИИТ в кислой области, то ИЭТ - левее на
шкале рН (если ИИТ = 5, то ИЭТ<5)
3. Если ИИТ = 7, то и ИЭТ = 7.
53
54. СПЕЦИФИЧЕСКОЕ СВЯЗЫВАНИЕ ИОНОВ ПОЛИАМФОЛИТАМИ
ИИТ и ИЭТ оченьчувствительны к
влиянию солей.
-
+
-
-
-
+
-
+
+
+
- +
+-
+
+
+
+ -
-
-
+
-
Специфическое
связывание анионов +Х
-
-
+
-
-
-
+
+
Х-
ИЭТ
1.на макромолекуле появляется
нескомпенсированный отрицательный
заряд (число "-" превышает число "+")
2.для Z=0 необходимо добавить
положительный заряд, т.е.
подкислить
3.ИЭТ смещается в кислую
область
- +
-
++ Х-
+
-
+
+
+
-
-
+
-
-
-
+ Х-
+
Х-
ИИТ
1.при адсорбции анионов часть OH-,
связанных с полиионном, вытесняется
в раствор
2.для восстановления прежнего
состояния макромолекулы надо
добавить OH-
3.ИИТ смещается в щелочную
54
область
55.
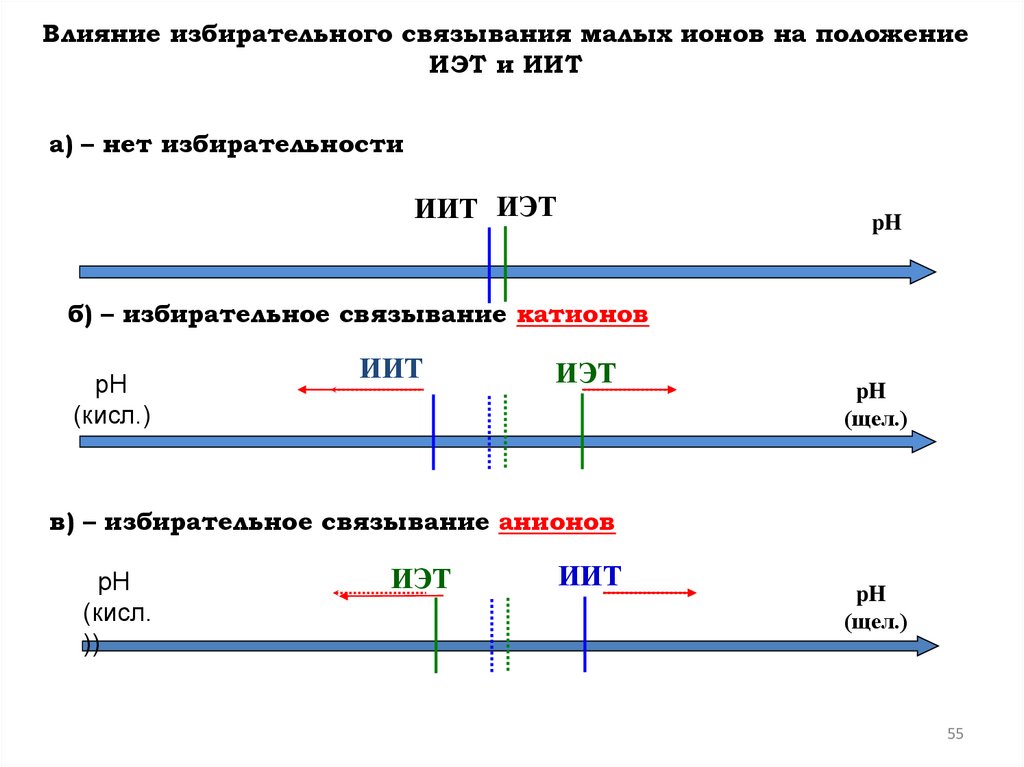
Влияние избирательного связывания малых ионов на положениеИЭТ и ИИТ
a) – нет избирательности
ИИТ ИЭТ
pH
б) – избирательное связывание катионов
рН
(кисл.)
ИИТ
ИЭТ
pH
(щел.)
в) – избирательное связывание анионов
рН
(кисл.
))
ИЭТ
ИИТ
pH
(щел.)
55
56.
Как экспериментально определить изоэлектрическую точку?Растворимость
иэт
I
Желатина (денатурированный
белок)
pH
В ИЭТ многие свойства (осмотическое давление,
электрофоретическая подвижность, растворимость,
удельная вязкость (для клубков) и др.) принимают
минимальные значения
56
57. Поликомплексы ПМАК с ПЭГ в водных растворах, стабилизированные водородными связями и гидрофобными взаимодействиями
CH3CH2
CH3
C
CH2
COOH
CH2
O
Олигомерный ПЭГ (М1 и М2) не образует
комплекс с ПМАК, т.к. проигрыш в
энтропии больше, чем выигрыш в
энергии взаимодействия. Проигрыш в
энтропии падает с увеличением ММ.
Равенство проигрыша и выигрыша
комплекс
C
COOH
CH2
CH2
O
M3
M1
M2
M3>M2>M1
ПМАК
ПЭГ
ηпр.
25 0С
40 0С
4000
MM ПЭГ
компактные
частицы
поликомплексы
компактизуются за счёт
гидрофобных взаимодействий
критическая ММ
MM 105
1000, 2000, 4000, 10000
Повышение температуры усиливает
гидрофобные
взаимодействия
компактизация сильнее
(кривая идёт ниже и участок абсциссы мм ПЭГ
57
короче)
58. ПОЛИЭЛЕКТРОЛИТНЫЕ КОМПЛЕКСЫ, стабилизированные солевыми связями
CH2CH
CH2
COO H
CH
n
COO H
HOH
CH2
NH2*HCl
NH2*HCl
CH
CH
CH2
COO
COO
NH3
NH3
nH nCl
сдвиг равновесия при добавлении щелочи
n
- степень превращения
концентрация солевых связей
концентрация полиэлектролитов (осново-моль/л)
за счет непрореагировавшей
поликислоты
q NaCl
с сол с0
H H
V0
(кол-во
щелочи)
(г-ион/л
в р-ре)
K дисс. ПК с0
Энергия образования солевых связей мала, меньше кТ, но велик выигрыш
в энтропии
за счёт выделения огромного количества низкомолекулярных ионов (HCl).
58
59. Полиэлектролитные комплексы, стабилизированные солевыми связями
NH3+ OHCH2CH
CH2
COO Na
CH
n
COO Na
HOH
NH2
CH2
CH
CH2
CH
qHCl
с сол с0
OH OH
V0
количество
HCl (г-экв)
COO
NH3
NH3
nNa
nOH
NH2
n
COO
KW c0
K дисс. ПO
сдвиг равновесия при добавлении
кислоты
за счет непрореагировавшего
полиоснования
KW- ионное произведение воды
Образование поликомлексов – процесс кооперативный
причина взаимосвязанность функциональных групп в макромолекуле
признак узость интервала изменения условий (pH, t0, I, c…)
движущая сила энтропийный выигрыш за счет выделения множества
низкомолекулярных ионов
59
60.
поликомплексы могут быть разрушены при изменении pHсильная поликислота + слабое
полиоснование
SO3 H
SO3 H
NH2
NH2
комплекс разрушается при pH > 9,
т.к. основные группы теряют заряд
слабая поликислота + сильное
полиоснование
N
N
Br
Br
C 2H 5
C 2H 5
COOH
COOH
комплекс разрушается при pH < 3,
т.к. кислотные группы теряют заряд
Поликомплексы на основе сильных поликислот и сильных
полиоснований
60
не разрушаются ни при каких рН и они нерастворимы
61. ИОННООБМЕННЫЕ СМОЛЫ
Катиониты (обмен катионов)-
-
- SO3 H+
Ионное
равновесие:
- COO H+
1
1
RM1
M2
Z1
Z2
Аниониты (обмен анионов)
- NH3+Cl
-
- NR3+Cl
-
1
1
RM 2 M1 M1, M2 – обменивающиеся
Z2
Z1
ионы;
Z1, Z2 – их заряды
1 –доля ионов М1, сорбированных на
матрице
1 – доля ионов М1 в растворе
1
1 – реально не наблюдается
2,3 – предпочтение в обмене одному из
ионов (селективность)
2
1
3
61
62. ОБМЕННАЯ ЕМКОСТЬ ИОНИТОВ
- количество (мг-экв) способных к обменуОБМЕННАЯ ЕМКОСТЬ ИОНИТОВ ионов в единице массы (1 г) сухого или в
единице объема (1см3) набухшего ионита
ПОЛНАЯ ОБМЕННАЯ
- количество ионогенных групп (постоянная величина)
ЕМКОСТЬ (ПОЕ)
РАВНОВЕСНАЯ ОБМЕННАЯ - зависит от условий обмена: pH, t0, концентрации,
ЕМКОСТЬ (РОЕ)
структуры ионита, химической природы ионита,
набухаемости (переменная величина)
Для сильных катионитов и анионитов нет зависимости РОЕ от pH.
Равновесная обменная емкость равна полной обменной емкости.
Для слабых катионитов и анионитов РОЕ зависит от pH.
Е
Е
(РОЕ)
(РОЕ)
3
9 pH
для слабых анионитов
3
9 pH
для слабых катионитов
62
63.
Гидрогели(сшитые водонабухающие и не
только полимеры). Практическое применение.
62
•Гемосорбент «Овосорб» для гемоперфузии в случае панкреатита,
перитонита, сепсиса, тяжелой аллергии, термических ожогов.
•Сорбент на основе L-лизина для препаративного выделения
плазминогена из плазмы крови
•Гемосовместимые покрытия на основе гепарин-содержащих гелей
для полиэтиленовых и полиэфирных катетеров и протезов
кровеносных сосудов.
•Гидрогелевые дренажи в офтальмологии при операциях по
вторичной катаракте.
•Трансдермальные гидрогели, содержащие лекарственные
препараты, выделяющиеся из геля при изменении условий (t, pH).
Подгузники.
•Гидрогелевые биоинертные протезы глазного яблока и некоторых
других внутренних органов.
64. ПОЛУЧЕНИЕ СШИТЫХ СОРБЕНТОВ
CH2CH2
CH2
CH
CH
CH2
CH
CH2
CH
H2 C
CH
CH2
CH
CH
CH2
CH
CH2
CH
CH2
CH
R*
CH
+
Получение
сшитого
полистирола.
CH2
CH
CH2
сетчатая структура
CH2
H2SO4
CH
n
сульфокатиониты
n
ClSO2H (H2O)
Модификация
сшитого
полистирола.
SO3 H
PCl3
CH2
H2O
CH
PCl2
CH2
CH
OH
P
HO
O
64
65. ПОЛУЧЕНИЕ СШИТЫХ СОРБЕНТОВ
CH2CH2
CH2
CH
CH
CH2
CH
CH2
CH
H2 C
CH
CH2
CH
CH
CH2
CH
CH2
CH
CH2
CH
R*
CH
+
Получение
сшитого
полистирола.
CH2
CH
CH2
сетчатая структура
CH2
H2SO4
CH
n
сульфокатиониты
n
ClSO2H (H2O)
Модификация
сшитого
полистирола.
SO3 H
PCl3
CH2
H2O
CH
PCl2
CH2
CH
OH
P
HO
O
65
66.
Полимеризация мономеров с ионногенными группами вприсутствии сшивателя
CH2
CH
+
CH2
CH
O C
COOH
NH CH2
CH
CH2
C O
NH
Поликонденсация многофункциональных мономеров (более 2-х
функциональных групп)
HOOC
COOH
+
HOOC
H2N-R-NH2
COOH
66
67.
Полимеризация мономеров с ионногенными группами вприсутствии сшивателя
CH2
CH
+
CH2
CH
O C
COOH
NH CH2
CH
CH2
C O
NH
Поликонденсация многофункциональных мономеров (более 2-х
функциональных групп)
HOOC
COOH
+
HOOC
H2N-R-NH2
COOH
67
68.
Полиэлектролиты и их производныеНапример, катионный гидрогель на основе тройного сополимера
N,N’-диметил-N,N’-диаллиламмоний хлорида, акриламида
и N,N’-метиленбисакриламида.
(- CH2 - CH - CH - CH2 -)n
H 2C
Cl N
H3C
CH2
CH3
-Сетчатые полиэлектролиты - эффективные носители для
иммобилизации или разделения белков, ПАВ, противоположно
заряженных полиэлектролитов.
-Необходимым условием транспорта таких веществ в геле
является интерполиэлектролитная реакция обмена на границе
раздела гель-интерполиэлектролитный комплекс.
25
69.
IMc
+I
I
+
диметиламиностирол
+(CH3)2SO4
I
N
ДВБ
N(CH3)2
Дорогой синтез
таких мономеров
20
(CH3) SO4-
N+(CH3)3
70.
Конец полиэлектролитов
ФФФХИ 2020 – 2021 - 2022
70
71.
7172.
7273. Задачи для семинаров
Задание 3. Как изменится (уменьшится, увеличится, не изменится, нельзяответить однозначно) величина рН водного раствора а) ПАК, б)
поливиниламина, в) полиакриламида при добавлении в раствор хлорида
натрия?
Задание 4. На одном графике схематически изобразить зависимость
приведенной вязкости ( пр.) от концентрации полимера (С) для бессолевого
водного раствора ПАК и раствора ПАК в диоксане.
Определите, где какая зависимость и прокомментировать почему так.
Задание 5. Изоионная точка (ИИТ) полиамфолита равна 5.0.
Каково соотношение (<, >, =, нельзя ответить однозначно) между изоионной
и изоэлектрической (ИЭТ) точками данного полиамфолита?
73
74.
Полиамфолиты: изоионная и изоэлектрическая точкиИИТ (изоионная точка) – значение pH
водного
раствора
полиамфолита
(в
отсутствие посторонних ионов), которое
определяется
только
диссоциацией
собственных
ионогенных
групп.
С
уменьшением
концентрации
изоионного
раствора
полиамфолита
увеличивается
эффективный заряд макромолекул и pH
меняется (в кислой области растет, а в
щелочной - падает).
В изоионном растворе: npZ + [H+]=[OH-]
при Z=0
[H+]=[OH-] при pH=7 ИИТ=ИЭТ
ИЭТ (изоэлектрическая точка) – значение pH
раствора полиамфолита, при котором средний
суммарный заряд макромолекулы равен нулю. ИЭТ
не зависит от концентрации полиамфолита и
74
определяется только его химической природой
75.
H+H+
AHA
A-
AAH
HA
H+
Соль
75









































































 Химия
Химия