Похожие презентации:
Окислительно-восстановительные реакции. Урок в 11 классе
1.
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕРЕАКЦИИ
Урок в 11 классе
Цырендоржиева Н.Н.
2.
Задачи урока:Закрепить умения применять понятие
«степень окисления» на практике.
Обобщить и дополнить знания об опорных
понятиях теории ОВР.
Совершенствовать умение применять эти
понятия на различных типах реакций ОВР в
заданиях ЕГЭ.
3.
Окислитель и восстановительОкислителем называют реагент, который
принимает электроны в ходе
окислительно-восстановительной
реакции.
Восстановителем называют реагент,
который отдает электроны в ходе
окислительно-восстановительной
реакции.
4.
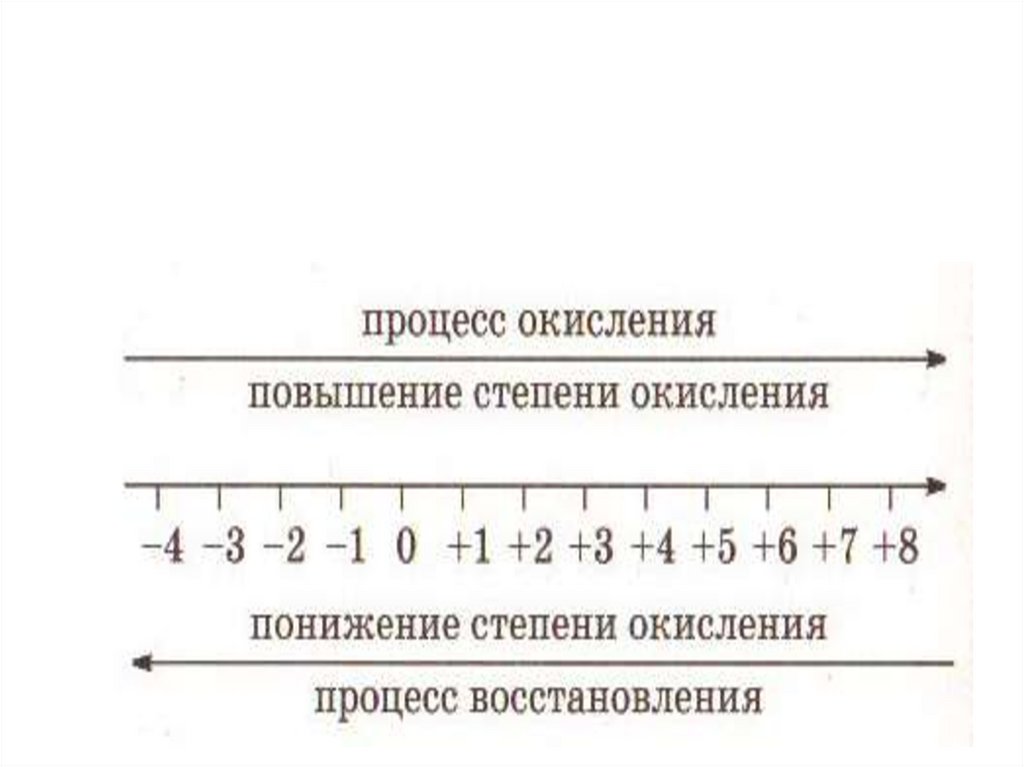
ПРОЦЕСС ОКИСЛЕНИЯ ИВОССТАНОВЛЕНИЯ
Окислением называют процесс отдачи
электронов атомом, молекулой или
ионом, который сопровождается
повышением степени окисления.
Восстановлением называют процесс
присоединения электронов атомом,
молекулой или ионом, который
сопровождается понижением степени
окисления.
5.
6.
Какие из перечисленных ниже процессов представляют собой: окисление (0), какие –восстановление (В)?
7.
8.
Правила определения функции соединения в окислительновосстановительных реакциях.1. Если элемент проявляет в соединении высшую степень
окисления, то это соединение может быть окислителем.
2. Если элемент проявляет в соединении низшую степени
окисления, то это соединение может быть восстановителем.
3. Если элемент проявляет в соединении промежуточную степень
окисления, то это соединение может быть как воcстановителем,
так и окислителем.
Задание:
Предскажите функции веществ в окислительно-восстановительных
реакциях:
9.
1.Установите соответствие между свойствами серы и уравнением ОВР, вкотором она проявляет эти свойства.
Свойства серы
Уравнение ОВР
А) окислитель
1) 3 S + 2 H2O(пар) = 2H2S + SO2
Б) восстановитель
2) FeS + 2 HCl = FeCl2 + H2S
В) и окислитель, и
3) 2 H2S + 3 O2 = 2 H2O + 2 SO2
восстановитель
4) 2 SO3 = 2 SO2 + O2
Г) ни окислитель,
ни восстановитель
2.Установите соответствие между изменением с.о. хлора и схемой реакции.
Изменение с.о. хлора
Схема реакции
А) Cl+4 Cl+3
1) Cl2 + Al4C3 AlCl3 + CCl4
Б) Cl+1 Cl-1
В) Cl+5 Cl-1
Г) Cl-1 Cl0
2) HCl + MnO2 MnCl2 + Cl2 + H2O
3) KClO3 + P KCl + P2O5
4) ClO2 + H2O2 HClO2 + O2
5) KClO4 KCl + O2
6) HClO + HI HCl + I2 + H2O
10.
Ответы:1.
4312
2.
4652
11.
• Основные окислители ивосстановители
12.
ВосстановительАтомы металлов
Сила
Среда, условия
Сила восстановителя зависит от свойств металла
водород
Слабый восстановитель
углерод
Сильный восстановитель
До чего
окисляется
Ионы металлов
Ионы водорода
При взаимодействии с окислителем
средней силы
СO
При взаимодействии с сильным
окислителем
СO2
Фосфор, сера
Слабые восстановители
При взаимодействии с сильным
окислителем
P2O5 , H3PO4
SO2 , H2SO4
H2S и ее соли
Сильный восстановитель
При взаимодействии с окислителем
средней силы
S0
При взаимодействии с сильным
окислителем
S+6
(в виде SO4 2-)
SO2 и соли H2SO3
Слабый восстановитель
SO3 , H2SO4 и ее
соли
Азотистая кислота HNO2 и ее соли
Слабый восстановитель
Азотная кислота
HNO3 и ее
соли
Cu +
Слабый восстановитель
Cu 2+
Fe2+ , Cr2+
Сильный восстановитель
Cr3+
Галогеноводородные кислоты и их соли
H2O2 (О -1)
Слабый восстановитель
Сильные восстановители (HCl слабый)
Слабый восстановитель
В кислой среде
Fe 3+ , Cr 3+
В щелочной среде
Fe(ОН)3 ,
Cr(ОН)3
В кислой среде
Cr2O7 2-
В щелочной среде
CrO4 2Галогены простые
вещества
O20
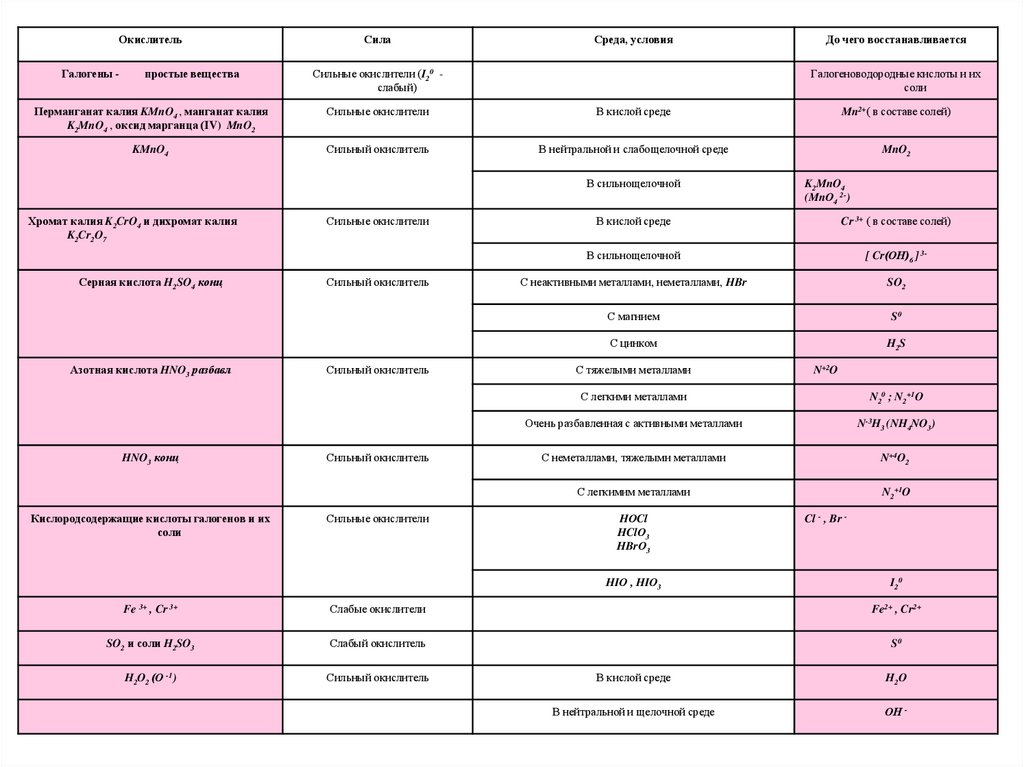
13.
ОкислительГалогены -
простые вещества
Сила
Среда, условия
Сильные окислители (I20 слабый)
До чего восстанавливается
Галогеноводородные кислоты и их
соли
Перманганат калия KMnO4 , манганат калия
K2MnO4 , оксид марганца (IV) MnO2
Сильные окислители
В кислой среде
Mn2+( в составе солей)
KMnO4
Сильный окислитель
В нейтральной и слабощелочной среде
MnO2
В сильнощелочной
Хромат калия K2CrO4 и дихромат калия
K2Cr2O7
Серная кислота H2SO4 конц
Азотная кислота HNO3 разбавл
HNO3 конц
Кислородсодержащие кислоты галогенов и их
соли
Сильные окислители
Сильный окислитель
Сильный окислитель
Сильный окислитель
Сильные окислители
K2MnO4
(MnО4 2-)
В кислой среде
Cr 3+ ( в составе солей)
В сильнощелочной
[ Cr(ОН)6 ] 3-
С неактивными металлами, неметаллами, HBr
SO2
С магнием
S0
С цинком
H2S
С тяжелыми металлами
N+2O
С легкими металлами
N20 ; N2+1O
Очень разбавленная с активными металлами
N-3H3 (NH4NO3)
С неметаллами, тяжелыми металлами
N+4O2
С легкимим металлами
N2+1O
HОCl
HClО3
HBrО3
HIО , HIО3
Cl - , Br -
I20
Fe 3+ , Cr 3+
Слабые окислители
Fe2+ , Cr2+
SO2 и соли H2SO3
Слабый окислитель
S0
H2O2 (О -1)
Сильный окислитель
В кислой среде
H2O
В нейтральной и щелочной среде
ОН -
14.
Сильным и достаточно распространенным окислителем является перманганат калия,который в различных средах восстанавливается до соединений марганца в различных
с.о.
Mn2+ - кислая среда
(Mn+7 +5ē Mn+2);
KMnO4 MnO2 – нейтральная среда (Mn+7 +3ē Mn+4);
MnO42- - щелочная среда
(Mn+7 +ē Mn+6)
15.
Классификация ОВР1 . Межмолекулярные реакции- реакции
, которые идут с изменением степеней
окисления атомов в различных
молекулах.
KMnO + KI +H SO =MnSO + I + K SO + H O
4
2
4
4
2
2
4
2
16.
2 . Внутримолекулярные реакции –реакции, в которых атомы, изменяющие
свои степени окисления, находятся в одной
молекуле.
KClO = KCl + O2
3
17.
Реакции диспропорционирования(самоокисления-самовосстановления) –
реакции , которые идут с изменением
степени окисления атомов одного и того же
элемента.
Cl + KOH = KCl +KClO + H O
2
3
2
18.
Реакции компропорционирования – те, в которых атомы одного и того же элемента в различных с.о. врезультате реакции
приобретают одну и ту же с.о. Реакции компропорционирования бывают как межмолекулярными, так и
внутримолекулярными.
H S + SO = S+ H O
2
2
2
19.
Межмолекулярные реакции:Частицы- доноры электронов (восстановители) – и частицы- акцепторы
электронов (окислители) – находятся в разных веществах.
К этому типу относится большинство ОВР.
20.
Внутримолекулярные реакцииДонор электронов - восстановитель и акцептор электронов – окислитель –
находятся в одном и том же веществе
.
21.
Реакции диспропорционирования (самоокислениясамовосстановления)Атомы одного и того же элемента в веществе выполняют одновременно функции и
доноров электронов (восстановителей) и акцепторов электронов (окислителей).
Эти реакции возможны для веществ, содержащих атомы химических элементов в
промежуточной степени окисления.
22.
Составление окислительно-восстановительныхреакций в заданиях ЕГЭ часть С1
Схемы с пропусками веществ
1)Ключевые вещества не пропущены
2)Пропущено ключевое вещество слева
3) Пропущено ключевое вещество справа
23.
Ключевые вещества не пропущены.NO + KClO + … KNO3 + KCl + …
1. Указаны формулы окислителя и восстановителя, а также
формулы продуктов их восстановления и окисления.
2. Составление баланса, подобрать коэффициенты перед
формулами окислителя, восстановителя и соответствующих им
веществ в правой части схемы.
3. После этого подсчитать число атомов других элементов и
определить формулы пропущенных веществ.
24.
Ответ:N+2 - 3ē N+5
Cl+1 + 2ē Cl-1
2 окисляется,
N+2 - восстановитель
3 восстанавливается, Cl+1 – окислитель
2 NO + 3 KClO + … 2 KNO3 + 3 KCl + …
2 NO + 3 KClO + 2 КОН = 2 KNO3 + 3 KCl + Н2О
25.
Пропущено ключевое вещество слева• … + KMn+7O4 + … N02 + К2Mn+6O4 +
…
1. Определение степени окисления частиц в веществах.
2. Логическое рассуждение (предположить формулу пропущенного
ключевого вещества).
3. Составление баланса.
4. Коэффициенты перед ключевыми веществами и продуктами их
превращения в правой части схемы, подсчетом атомов других элементов
(не изменивших с.о.) определяют формулы остальных пропущенных
веществ.
26.
Ответ:2 N-3 - 6ē N02
Mn+7 + ē Mn+6
1 окисляется,
N-3 - восстановитель
6 восстанавливается, Mn+7 - окислитель
2 NH3 + 6 KMnO4 + … N2 + 6 К2MnO4 + …
2 NH3 + 6 KMnO4 + 6 КОН N2 + 6 К2MnO4 + 6 Н2О
27.
Пропущено ключевое вещество справа.Р-3Н3 + Ag+1NO3 + … Ag0 + … + HNO3.
1. Определение окислителя и восстановителя.
2. Восстановитель – фосфин за счет фосфора в с.о. -3. В результате
окисления фосфор должен повысить с.о.
3. Составление баланса.
4. Подбор коэффициентов.
28.
Ответ:Р-3Н3 + Ag+1NO3 + … Ag0 + Н3РО4 + HNO3.
Р-3 - 8ē Р+5
Ag+1 + ē Ag0
1 окисляется,
P-3 - восстановитель
8 восстанавливается, Ag+1 - окислитель
РН3 + 8 AgNO3 + … 8 Ag + Н3РО4 + 8 HNO3.
РН3 + 8 AgNO3 + 4 Н2О 8 Ag + Н3РО4 + 8 HNO3.
29.
Задания для самостоятельной работы1. Используя метод электронного баланса, составьте уравнение реакции:
Pt + HNO3 + HCl PtCl4 + NO + …
Определите окислитель и восстановитель.
2. Используя метод электронного баланса, составьте уравнение реакции:
C2H4 + K2Cr2O7 + H2SO4 CO2 + … + K2SO4 + …
Определите окислитель и восстановитель.
3. Используя метод электронного баланса, составьте уравнение реакции:
(NH4)2Cr2O7 Cr2O3 + N2 + …
Определите окислитель и восстановитель.
4. Используя метод электронного баланса, составьте уравнение реакции:
Br2 + Na2CO3 … + NaBrO3 + CO2
Определите окислитель и восстановитель.
30.
Ответы:1. Pt + HNO3 + HCl PtCl4 + NO + …
3 Pt + 4 HNO3 + 12 HCl = 3 PtCl4 + 4 NO + 8 H2O
Pt – восстановитель, HNO3 (или N+5) – окислитель.
2. C2H4 + K2Cr2O7 + H2SO4 CO2 + … + K2SO4 + …
C2H4 + 2 K2Cr2O7 + 8 H2SO4 = 2 CO2 + 2 Cr2(SO4)3 + 2 K2SO4 + 10 H2O
C2H4 (или С-2) – восстановитель, K2Cr2O7 (или Cr+6) – окислитель.
3. (NH4)2Cr2O7 Cr2O3 + N2 + …
(NH4)2Cr2O7 = Cr2O3 + N2 + 4 H2O
Азот в степени окисления -3 – восстановитель, хром в степени окисления +6 – окислитель.
4. Br2 + Na2CO3 … + NaBrO3 + CO2
3 Br2 + 3 Na2CO3 = 5 NaBr + NaBrO3 + 3 CO2
Br2 (или Br0) – и окислитель, и восстановитель: это реакция диспропорционирования.





























 Химия
Химия








