Похожие презентации:
Составление уравнений окислительно- восстановительных реакций (лекция 16)
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 16
СОСТАВЛЕНИЕ УРАВНЕНИЙ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ
РЕАКЦИЙ
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Нахождение коэффициентов в уравнениях
окислительно-восстановительных реакций методом
электронного баланса
Составление уравнений окислительновосстановительных реакций методом электронноионного баланса
Составление уравнений реакций, протекающих в кислой
среде
Составление уравнений реакций, протекающих в
щелочной среде
Составление уравнений реакций, протекающих в
нейтральной среде
Составление уравнений реакций с незаданной средой
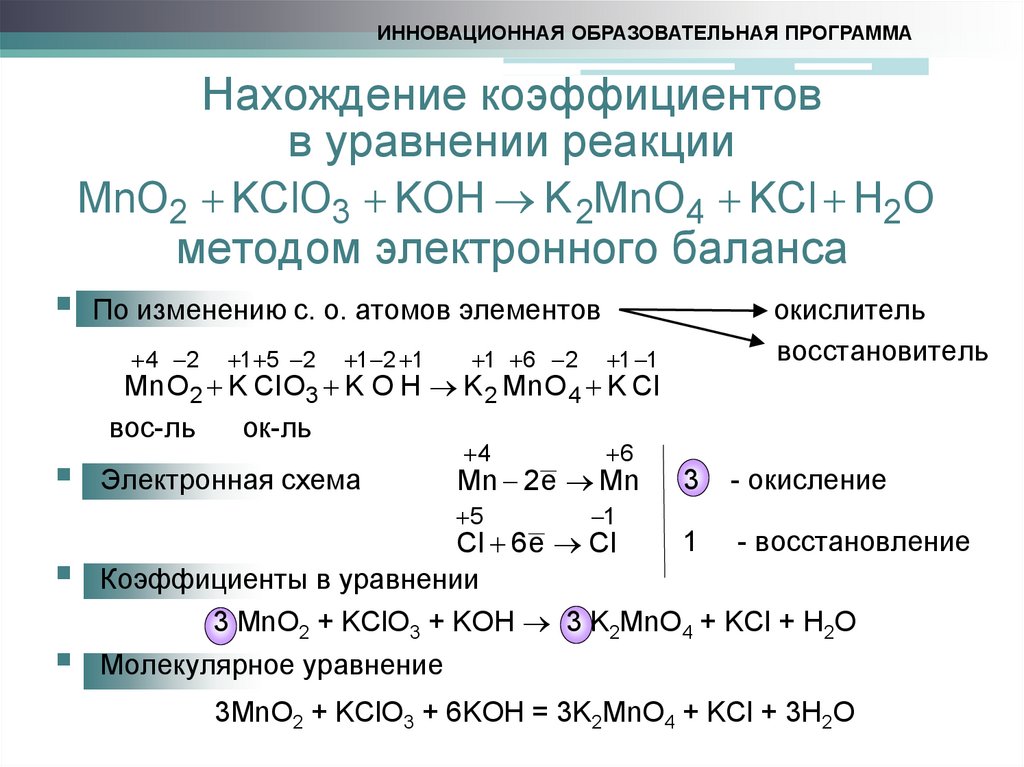
3. Нахождение коэффициентов в уравнении реакции методом электронного баланса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАНахождение коэффициентов
в уравнении реакции
MnO2 KClO3 KOH K 2MnO4 KCl H2O
методом электронного баланса
По изменению с. о. атомов элементов
4 2
1 5 2
1 2 1
1 6 2
1 1
4
6
окислитель
восстановитель
Mn O 2 K Cl O3 K O H K 2 Mn O 4 K Cl
вос-ль
ок-ль
Электронная схема
Mn 2e Mn
5
3
- окисление
1
1 - восстановление
Cl 6 e Cl
Коэффициенты в уравнении
3 MnO2 + KClO3 + KOH 3 K2MnO4 + KCl + H2O
Молекулярное уравнение
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
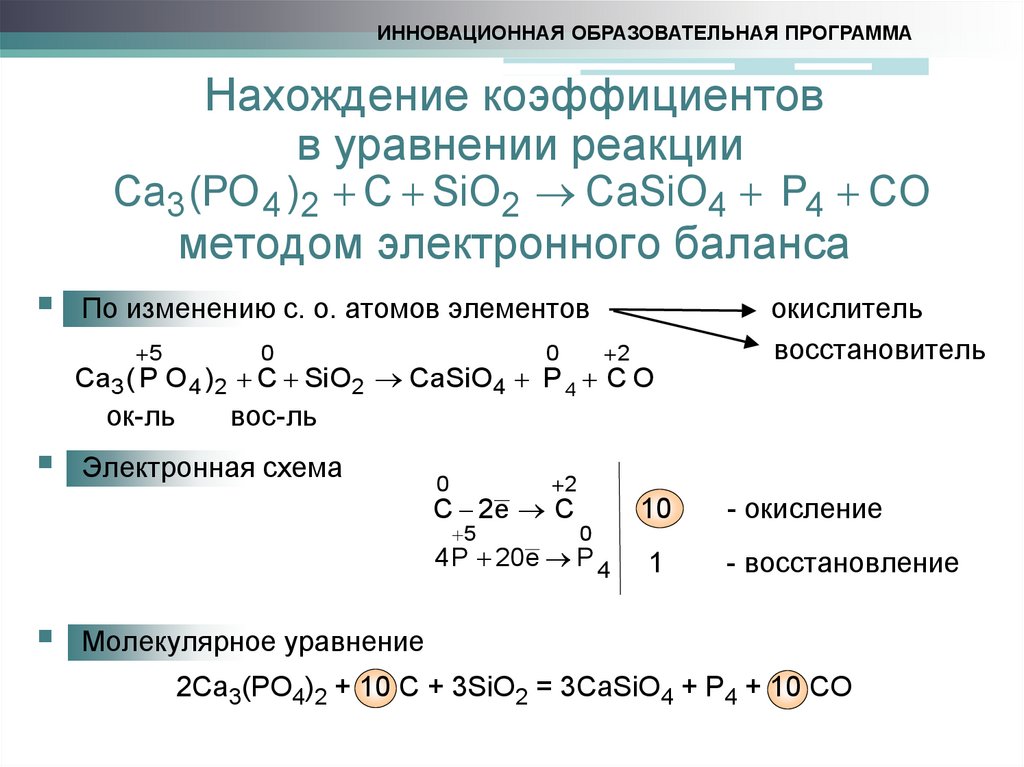
4. Нахождение коэффициентов в уравнении реакции методом электронного баланса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАНахождение коэффициентов
в уравнении реакции
Ca3 (PO 4 )2 C SiO2 CaSiO4 P4 CO
методом электронного баланса
По изменению с. о. атомов элементов
5
0
2
0
Ca3 ( P O 4 )2 C SiO2 CaSiO4 P 4 C O
ок-ль
вос-ль
Электронная схема
2
0
C 2e C
5
окислитель
восстановитель
10
- окисление
1
- восстановление
0
4 P 20 e P 4
Молекулярное уравнение
2Ca3(PO4)2 + 10 C + 3SiO2 = 3CaSiO4 + P4 + 10 CO
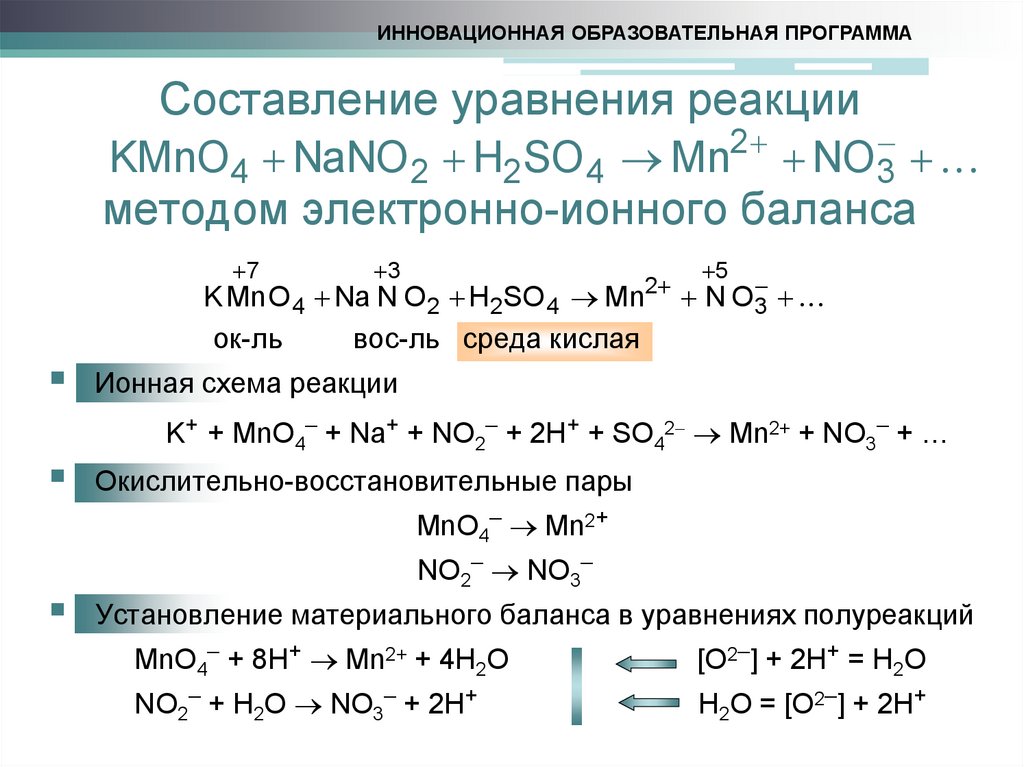
5. Составление уравнения реакции методом электронно-ионного баланса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнения реакции
KMnO4 NaNO 2 H2SO 4 Mn2 NO 3
методом электронно-ионного баланса
7
3
2
K Mn O 4 Na N O 2 H2SO 4 Mn
ок-ль
вос-ль среда кислая
5
N O3
Ионная схема реакции
K+ + MnO4 + Na+ + NO2 + 2H+ + SO42 Mn2+ + NO3 + …
Окислительно-восстановительные пары
MnO4 Mn2+
NO2 NO3
Установление материального баланса в уравнениях полуреакций
MnO4 + 8H+ Mn2+ + 4H2O
[O2 ] + 2H+ = H2O
NO2 + H2O NO3 + 2H+
H2O = [O2 ] + 2H+
6. Составление уравнения реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнения реакции
KMnO4 NaNO 2 H2SO 4 Mn2 NO 3
Расчет числа отданных и принятых электронов в полуреакциях
MnO4 + 8H+ + 5 e = Mn2+ + 4H2O
электронно-ионное уравнение
баланс зарядов: -1 + 8 + 5 ( -1) = +2
полуреакции восстановления
NO2 + H2O – 2 e = NO3 + 2H+
баланс зарядов: -1 – 2 ( -1) = -1 + 2
электронно-ионное уравнение
полуреакции окисления
Электронно-ионная схема реакции
MnO4 + 8H+ + 5 e = Mn2+ + 4H2O
2
NO2 + H2O – 2 e = NO3 + 2H+
5
2MnO4 + 5NO2 + 16H+ + 5H2O= 2Mn2+ + 5NO3 + 10H+ + 8H2O
Ионное и молекулярное уравнения реакции
2MnO4 + 5NO2 + 6H+ = 2Mn2+ + 5NO3 + 3H2O
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
7. Составление уравнений полуреакций с заданной кислой средой
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнений
полуреакций с заданной кислой средой
В электронно-ионные уравнения полуреакций с заданной кислой
средой помимо окисленных и восстановленных форм включают
ионы H+ и молекулы H2O
[O2-] + 2H+ = H2O
H2O = [O2-] + 2H+
Примеры электронно-ионных уравнений полуреакций
Cr2O72- Cr3+
Cr2O72- + 14H+ + 6 e = 2Cr3+ + 7H2O - полуреакция восстановления
PbS PbSO4
PbS + 4H2O – 8 e = PbSO4 + 8H+
- полуреакция окисления
Малорастворимые PbS и PbSO4 записаны в молекулярной форме
8. Составление уравнений полуреакций по балансу зарядов
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнений
полуреакций по балансу зарядов
Число отданных и принятых электронов в полуреакциях с участием
сложных частиц, содержащих атомы элемента в разных степенях
окисления, определяют по балансу зарядов
Пример 1.
Co3O4 + H+ Co2+
Co3O4 + 8H+ + х e = 3Co2+ + 4H2O
баланс зарядов: 8 + х( -1) = 6
х=2
Co3O4 + 8H+ + 2 e = 3Co2+ + 4H2O полуреакция восстановления
Пример 2.
Fe3O4 + H+ Fe3+
Fe3O4 + 8H+ + х e = 3Fe3+ + 4H2O
баланс зарядов: 8 + х( -1) = 9
Fe3O4 + 8H+ -
e = 3Fe3+ + 4H2O
х = -1
полуреакция окисления
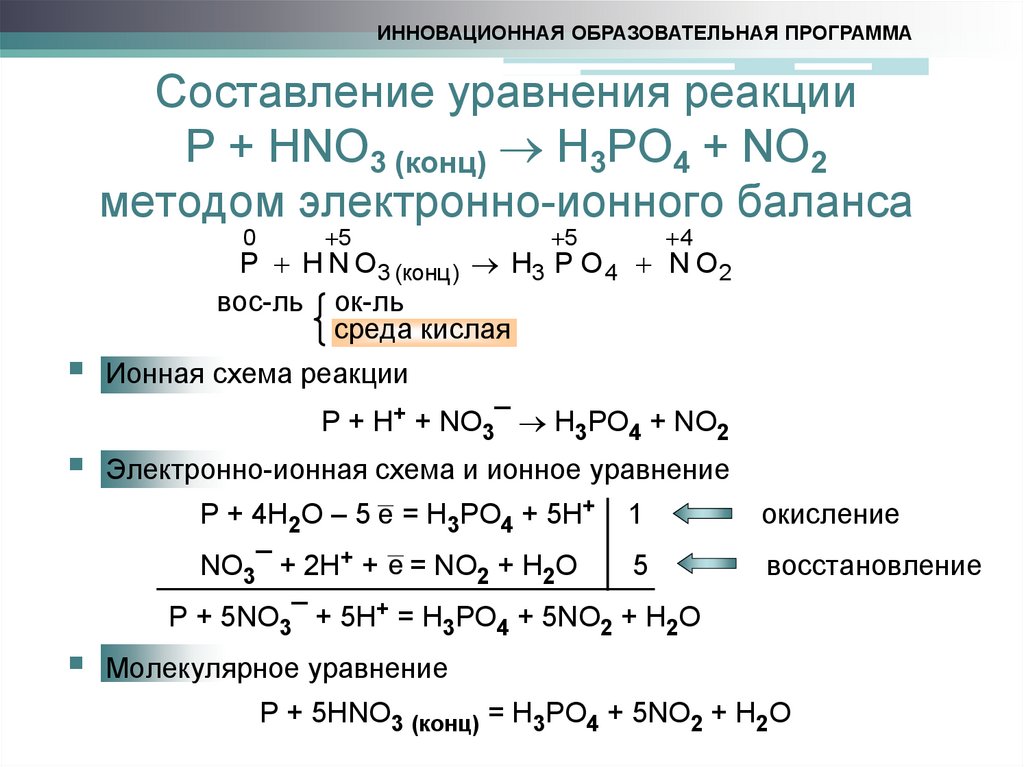
9. Составление уравнения реакции P + HNO3 (конц) H3PO4 + NO2 методом электронно-ионного баланса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнения реакции
P + HNO3 (конц) H3PO4 + NO2
методом электронно-ионного баланса
0
5
5
4
P H N O3 (конц ) H3 P O 4 N O 2
вос-ль ок-ль
среда кислая
Ионная схема реакции
P + H+ + NO3¯ H3PO4 + NO2
Электронно-ионная схема и ионное уравнение
P + 4H2O – 5 e = H3PO4 + 5H+
1
окисление
NO3¯ + 2H+ + e = NO2 + H2O
5
восстановление
P + 5NO3¯ + 5H+ = H3PO4 + 5NO2 + H2O
Молекулярное уравнение
P + 5HNO3 (конц) = H3PO4 + 5NO2 + H2O
10. Составление уравнений полуреакций с заданной щелочной средой
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнений полуреакций
с заданной щелочной средой
В электронно-ионные уравнения полуреакций с заданной щелочной
средой помимо окисленных и восстановленных форм включают
ионы ОH ¯ и молекулы H2O
[O2-] + H2О = 2ОH ¯
2ОН ¯ = [O2-] + H2О
Примеры электронно-ионных уравнений полуреакций
NO3¯ NO2¯
NO3¯ + H2O + 2 e = NO2¯ + 2ОН¯ - полуреакция восстановления
I2 IO3¯
I2 + 12ОН¯ – 10 e = 2IO3¯ + 6H2O - полуреакция окисления
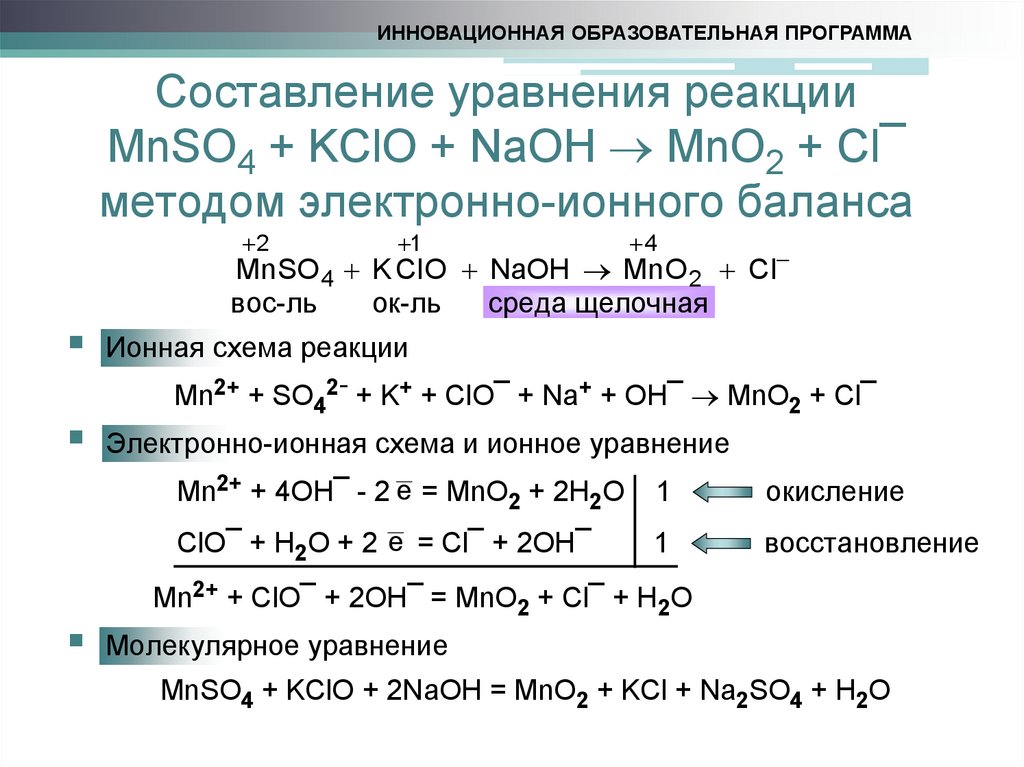
11. Составление уравнения реакции MnSO4 + KClO + NaOH MnO2 + Cl¯ методом электронно-ионного баланса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнения реакции
MnSO4 + KClO + NaOH MnO2 + Cl¯
методом электронно-ионного баланса
2
1
4
Mn SO 4 K Cl O NaOH Mn O 2 Cl
вос-ль
ок-ль
среда щелочная
Ионная схема реакции
Mn2+ + SO42- + K+ + ClO¯ + Na+ + OH¯ MnO2 + Cl¯
Электронно-ионная схема и ионное уравнение
Mn2+ + 4ОН¯ - 2 e = MnO2 + 2H2O
1
окисление
ClO¯ + H2O + 2 e = Cl¯ + 2OH¯
1
восстановление
Mn2+ + ClO¯ + 2ОН¯ = MnO2 + Cl¯ + H2O
Молекулярное уравнение
MnSO4 + KClO + 2NaOH = MnO2 + KCl + Na2SO4 + H2O
12. Составление уравнений полуреакций с заданной нейтральной средой
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнений полуреакций
с заданной нейтральной средой
В нейтральной среде концентрация ионов H+ и ОН¯ мала, в левой
части уравнений полуреакций, кроме окислителя и восстановителя,
могут быть записаны только молекулы H2O
[O2-] + H2О = 2ОH ¯
H2O = [O2-] + 2H+
Примеры электронно-ионных уравнений полуреакций
MnO42 MnO2
MnO42 + 2H2O + 2 e = MnO2 + 4ОН¯ - полуреакция восстановления
Mn2+ MnO2
Mn2+ + 2H2O – 2 e = MnO2 + 4H+
- полуреакция окисления
13. Составление уравнения реакции KMnO4 + Na2SO3 + H2O MnO2 + SO42‑ методом электронно-ионного баланса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнения реакции
KMnO4 + Na2SO3 + H2O MnO2 + SO42методом электронно-ионного баланса
7
4
ок-ль
вос-ль
4
6
K Mn O 4 Na 2 S O3 H2O Mn O 2 S O 24
Ионная схема реакции
среда нейтральная
K+ + MnO4 + 2Na+ + SO32- + H2O MnO2 + SO42 Электронно-ионная схема
MnO4 + 2H2O + 3 e = MnO2 + 4ОН¯ 2
восстановление
SO32- + H2O – 2 e = SO42- + 2H+
3
окисление
2MnO4 + 3SO32- + 7H2O = 2MnO2 + 3SO42- + 8OH¯ + 6H+
объединяют ионы H+ и ОН- в молекулы воды
6H2O + 2OH¯
Ионное и молекулярное уравнения
2MnO4 + 3SO32- + H2O = 2MnO2 + 3SO42- + 2OH¯
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
14. Составление уравнения реакции K2(S5) + O3 + H2O S + O2 методом электронно-ионного баланса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнения реакции
K2(S5) + O3 + H2O S + O2
методом электронно-ионного баланса
K2(S5) + O3 + H2O S + O2
вос-ль ок-ль среда нейтральная
Ионная схема реакции
2K+ + (S5)2- + O3 + H2O S + O2
Электронно-ионная схема и ионное уравнение
(S5)2- - 2 e = 5S
1
O3 + H2O + 2 e = O2 +2OH
1
уравнение баланса зарядов: х( 1) = 2;
окисление
восстановление
х= 2
(S5)2- + O3 + H2O = 5S + O2 +2ОН
Молекулярное уравнение
K2(S5) + O3 + H2O = 5S + O2 + 2KOH
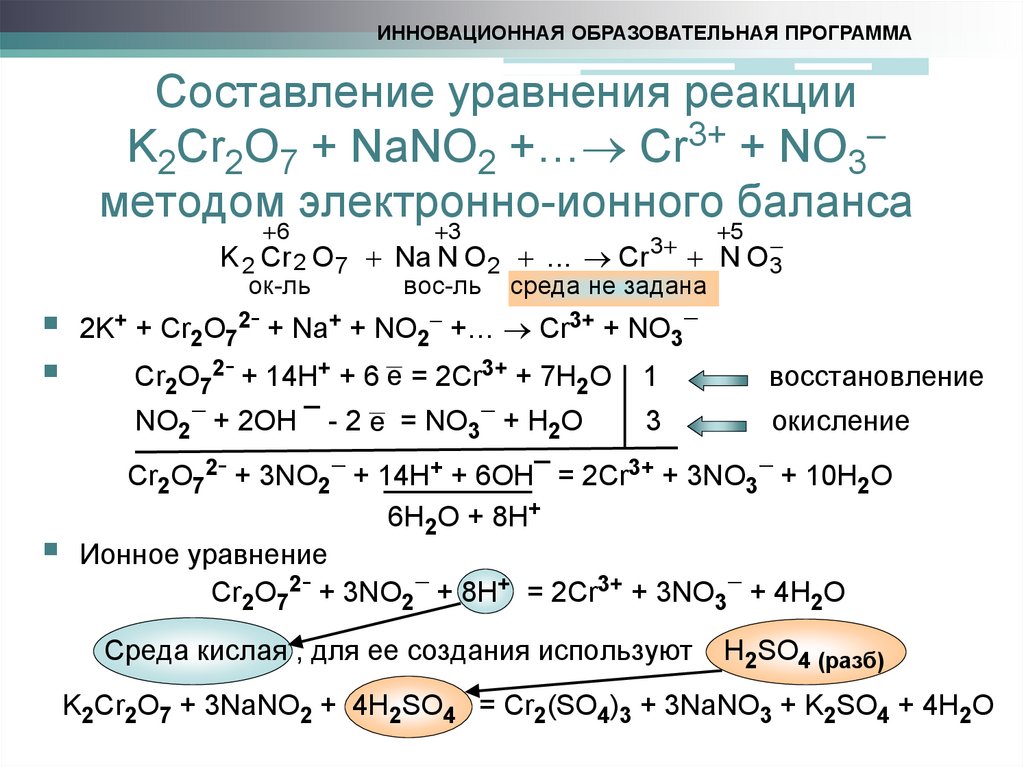
15. Составление уравнения реакции K2Cr2O7 + NaNO2 +… Cr3+ + NO3 методом электронно-ионного баланса
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСоставление уравнения реакции
K2Cr2O7 + NaNO2 +… Cr3+ + NO3
методом 6 электронно-ионного
баланса
3
5
K 2 Cr 2 O7 Na N O 2 ... Cr 3 N O3
ок-ль
вос-ль среда не задана
2K+ + Cr O 2- + Na+ + NO +… Cr3+ + NO
2 7
2
Cr2O72- + 14H+ + 6 e = 2Cr3+ + 7H2O
NO2 + 2OH ¯ - 2 e = NO3 + H2O
3
1
восстановление
3
окисление
Cr2O72- + 3NO2 + 14H+ + 6OH¯ = 2Cr3+ + 3NO3 + 10H2O
6H2O + 8H+
Ионное уравнение
Cr2O72- + 3NO2 + 8H+ = 2Cr3+ + 3NO3 + 4H2O
Среда кислая , для ее создания используют
H2SO4 (разб)
K2Cr2O7 + 3NaNO2 + 4H2SO4 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4H2O
16. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Основными способами составления уравнений окислительно-
восстановительных реакций являются методы электронного и
электронно-ионного баланса
Все способы составления уравнений окислительно-
восстановительных реакций основаны на равенстве числа
электронов, отданных восстановителем, и принятых
окислителем (электронном балансе)
Метод электронно-ионного баланса (или электронно-ионных
полуреакций) используют при составлении уравнений реакций,
протекающих в растворе
В электронно-ионные уравнения полуреакций помимо
окислителя и восстановителя, в зависимости от среды,
включают ионы H+, OH¯ и молекулы H2O
17. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Лидин Р.А. Задачи по общей и неорганической химии. - М.:
ВЛАДОС, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках,
таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш. шк.,
1994
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.:
Академия, 2004











 Химия
Химия








