Похожие презентации:
Положение азота и фосфора в ПСХЭ, строение их атомов. Азот свойства и применение
1.
Положение азота и фосфора впериодической системе
химических элементов,
строение их атомов. Азот
свойства и применение.
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
2.
VА-группаПодгруппа
азота
(«пниктогены»
–
неприятно пахнущие) – VА-группа - азот,
фосфор,
мышьяк,
сурьма,
висмут.
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
3.
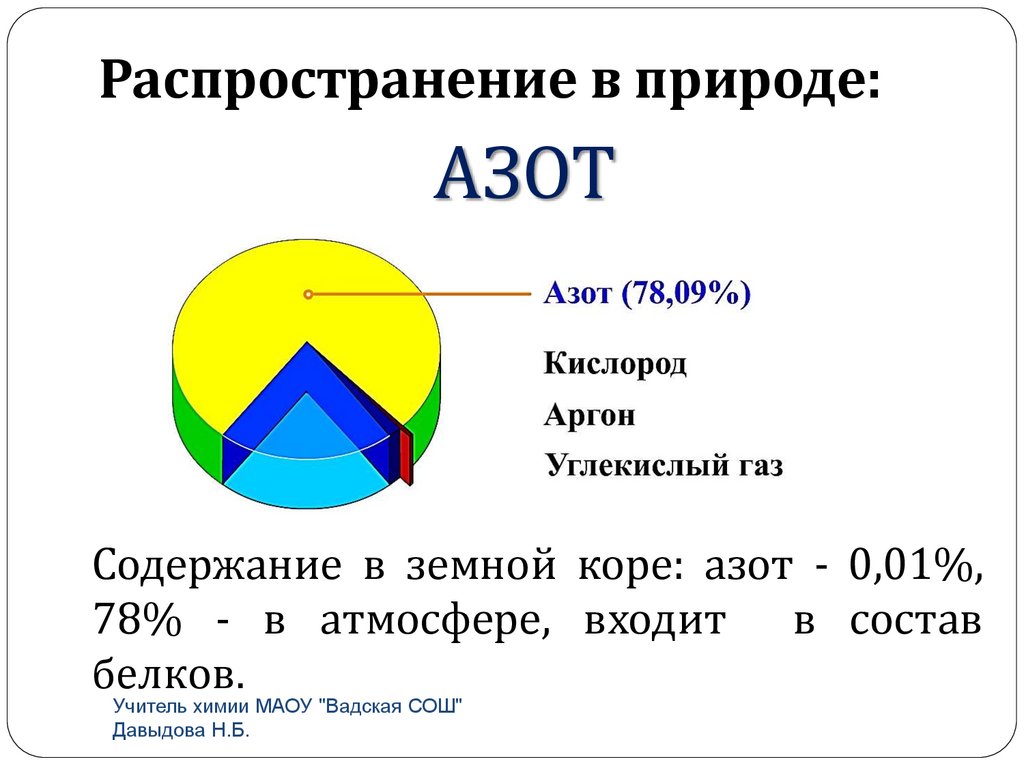
Распространение в природе:АЗОТ
Содержание в земной коре: азот - 0,01%,
78% - в атмосфере, входит в состав
белков.
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
4.
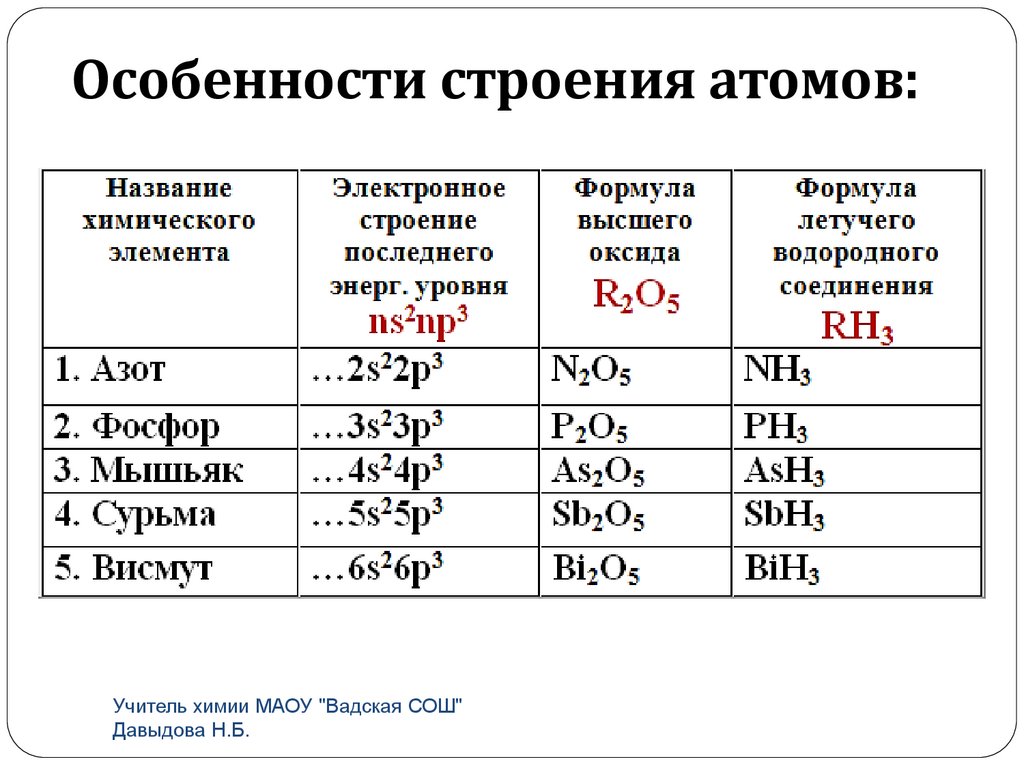
Особенности строения атомов:Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
5.
Высшая с.о. +5, низшая с.о. -3.На внешнем уровне 5е, ns2np3
Высший оксид R2O5
Высший гидроксид HRO3
H3RO4
Летучее водородное соединение RН3
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
6.
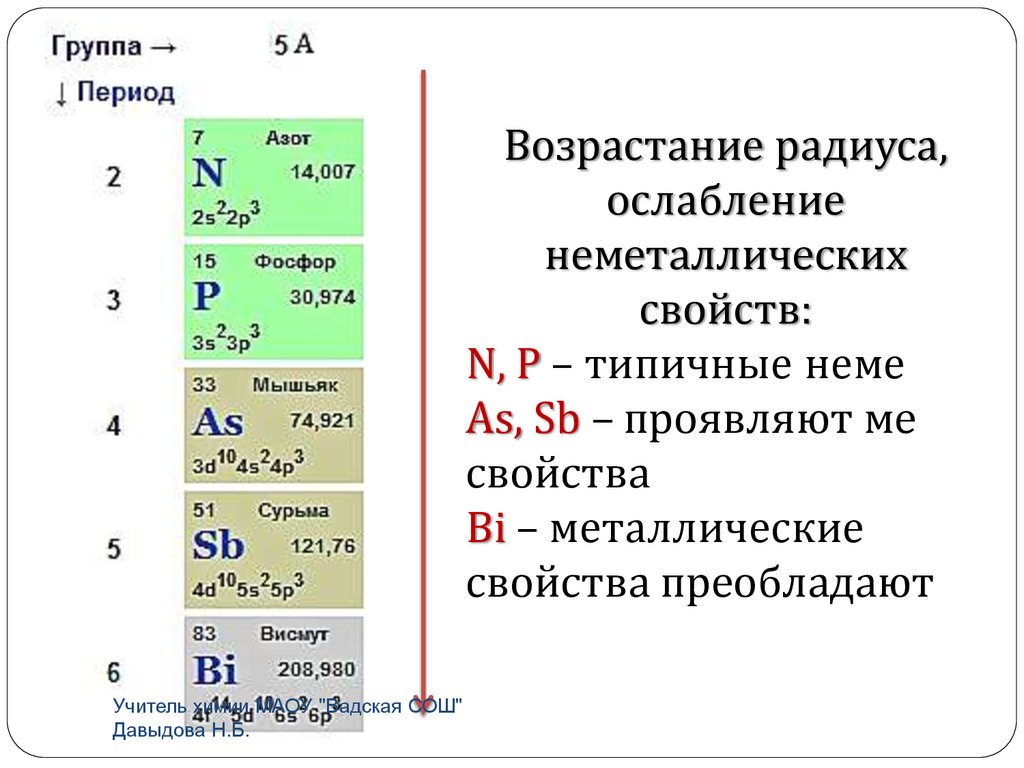
Возрастание радиуса,ослабление
неметаллических
свойств:
N, P – типичные неме
As, Sb – проявляют ме
свойства
Bi – металлические
свойства преобладают
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
7.
Азот – «безжизненный»,«рождающий селитру»
Резерфорд –
«удушливый
воздух»
Лавуазье «азот» безжизненный
воздух
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
8.
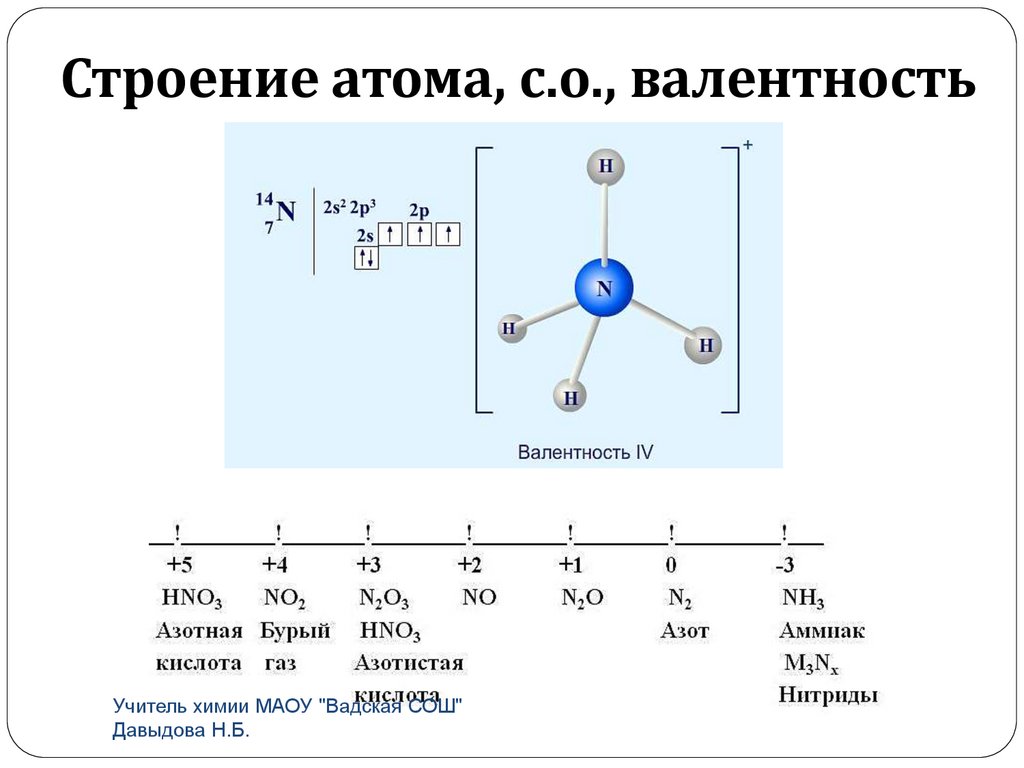
Строение атома, с.о., валентностьУчитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
9.
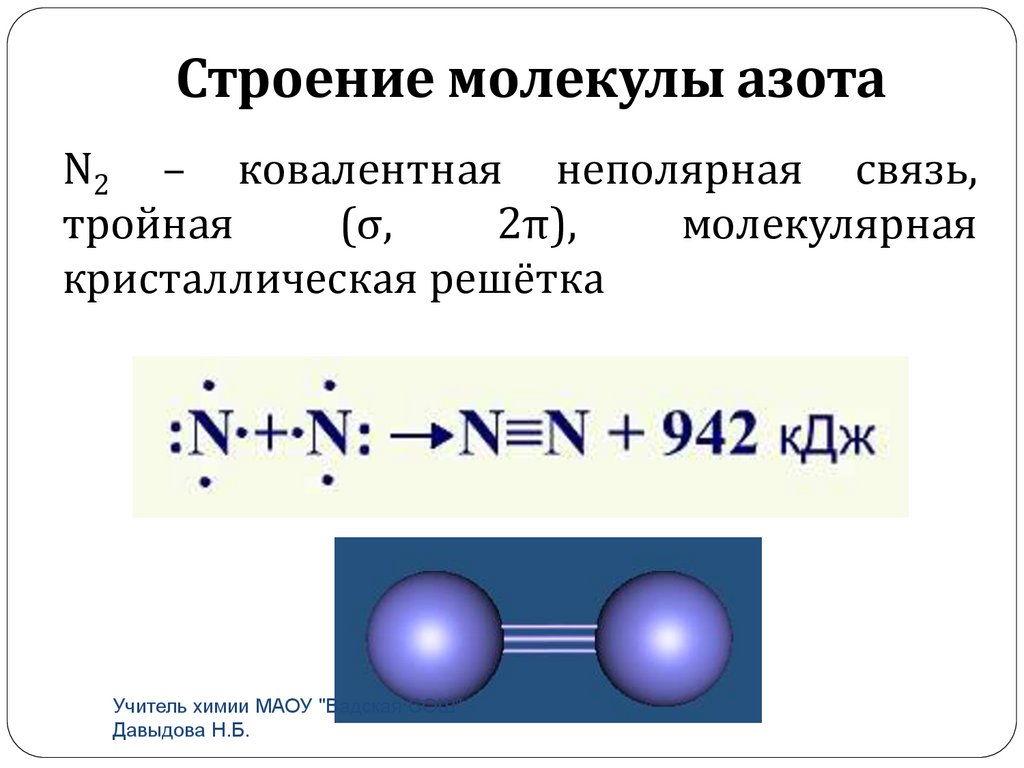
Строение молекулы азотаN2 – ковалентная неполярная связь,
тройная
(σ,
2π),
молекулярная
кристаллическая решётка
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
10.
Физические свойства азотаБесцветный
газ,
без
запаха,
малорастворимый в воде, немного легче
воздуха, химически инертен, при -1960С
сжижается.
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
11.
Химические свойства азота:1. Окислительные свойства (с.о. -3):
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
12.
Химические свойства азота:2. Восстановительные свойства (с.о. +2):
30000С
N2 + O2 ⇄ 2NO – Q
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
13.
Получение азота1. В лаборатории.
Разложение нитрита аммония:
NH4NO2 → N2 + 2H2O
Разложение дихромата аммония:
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
2. В промышленности:
Перегонка жидкого воздуха.
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
14.
Применение азота:для получения аммиака
для обеспечения инертной среды
жидкий азот широко используют
как хладагент
азотные минеральные удобрения.
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.
15.
Домашнее задание:§22 упр.3
Учитель химии МАОУ "Вадская СОШ"
Давыдова Н.Б.










 Химия
Химия








