Похожие презентации:
Биологические молекулы
1. Биологические молекулы
Тема 1Биологические
молекулы
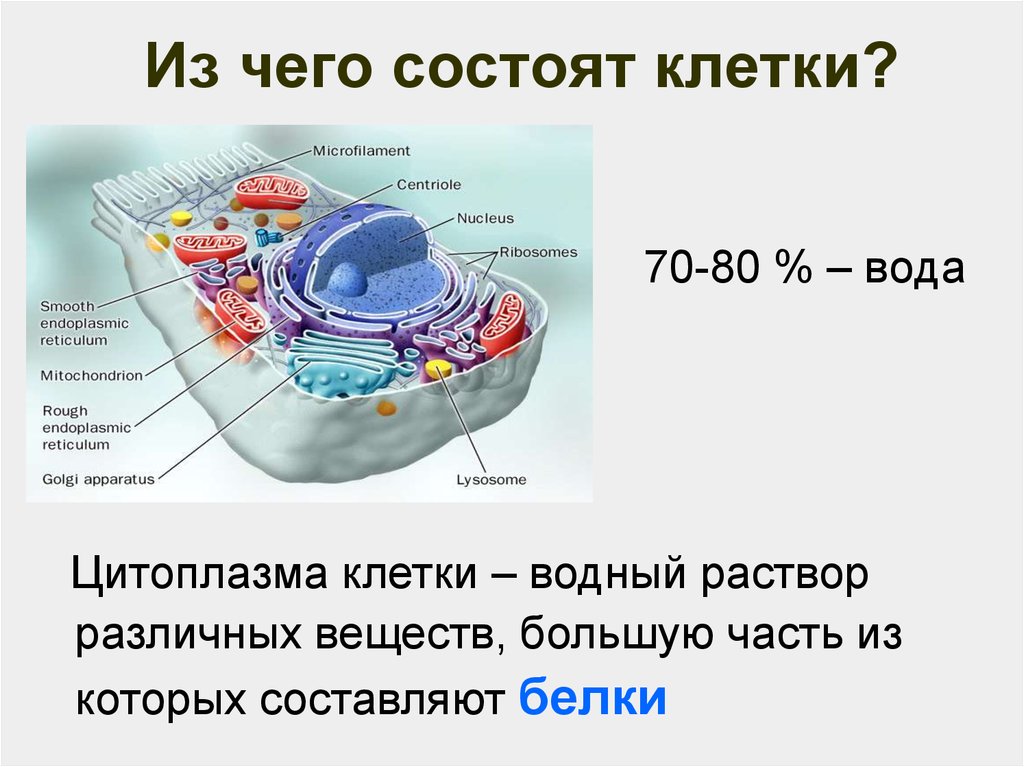
2. Из чего состоят клетки?
70-80 % – водаЦитоплазма клетки – водный раствор
различных веществ, большую часть из
которых составляют белки
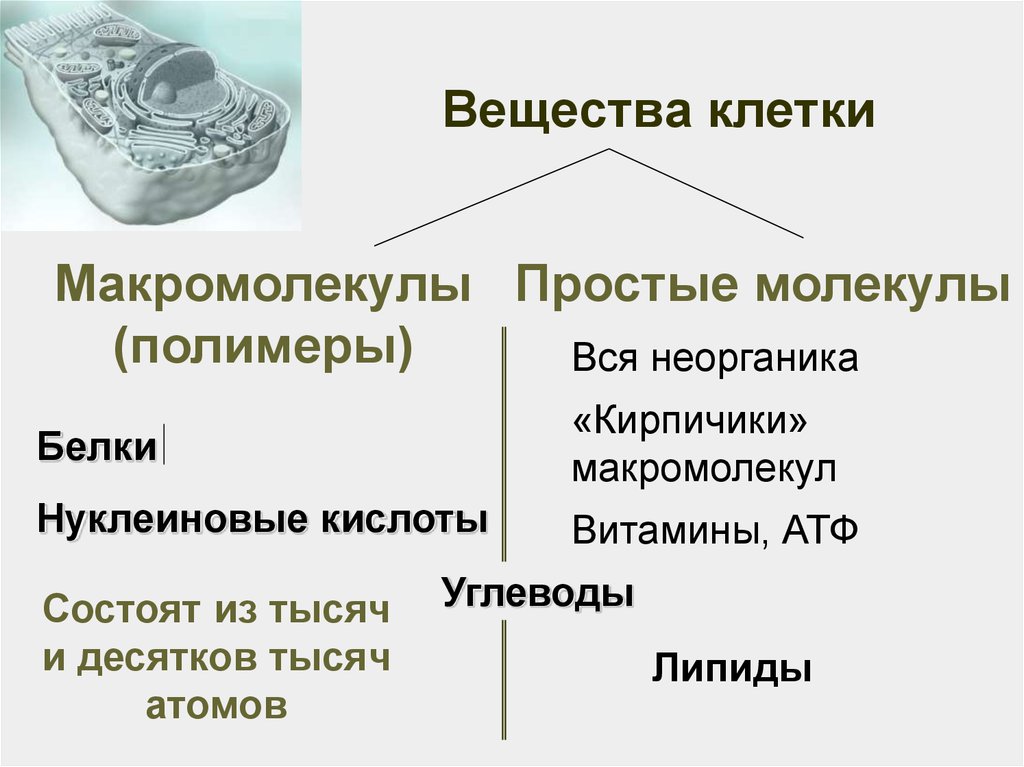
3. Вещества клетки
Органические1. Белки
2. Нуклеиновые кислоты
(ДНК и РНК)
3. Углеводы
4. Липиды
5. Витамины, АТФ
Неорганические
Вода,
ионы,
О2,
СО2
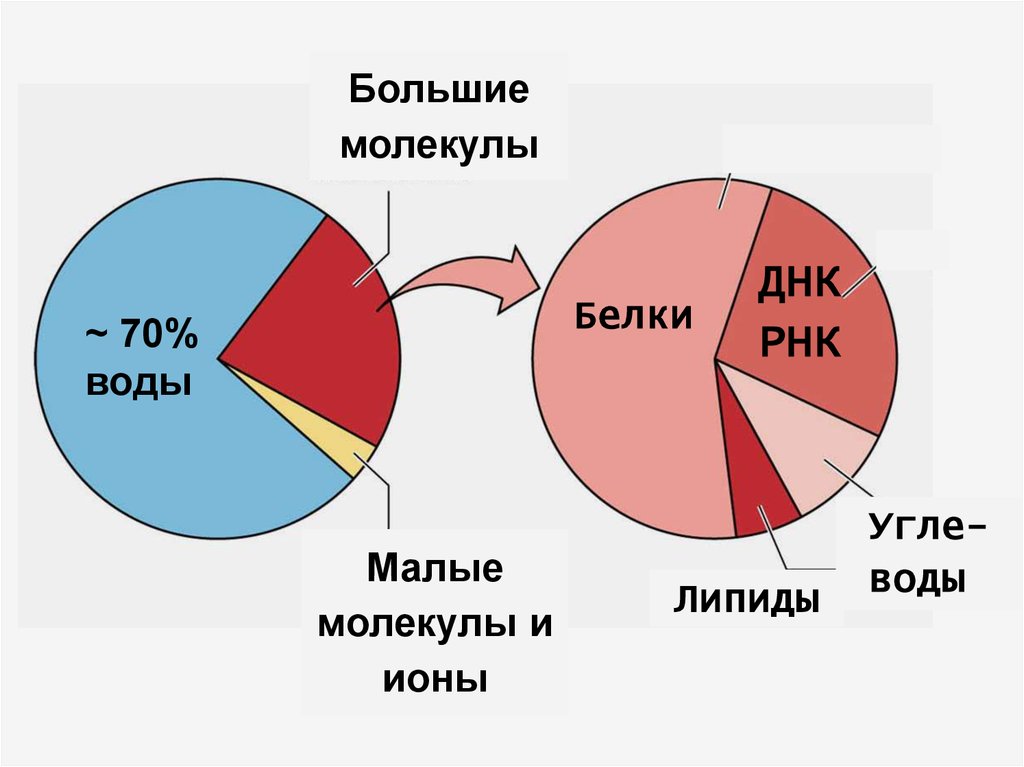
4.
Большиемолекулы
Белки
~ 70%
воды
Малые
молекулы и
ионы
ДНК
РНК
Липиды
Углеводы
5. Вещества клетки
Макромолекулы Простые молекулы(полимеры)
Вся неорганика
Белки
«Кирпичики»
макромолекул
Нуклеиновые кислоты
Витамины, АТФ
Состоят из тысяч
и десятков тысяч
атомов
Углеводы
Липиды
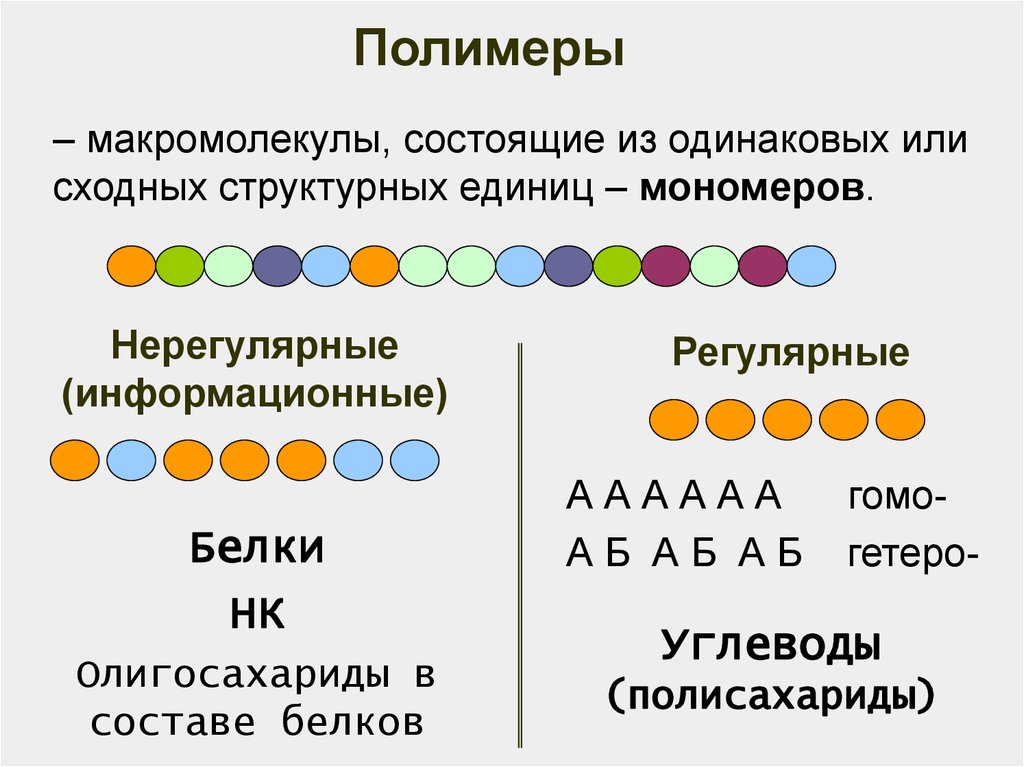
6.
Полимеры– макромолекулы, состоящие из одинаковых или
сходных структурных единиц – мономеров.
Нерегулярные
(информационные)
Белки
НК
Олигосахариды в
составе белков
Регулярные
АААААА
АБ АБ АБ
гомогетеро-
Углеводы
(полисахариды)
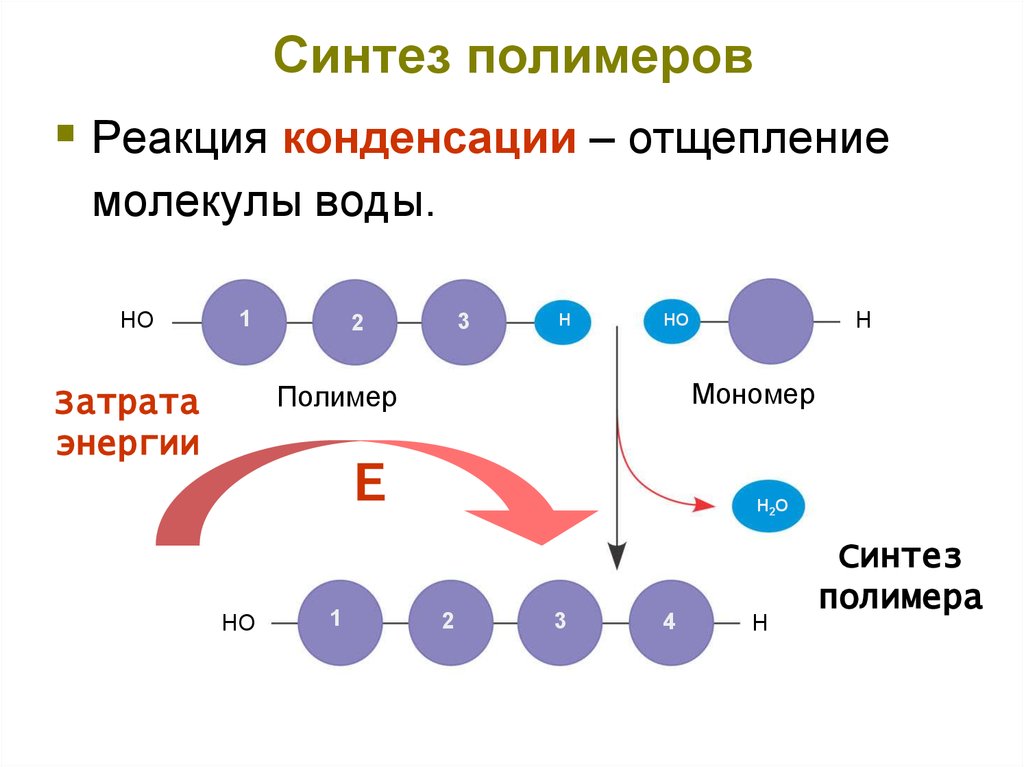
7. Синтез полимеров
Реакция конденсации – отщеплениемолекулы воды.
HO
1
3
2
H
Мономер
Полимер
Затрата
энергии
Е
HO
1
H
HO
H2O
2
3
4
H
Синтез
полимера
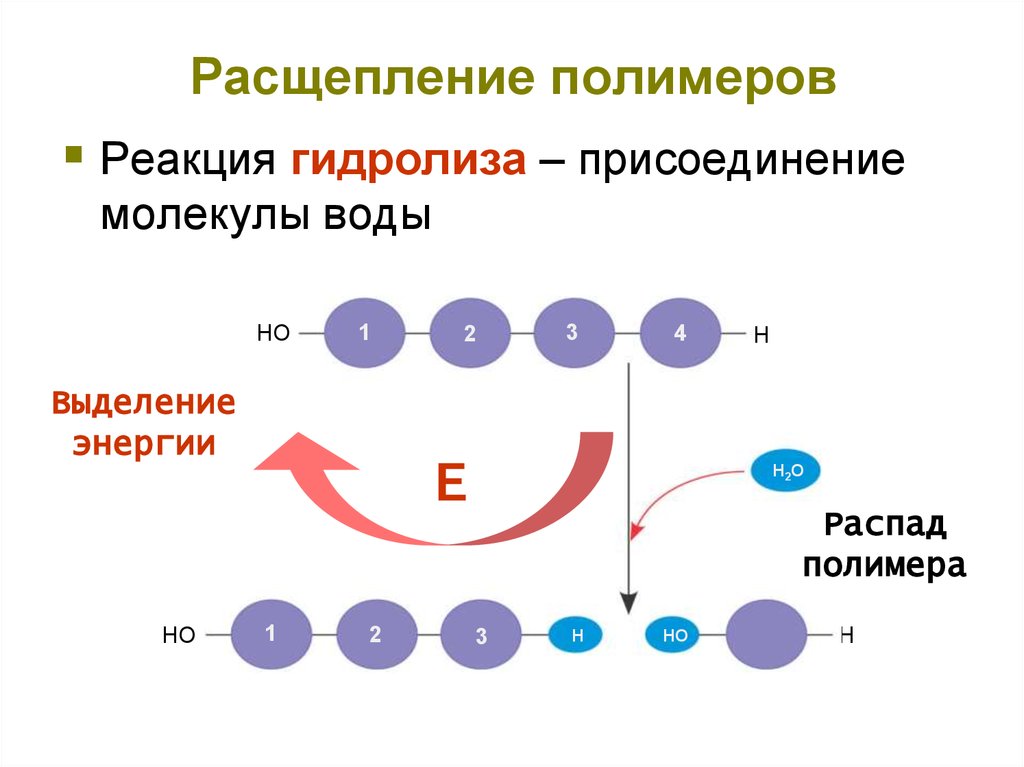
8. Расщепление полимеров
Реакция гидролиза – присоединениемолекулы воды
HO
1
Выделение
энергии
HO
2
3
4
Е
1
2
H
H2O
Распад
полимера
3
H
HO
H
9. Свойства воды
10.
Процент воды в тканяхМозг……………….... 70- 85
Мышцы…………….. 75
Кожа……………….... 70
Соединительная…. 60
Кости………………... 25
Жировая……………. 20
11. Уникальные свойства воды
Молекулы полярны – являются диполями– 0,66 е
+ 0,33 е
+ 0,33 е
–
Диполь
+
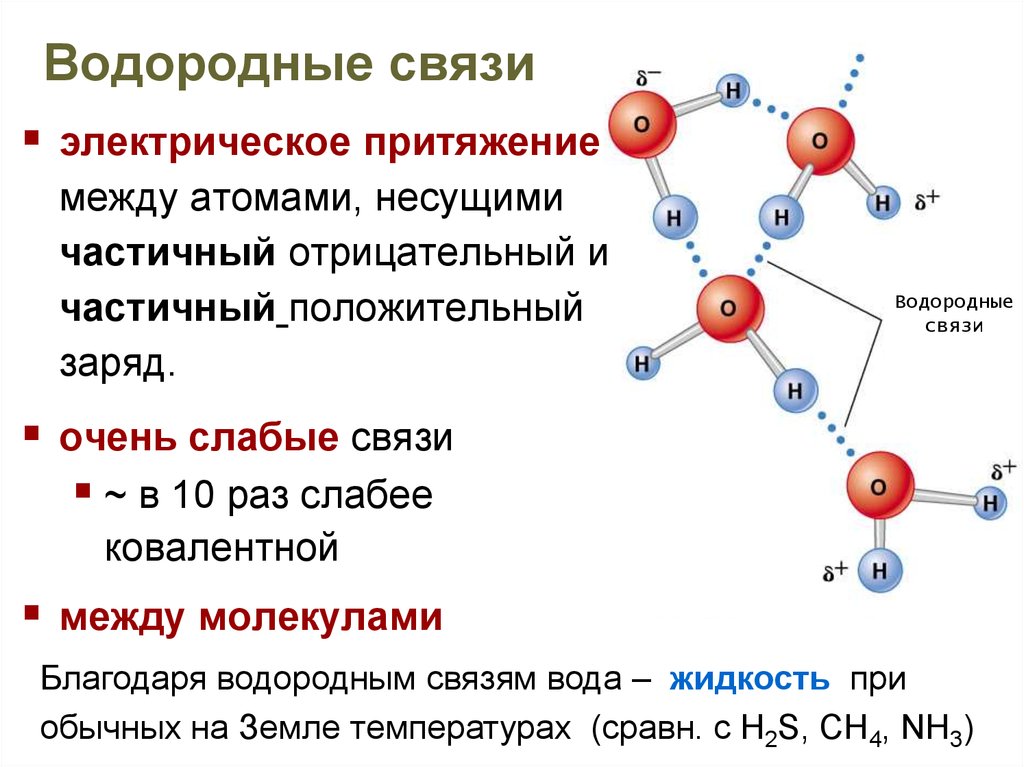
12. Водородные связи
электрическое притяжениемежду атомами, несущими
частичный отрицательный и
частичный положительный
заряд.
Водородные
связи
очень слабые связи
~ в 10 раз слабее
ковалентной
между молекулами
Благодаря водородным связям вода – жидкость при
обычных на Земле температурах (сравн. с H2S, CH4, NH3)
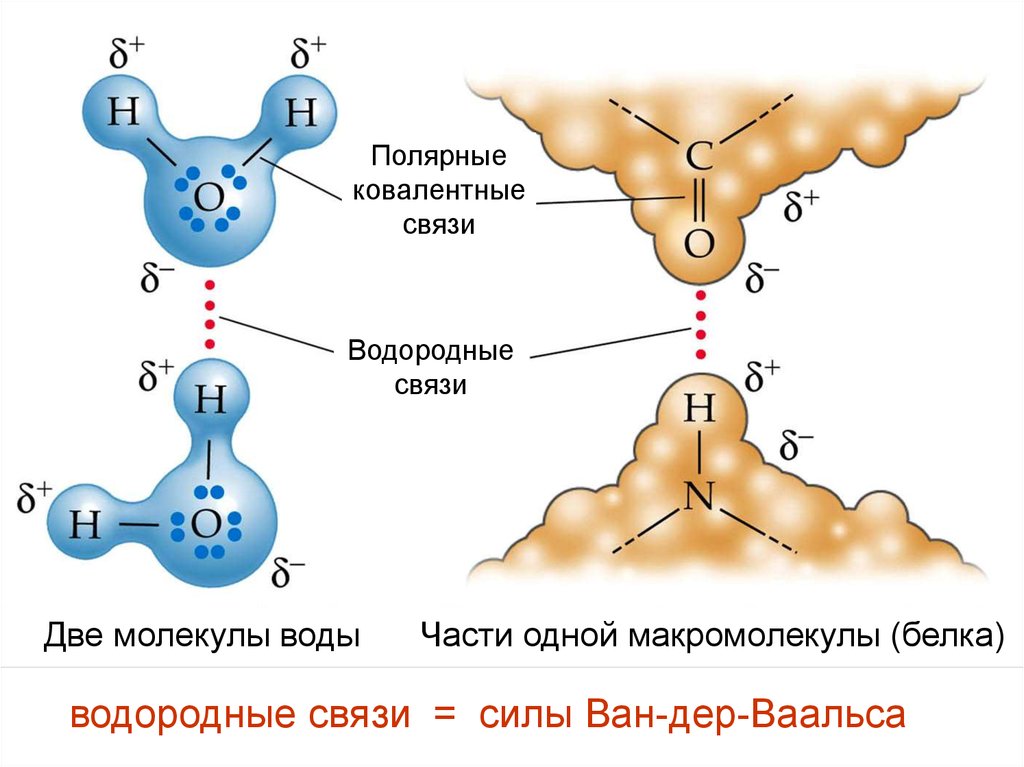
13.
Полярныековалентные
связи
Водородные
связи
Две молекулы воды
Части одной макромолекулы (белка)
водородные связи = силы Ван-дер-Ваальса
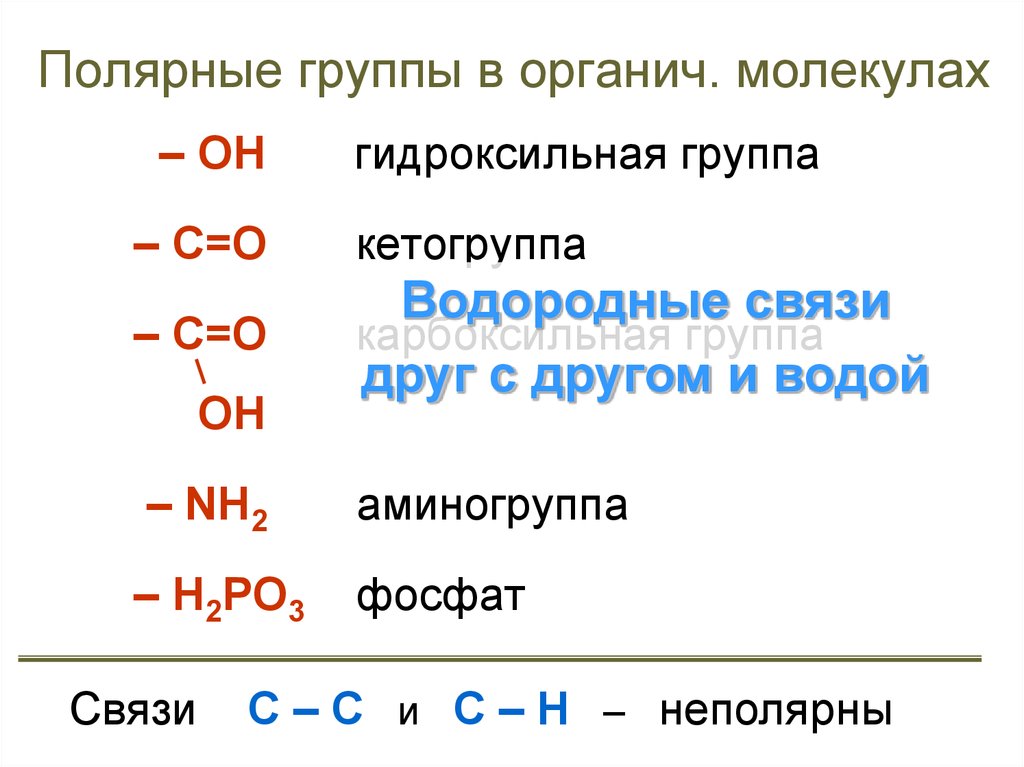
14. Полярные группы в органич. молекулах
– ОНгидроксильная группа
– С=О
кетогруппа
– С=О
Водородные связи
карбоксильная группа
друг с другом и водой
ОН
– NH2
аминогруппа
– Н2РО3
фосфат
Связи
С – С и С – Н – неполярны
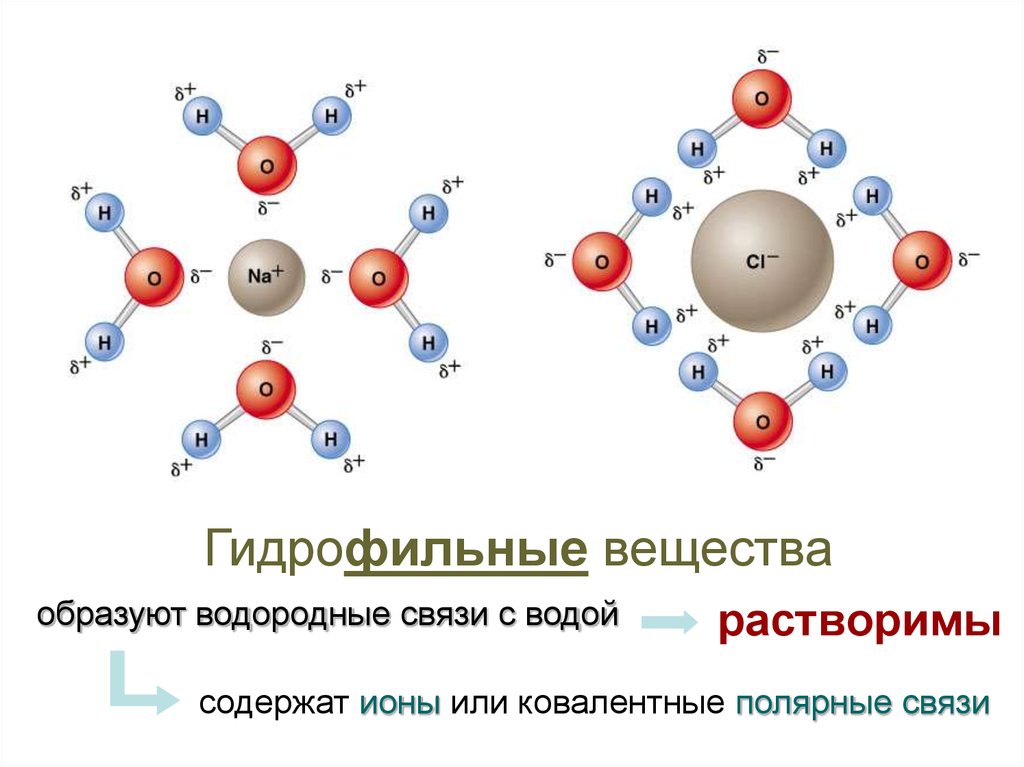
15.
Гидрофильные веществаобразуют водородные связи с водой
растворимы
содержат ионы или ковалентные полярные связи
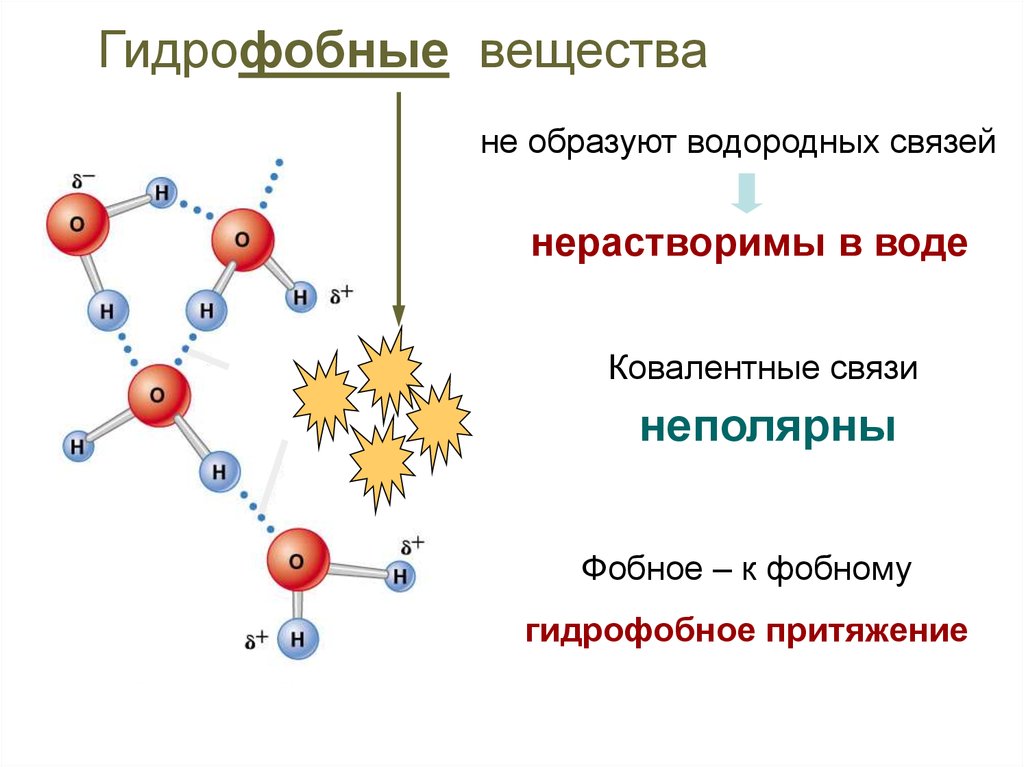
16.
Гидрофобные веществане образуют водородных связей
нерастворимы в воде
Ковалентные связи
неполярны
Фобное – к фобному
гидрофобное притяжение
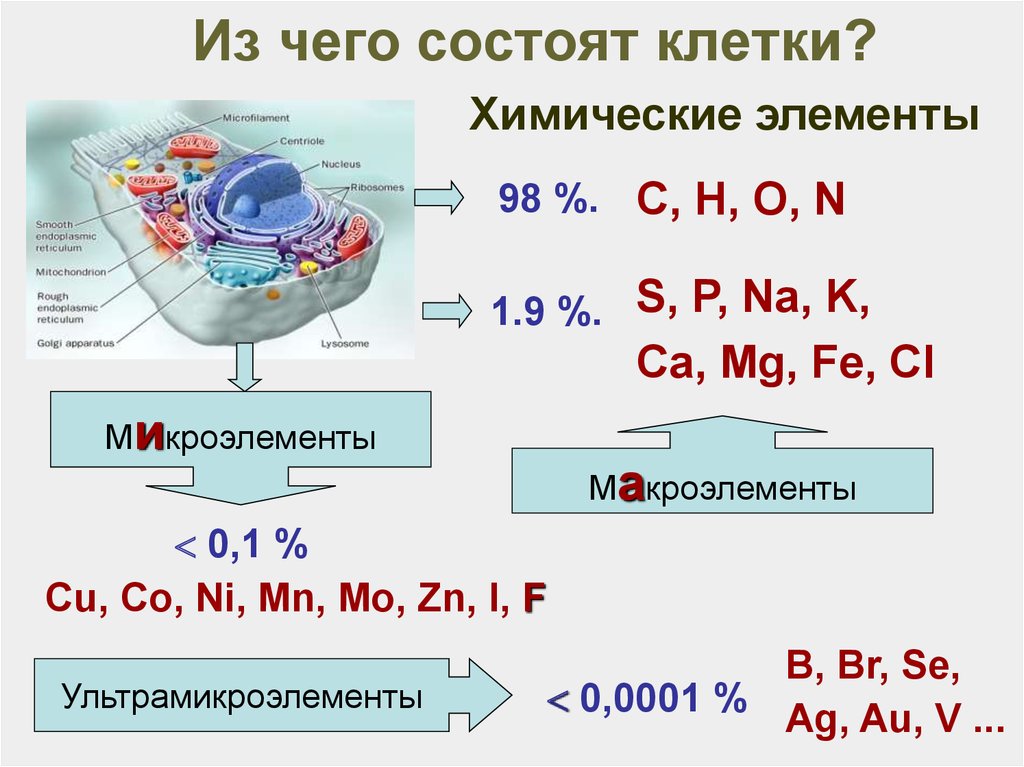
17. Из чего состоят клетки?
Химические элементы98 %. С, Н, O, N
1.9 %. S, P, Na, K,
Ca, Mg, Fe, Cl
Микроэлементы
Макроэлементы
0,1 %
Сu, Co, Ni, Mn, Mo, Zn, I, F
Ультрамикроэлементы
В, Br, Se,
0,0001 %
Ag, Au, V ...
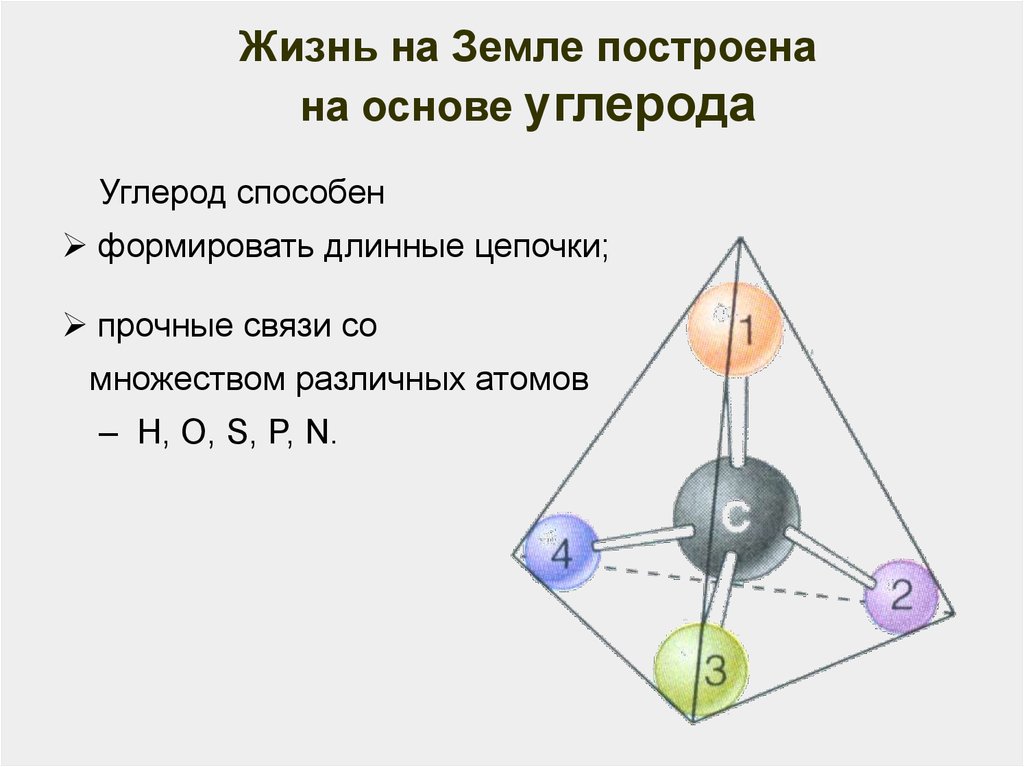
18.
Жизнь на Земле построенана основе углерода
Углерод способен
формировать длинные цепочки;
прочные связи со
множеством различных атомов
– Н, О, S, P, N.
19. Б Е Л К И
Тема 1.Биологические молекулы
БЕЛКИ
Часть 1. Строение.
20.
БЕЛКИ = ПРОТЕИНЫ(от греч. protos – первый, главный)
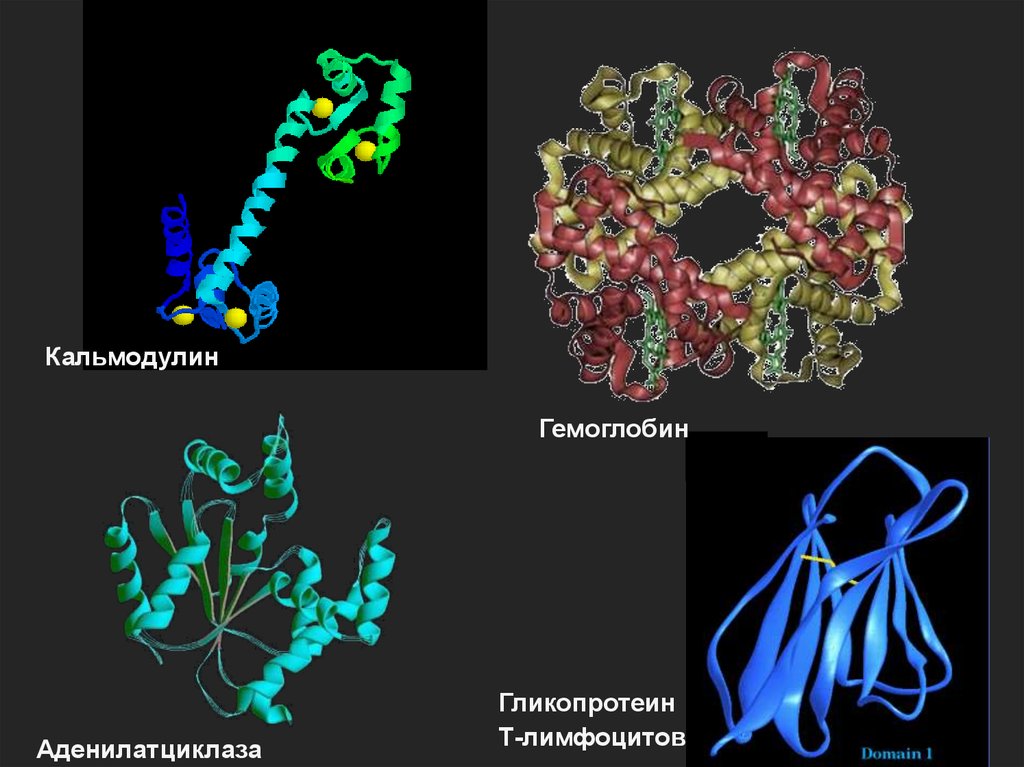
21.
КальмодулинГемоглобин
Аденилатциклаза
Гликопротеин
Т-лимфоцитов
22.
Белки – нерегулярные полимеры,мономерами которых являются аминокислоты
неразветвленные
Мономеры –
20 аминокислот
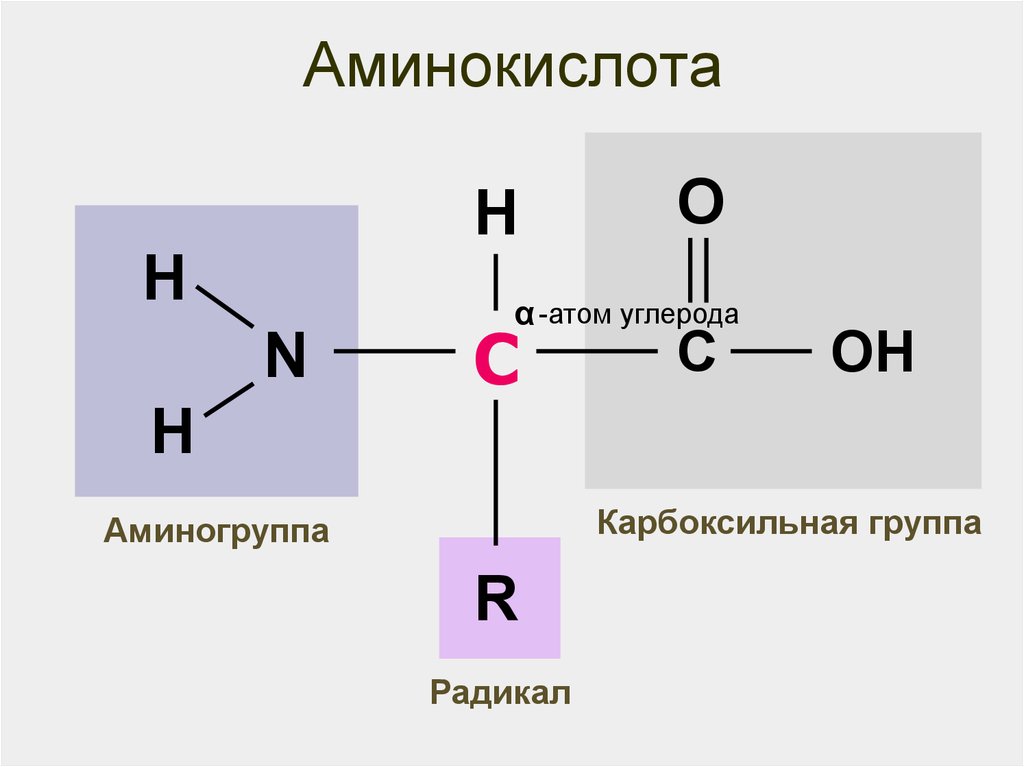
23. Аминокислота
HH
N
O
α -атом углерода
С
С
OH
H
Карбоксильная группа
Аминогруппа
R
Радикал
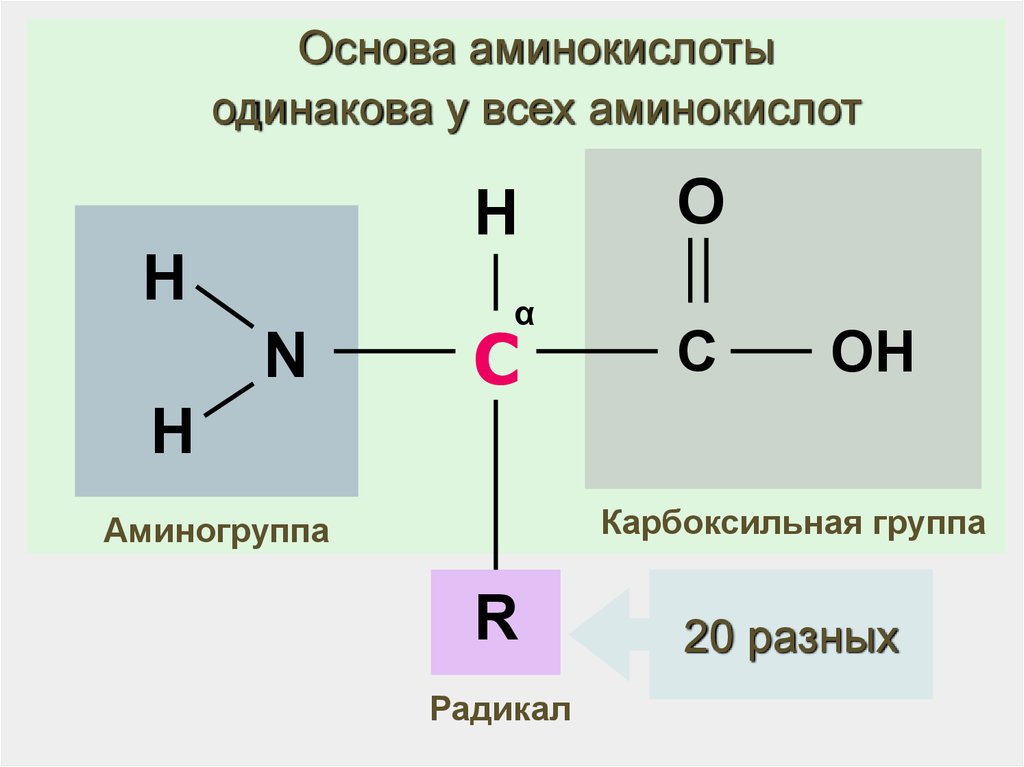
24.
Основа аминокислотыодинакова у всех аминокислот
H
H
N
α
С
O
С
OH
H
Карбоксильная группа
Аминогруппа
R
Радикал
20 разных
25.
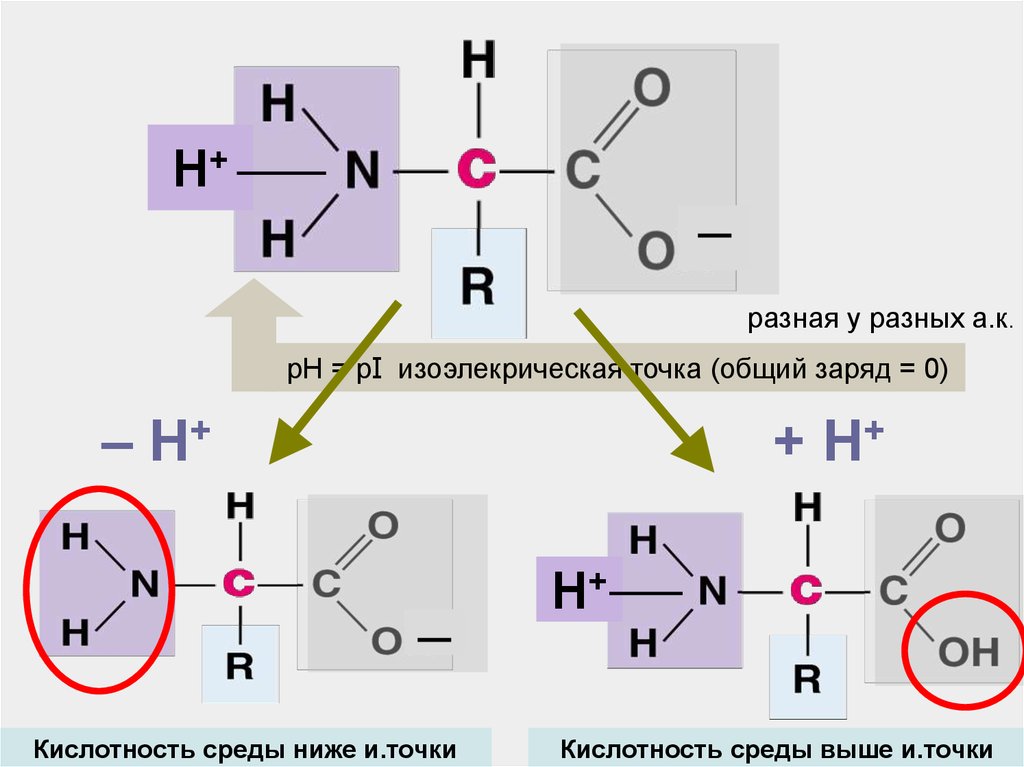
Н+─
разная у разных а.к.
pH = рI изоэлекрическая точка (общий заряд = 0)
– H+
+ H+
─
Кислотность среды ниже и.точки
Н+
Кислотность среды выше и.точки
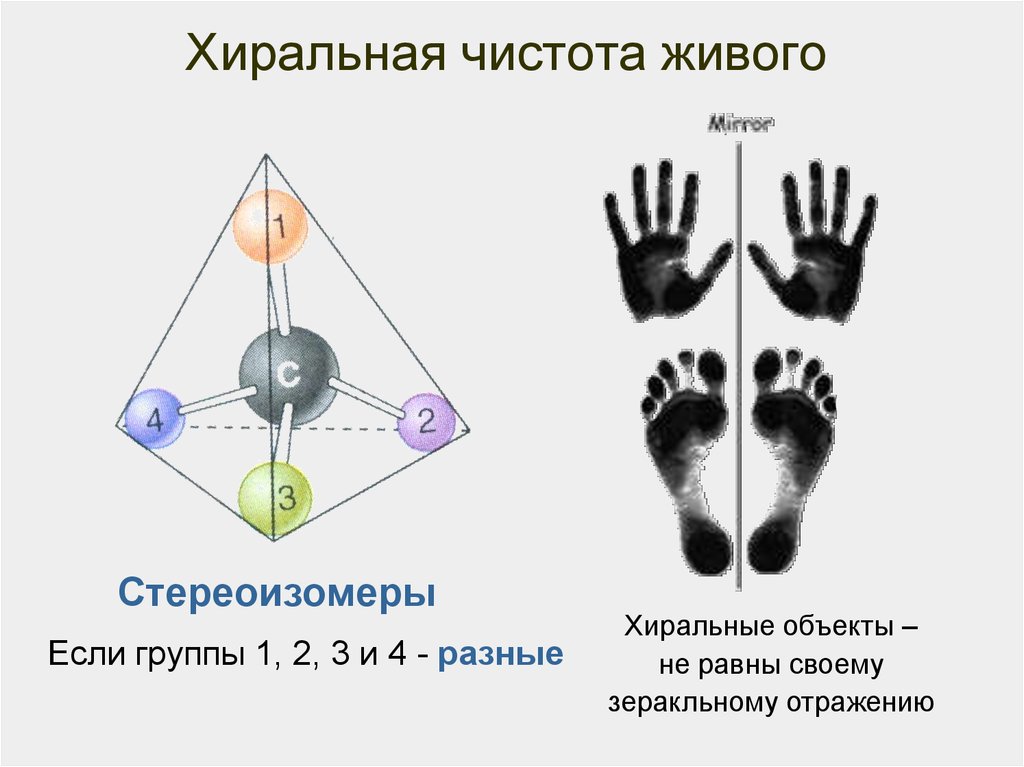
26. Хиральная чистота живого
СтереоизомерыЕсли группы 1, 2, 3 и 4 - разные
Хиральные объекты –
не равны своему
зеракльному отражению
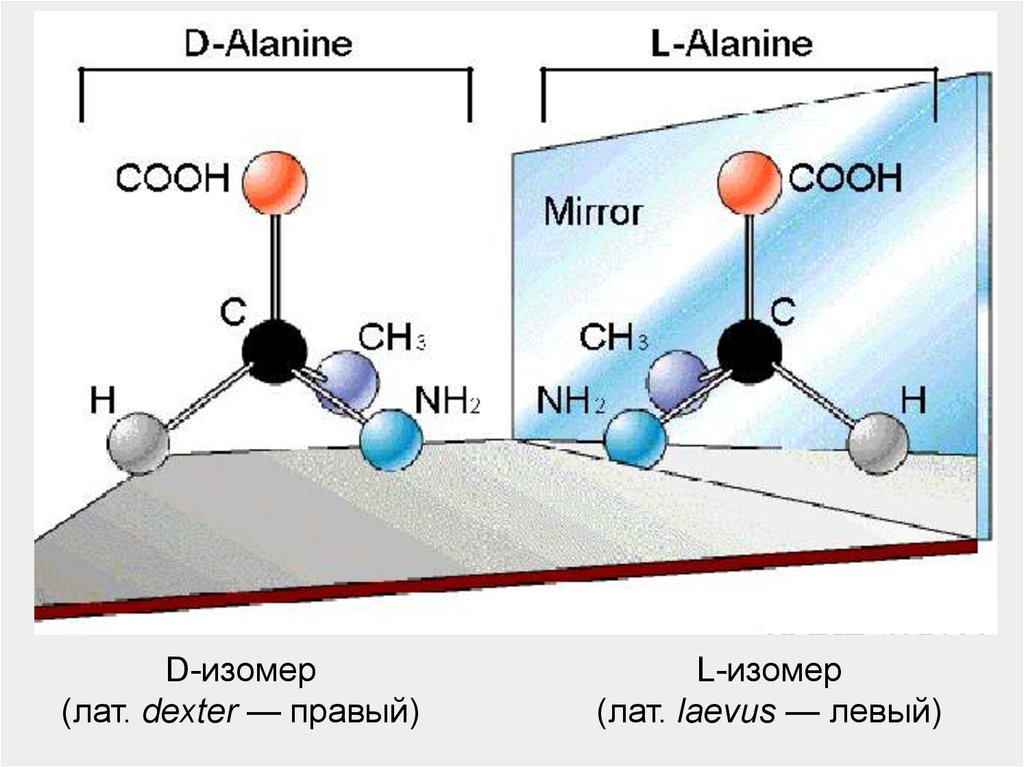
27.
D-изомер(лат. dexter — правый)
L-изомер
(лат. laevus — левый)
28. Незаменимые аминокислоты
Организм не может синтезировать сам→ должны поступать с пищей.
Для человека это:
валин, лейцин, изолейцин, треонин,
метионин, фенилаланин, триптофан,
гистидин, лизин, аргинин.
Этот список приблизительно одинаков у
всех позвоночных, и даже у насекомых.
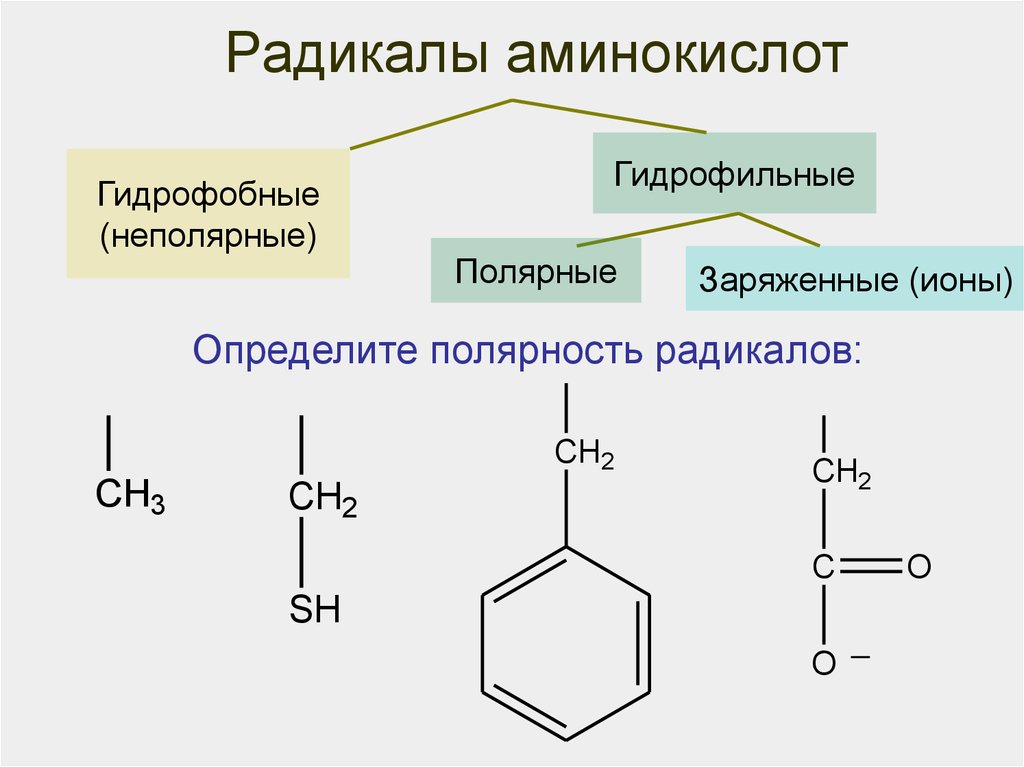
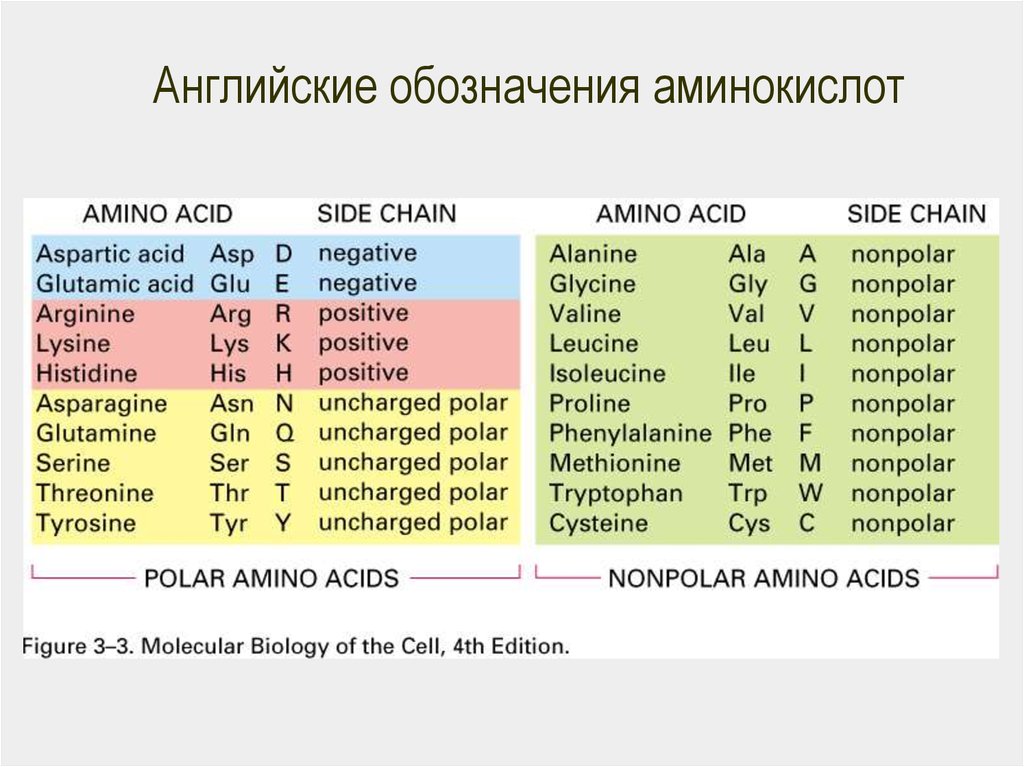
29. Радикалы аминокислот
NРадикалы аминокислот
Гидрофобные
(неполярные)
O
Гидрофильные
O
O Полярные O HЗаряженные
CH
C
(ионы)O
2N
Определите Hполярность
радикалов:
CH
C
OH
2N
CH2
CH
H2N C CHOH C
OH
CH2
CH3
CH2
CH2
C
SH
OH─
O
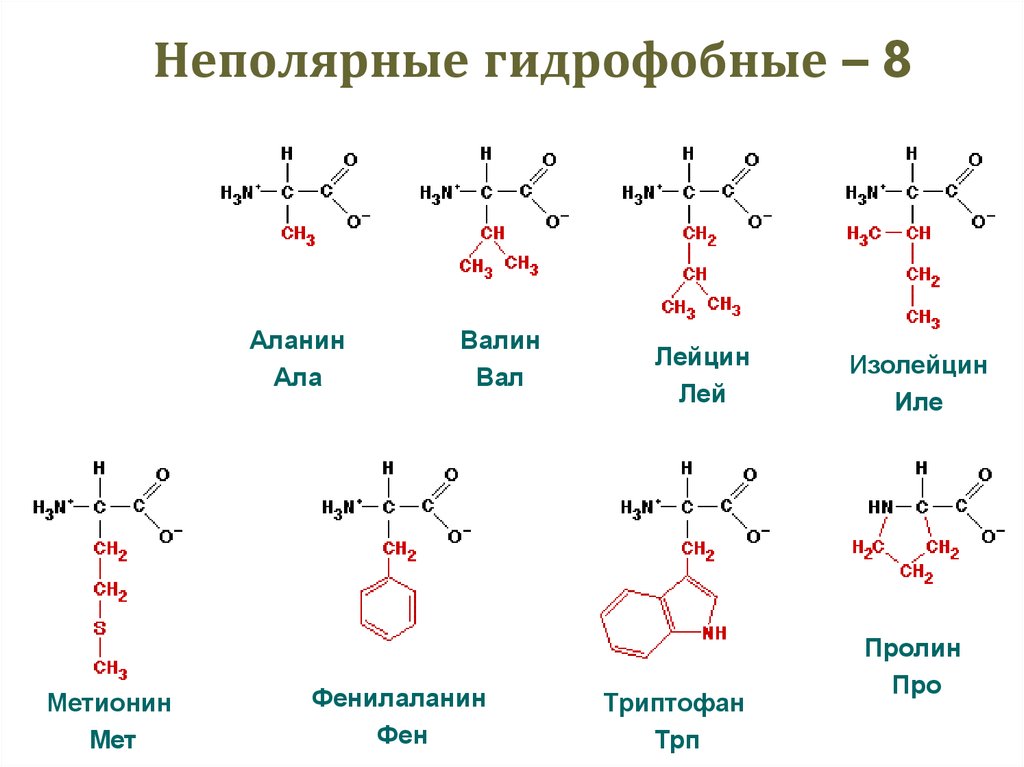
30. Неполярные гидрофобные – 8
ГлицинГли
Метионин
Мет
Аланин
Ала
Валин
Вал
Фенилаланин
Фен
Лейцин
Лей
Триптофан
Трп
Изолейцин
Иле
Пролин
Про
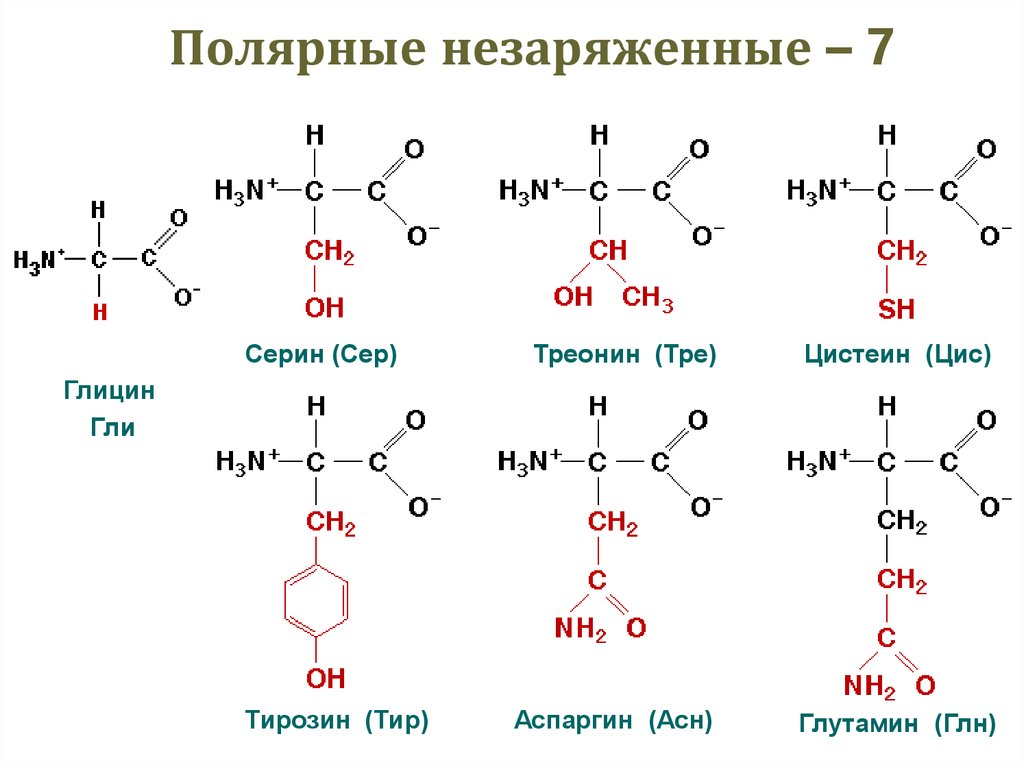
31. Полярные незаряженные – 7
Серин (Сер)Треонин (Тре)
Цистеин (Цис)
Аспаргин (Асн)
Глутамин (Глн)
Глицин
Гли
Тирозин (Тир)
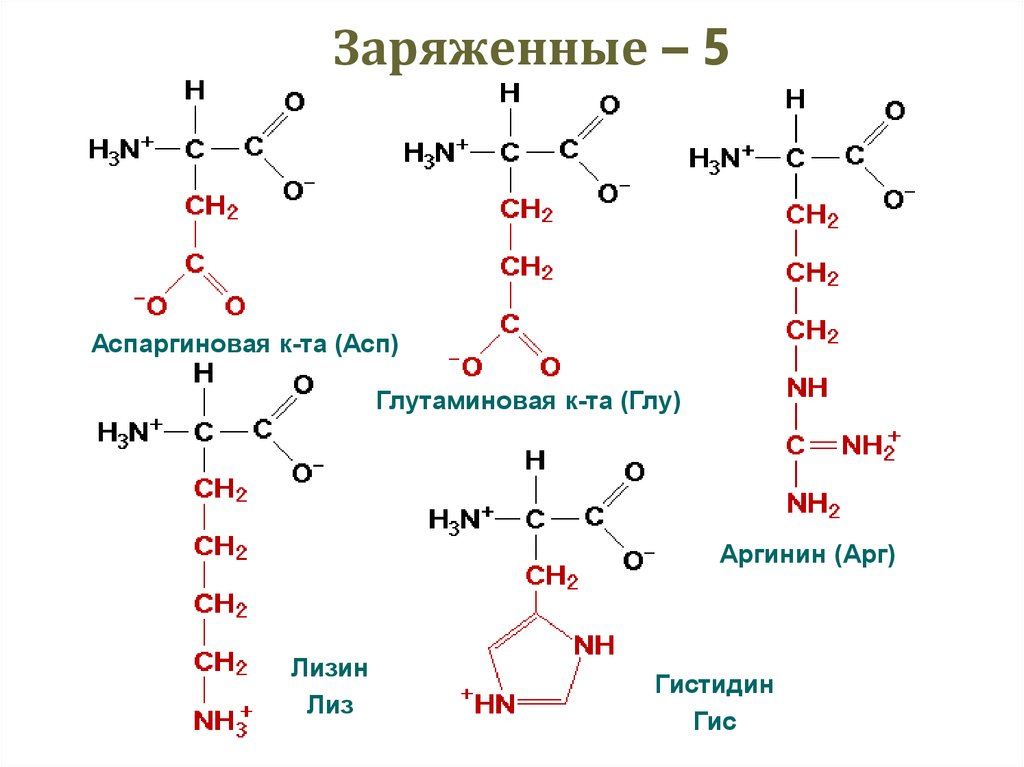
32. Заряженные – 5
Аспаргиновая к-та (Асп)Глутаминовая к-та (Глу)
Аргинин (Арг)
Лизин
Лиз
Гистидин
Гис
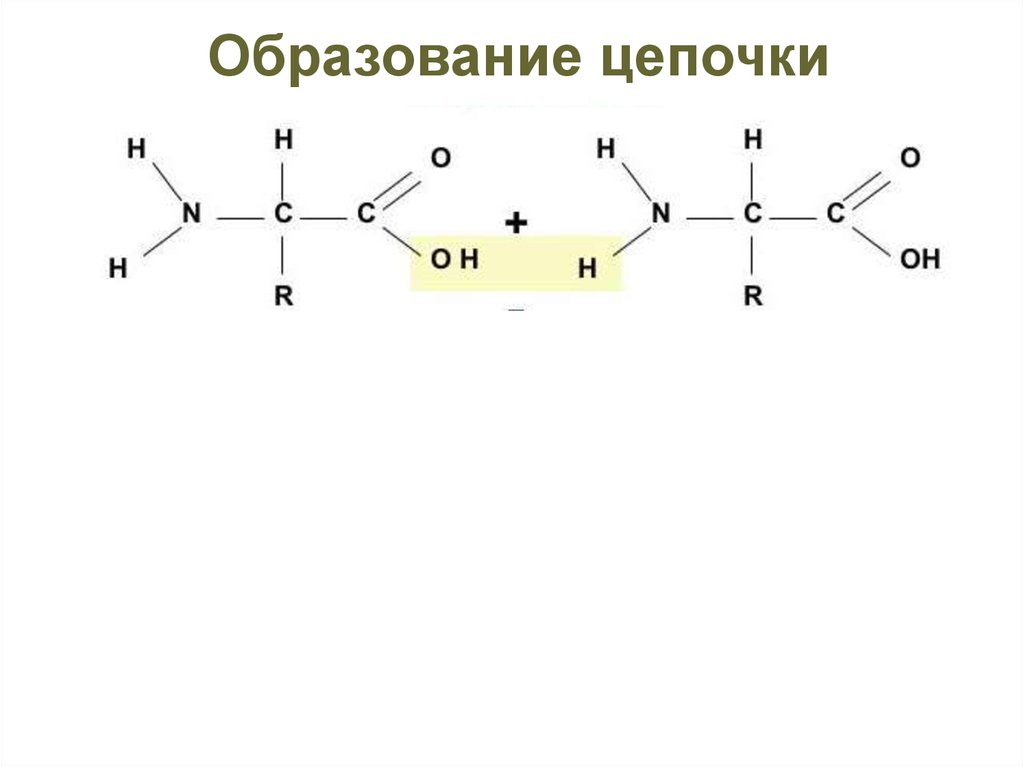
33.
Образование цепочкиЭнергия
N-конец
Пептидная связь
С-конец
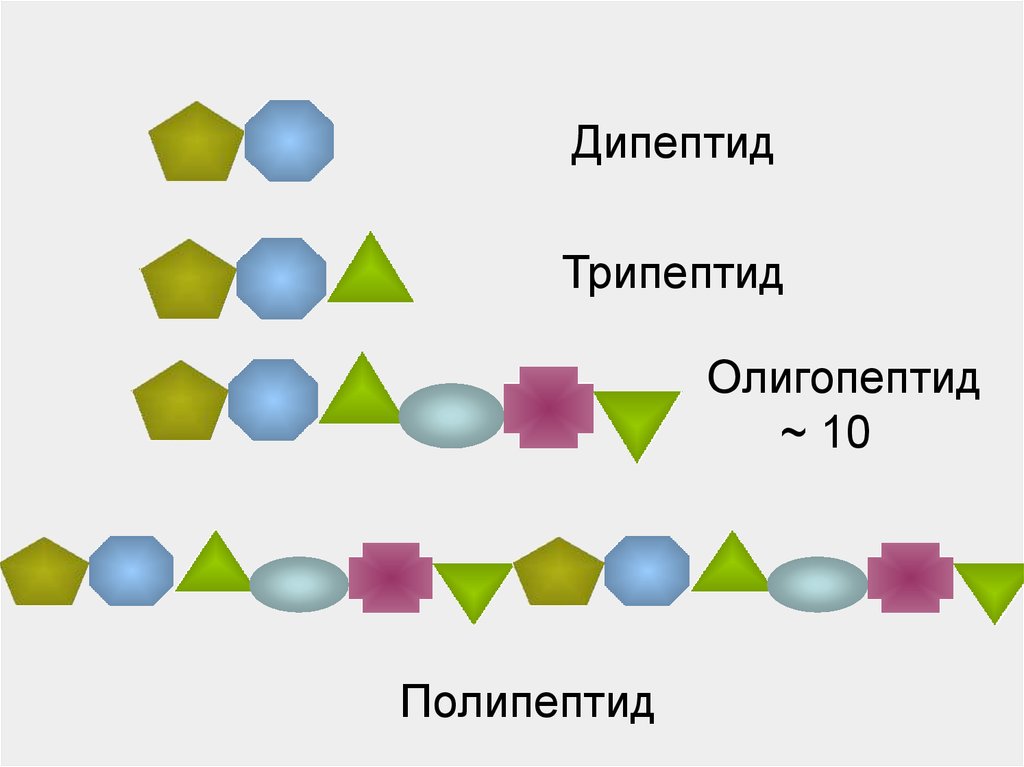
34.
ДипептидТрипептид
Олигопептид
~ 10
Полипептид
35.
I Первичная структура белка – этопоследовательность аминокислот в
полипептидной цепочке, записанная в
порядке N……..C.
(соответствует направлению роста цепочки при
ее синтезе в клетке).
N
Ала
1
Глу
Гис
Гис
Ала
Трп
2
3
4
5
6
Цис
7
Вал
8
Иле
9
C
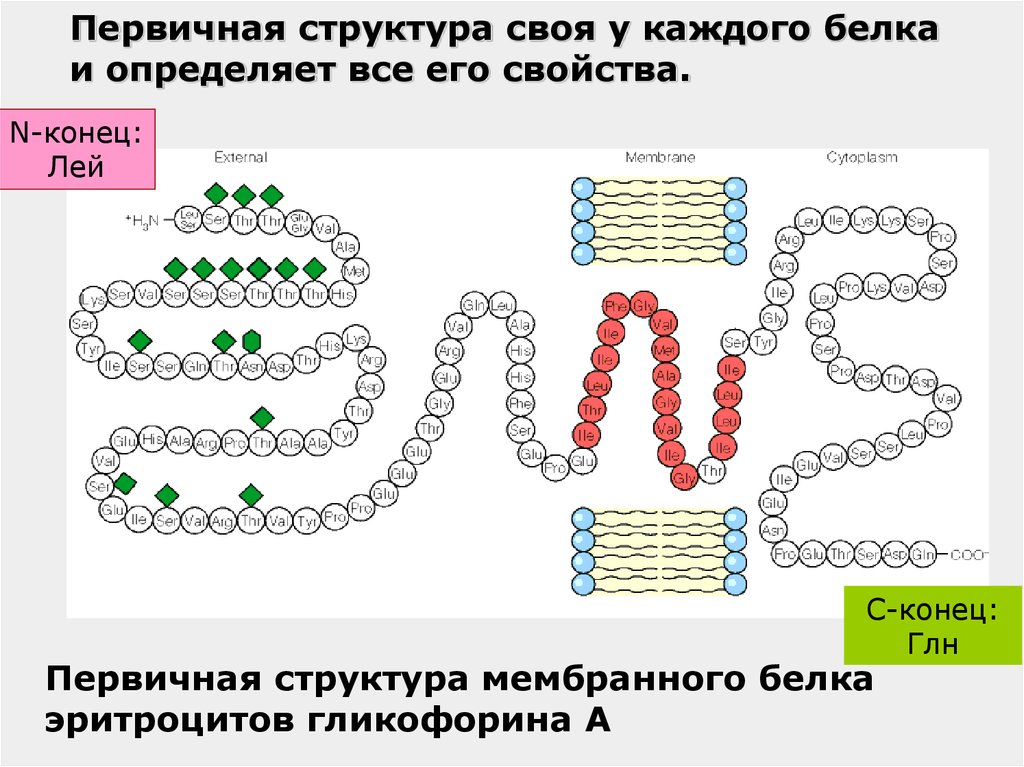
36.
Первичная структура своя у каждого белкаи определяет все его свойства.
N-конец:
Лей
C-конец:
Глн
Первичная структура мембранного белка
эритроцитов гликофорина А
37.
Белки с одной функцией у родственныхвидов имеют сходную I структуру
Количество отличий отражает время их
дивергенции в эволюции
Молекулярная
филогения
Эволюция белка р53 у
позвоночных
38. Эволюция шаперонина-60 за ~1.5 млрд.лет
Растенияи грибы
Животные
Простей
шие
Бактерии
Найдите участки белка, эволюционирующие
быстро и медленно
39.
Сколько разных белков длиной в nмономеров можно построить из 20
а.к.?
n
20
Средний белок: 300 а.к.
Длина большинства лежит в
пределах 100 – 2 000 а.к.
40.
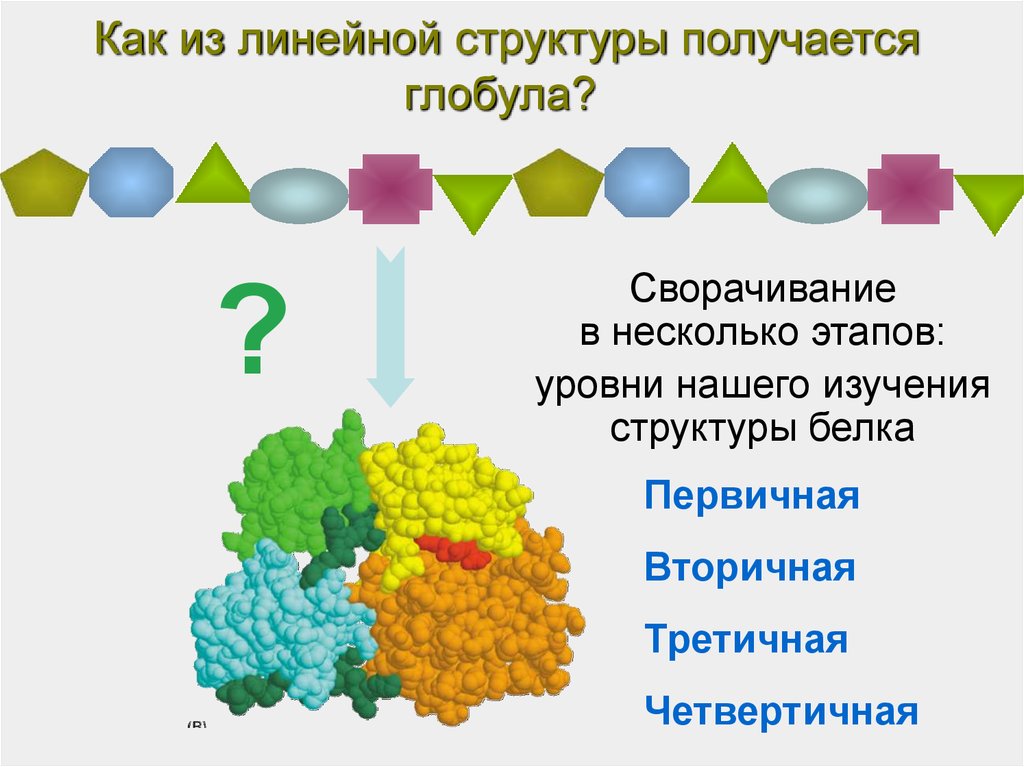
Как из линейной структуры получаетсяглобула?
?
Сворачивание
в несколько этапов:
уровни нашего изучения
структуры белка
Первичная
Вторичная
Третичная
Четвертичная
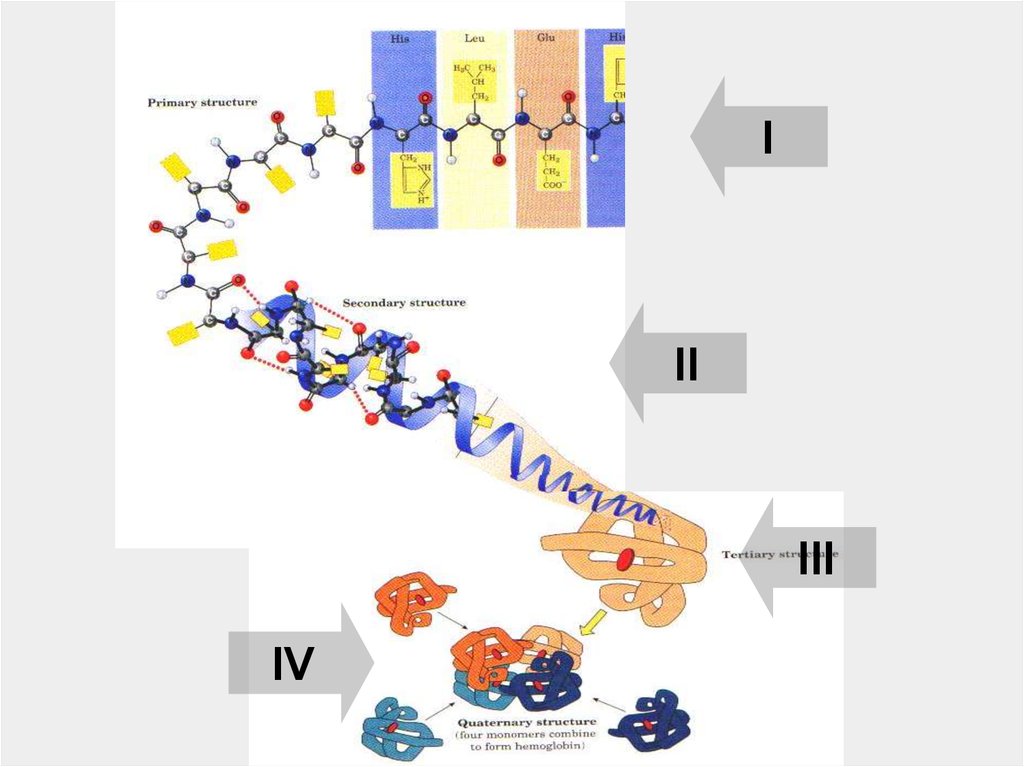
41.
III
III
IV
42.
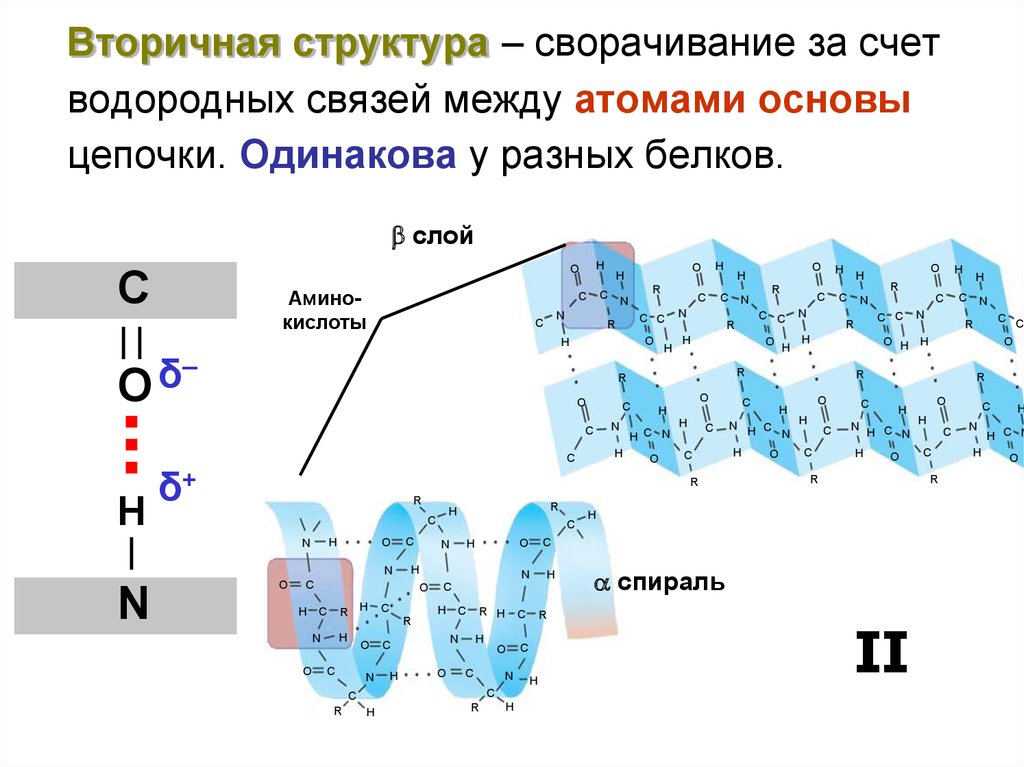
Вторичная структура – сворачивание за счетводородных связей между атомами основы
цепочки. Одинакова у разных белков.
слой
С
H
O
Аминокислоты
N
C
R
C
C
C C
O
H
O
C
N
H
δ+
H
O
H
N
O
N
O
C
R H
H
N
O
O
C
N
C
N
H
C
R H
H
N
C
H
O
C
N
C
H
R
R
C
O
C
C
R
H
C
R
H
H
O
H C N
O
H
C
C
H
N H C
N
H
H
H
O
H
R
C
C
N
N
C C
R
H
N
C
N
C C
R
O H H
O
R
C
H
O
H
O
H
C
C
R
C
N
H
H
H C N
O
R
O
H
C
C
R
H
C
O
H
N
O
C
C
H
C
H
R
H
C
H
C
C C
R
R
R
N
R
R
C
C
N
H
O
H
N
R
C
H
C
N
R
–
δ
О
H
O
H
спираль
II
C
N
H
H
H C N
O
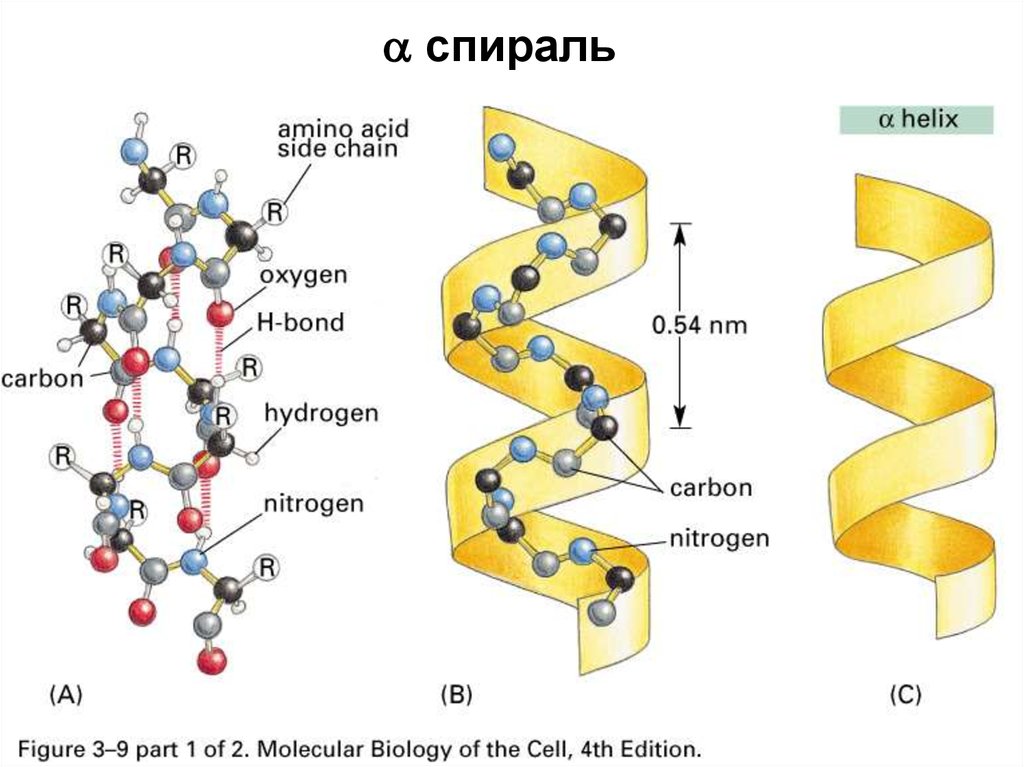
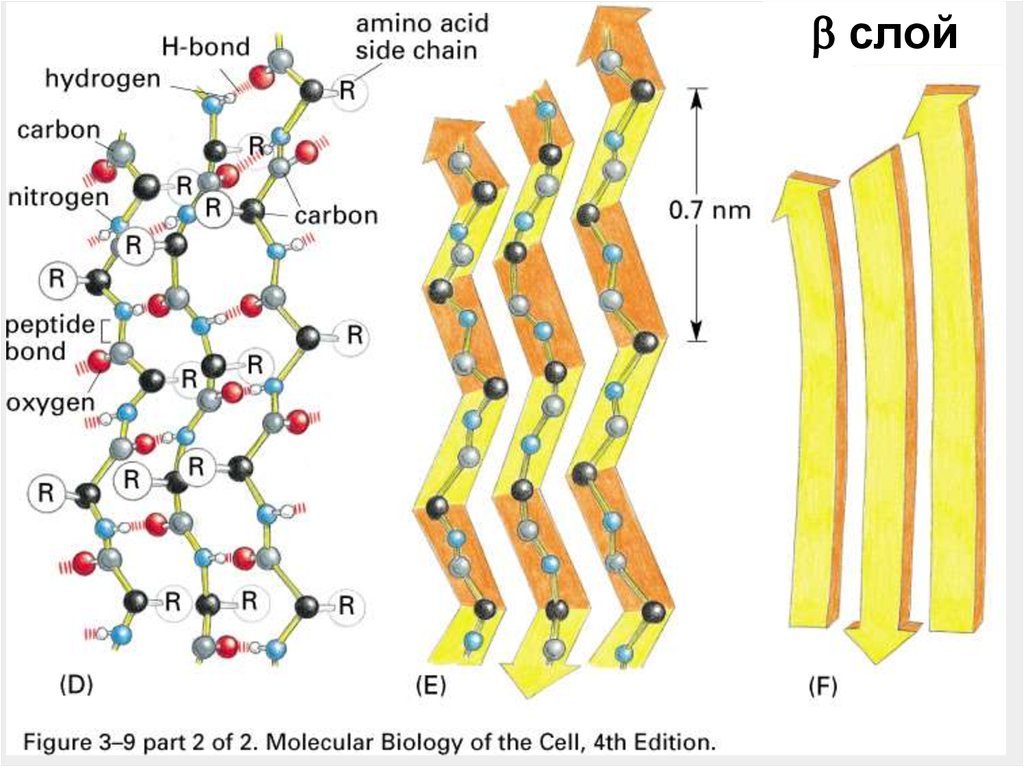
43.
спираль44.
слой45.
46.
В белках сочетаются разные типы вторичной структуры47.
Встречаемость в белках разныхвторичных структур
Нет II структуры
28% – 35%
18% – 26%
40% – 50%
48.
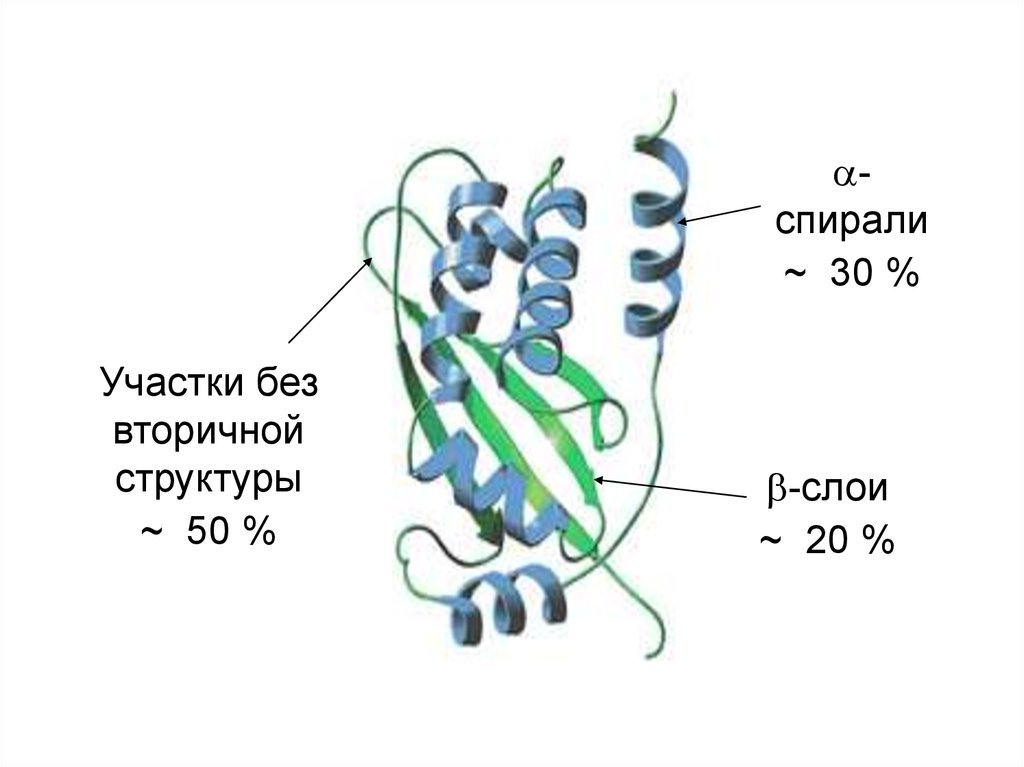
спирали~ 30 %
Участки без
вторичной
структуры
~ 50 %
-слои
~ 20 %
49. Лайнус Полинг
Открылα-спираль
в 1951
50.
Итак, у нас есть цепочка сэлементами II структуры
51. Третичная структура
IIIТретичная структура
Сворачивание за счет взаимодействий
между радикалами аминокислот.
полностью определяется
первичной структурой
Уникальна
для каждого белка
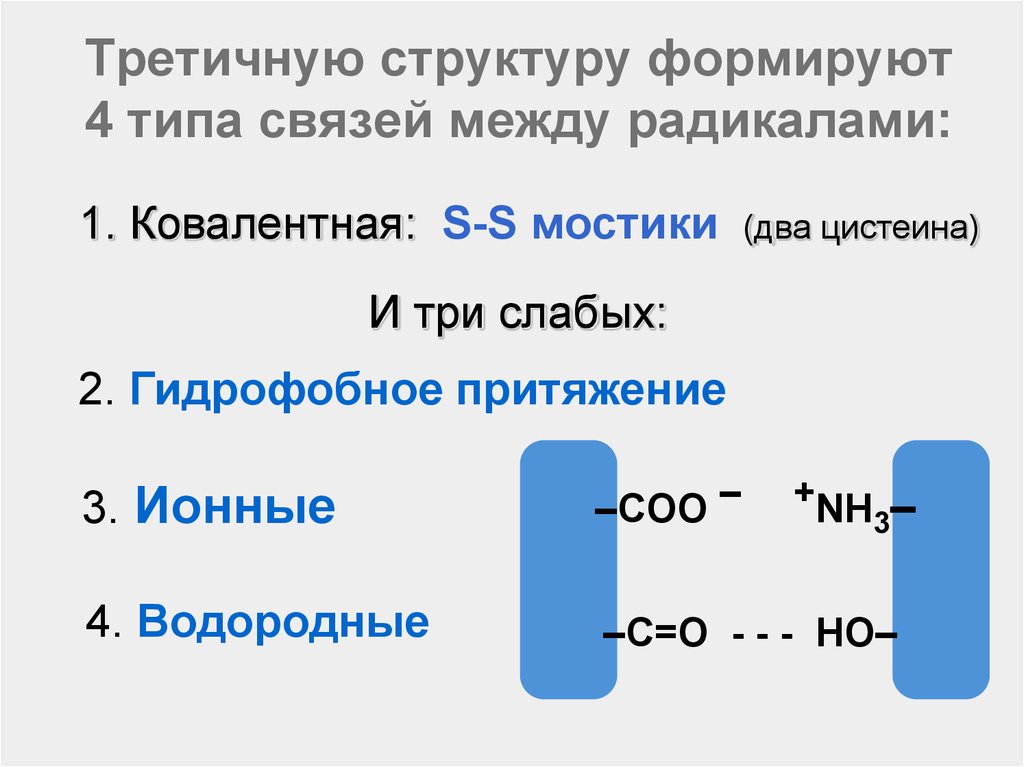
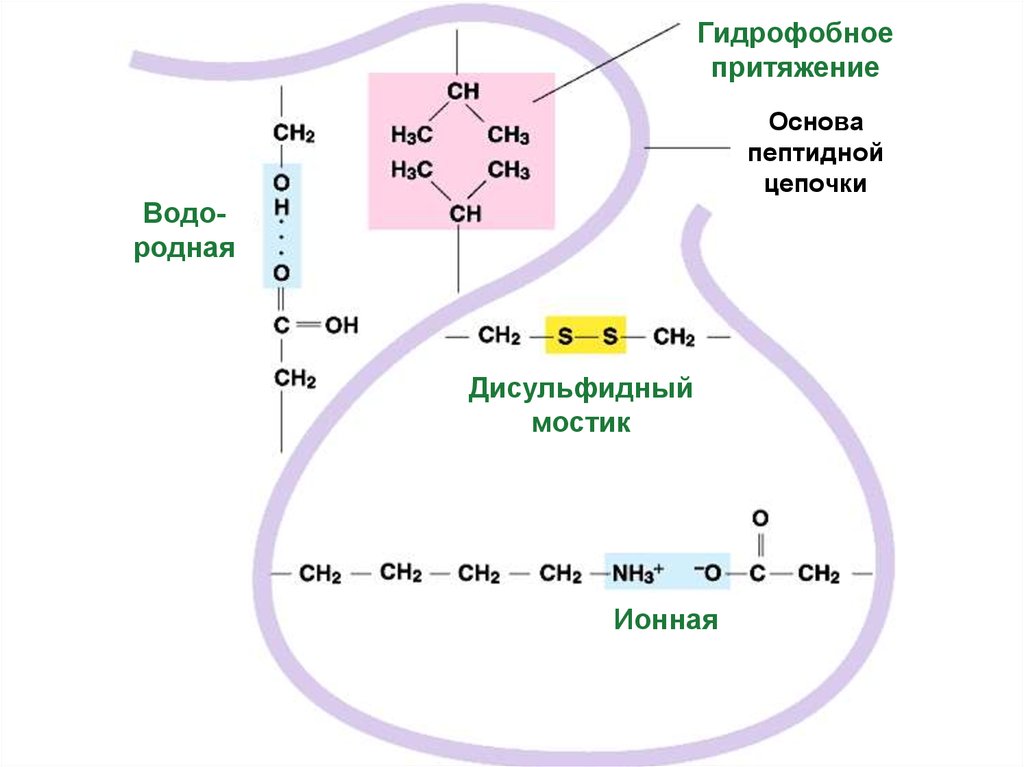
52. Третичную структуру формируют 4 типа связей между радикалами:
1. Ковалентная: S-S мостики(два цистеина)
И три слабых:
2. Гидрофобное притяжение
3. Ионные
–COO –
4. Водородные
–C=O - - - HO–
+NH
3–
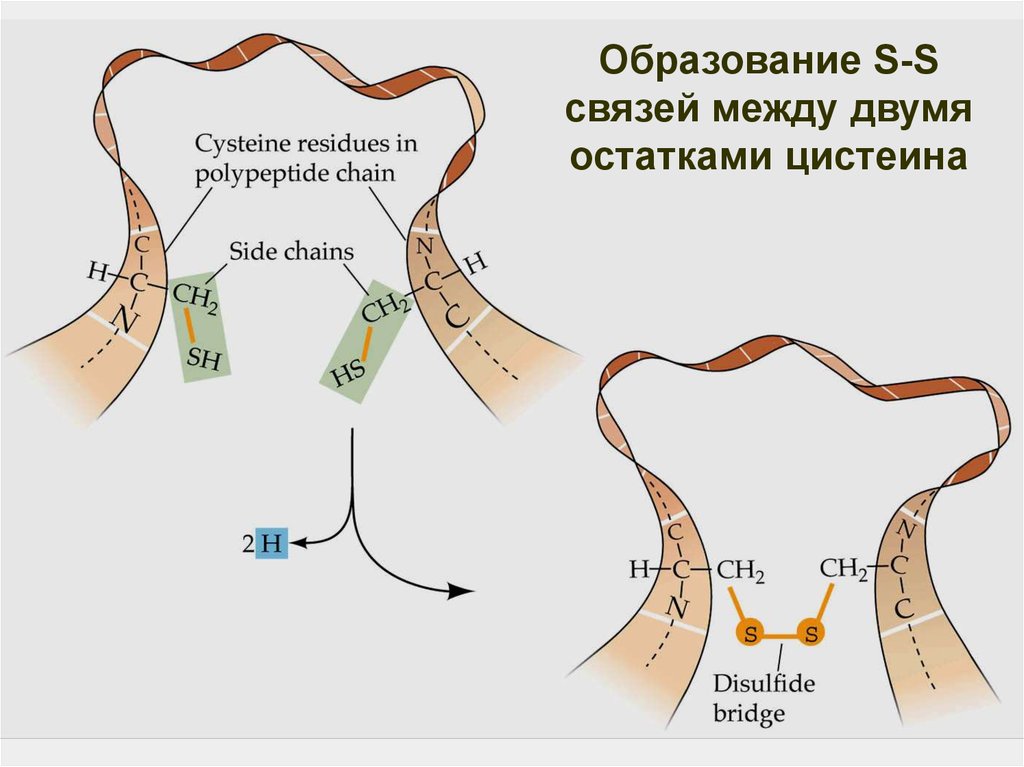
53.
Образование S-Sсвязей между двумя
остатками цистеина
54.
55.
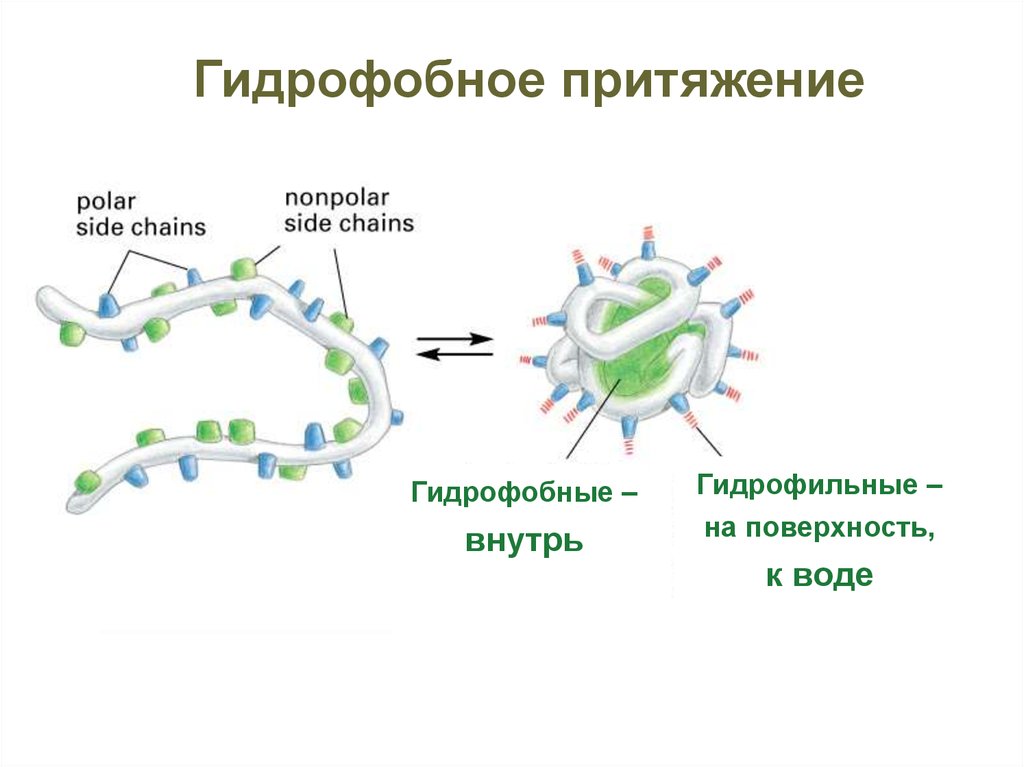
Гидрофобное притяжениеГидрофобные –
внутрь
Гидрофильные –
на поверхность,
к воде
56.
Гидрофобноепритяжение
Основа
пептидной
цепочки
Водородная
Дисульфидный
мостик
Ионная
57.
Глобулярный белокГлобула - шарик
Фибриллярный белок
Фибрилла - нить
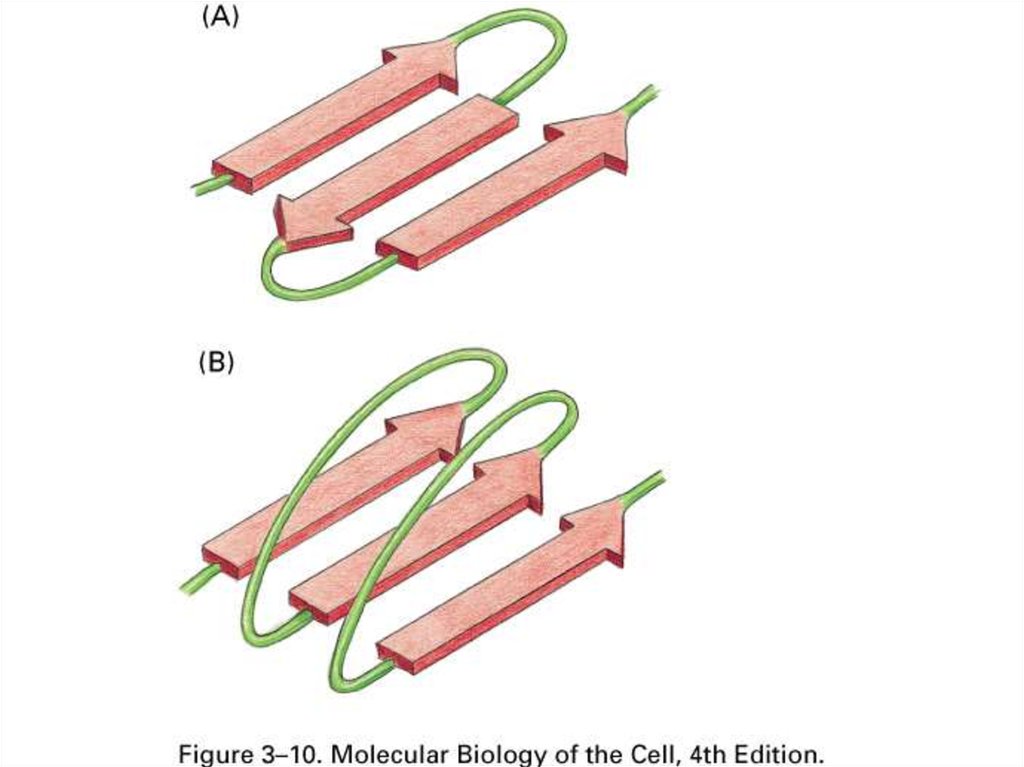
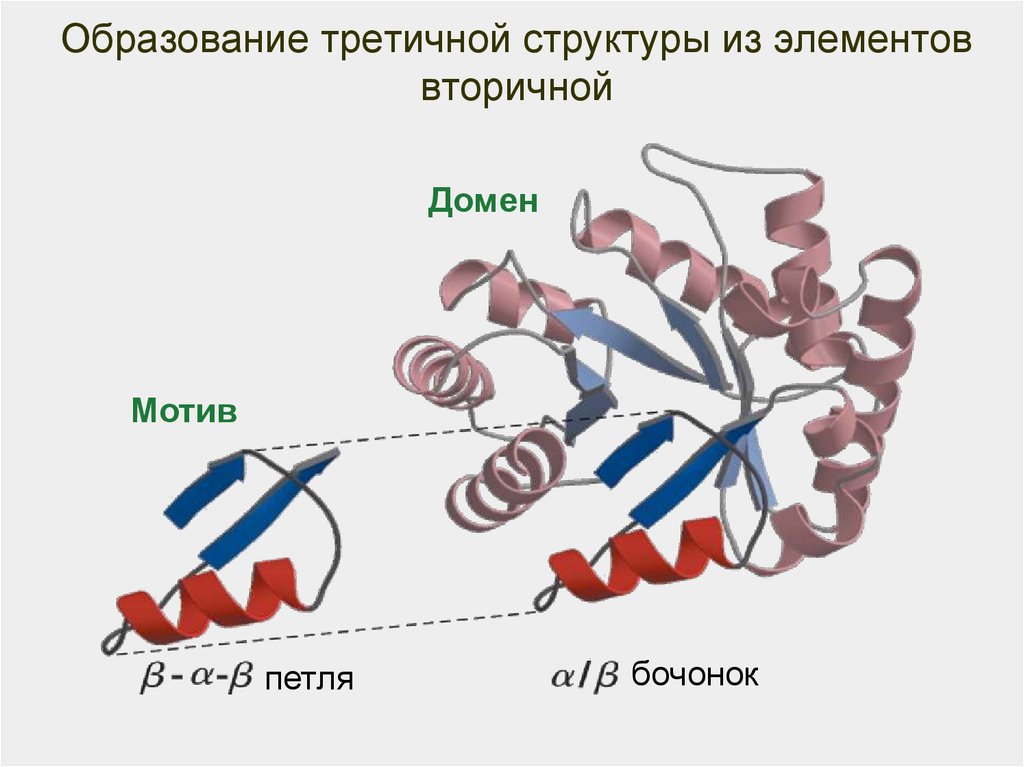
58. Образование третичной структуры из элементов вторичной
ДоменМотив
петля
бочонок
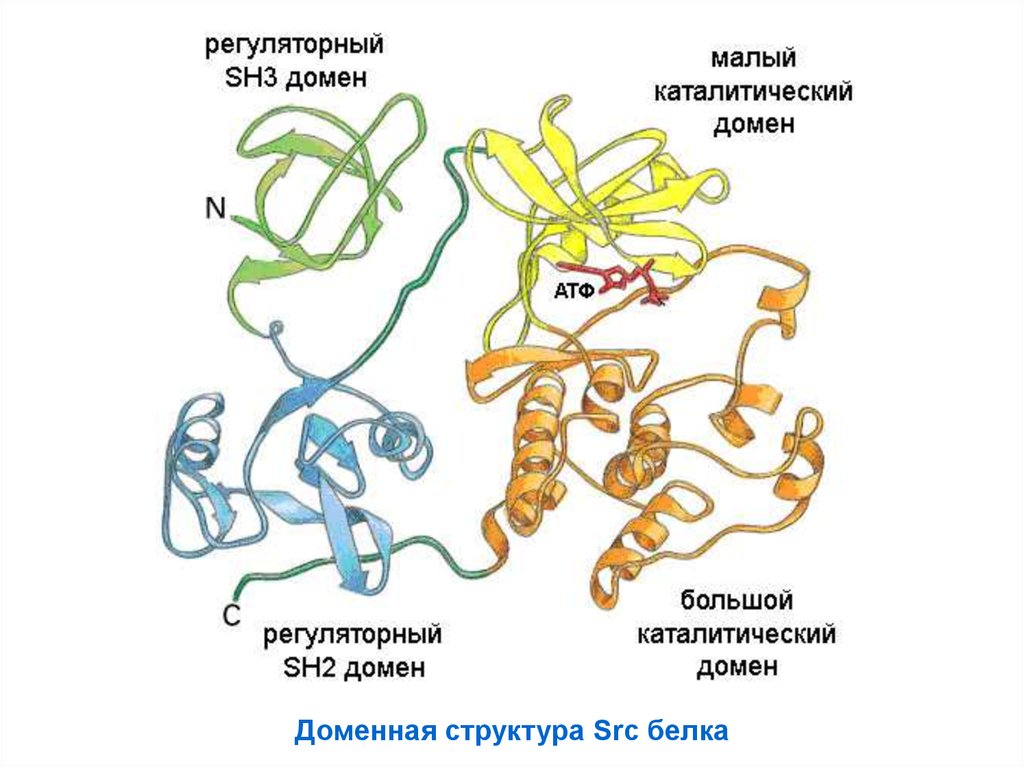
59.
Доменная структура Src белка60.
Домен – часть белкапространственно обособленная
сворачивается независимо
выполняет одну функцию
В эволюции домены –
функциональные блоки
из которых строятся
новые белки
61.
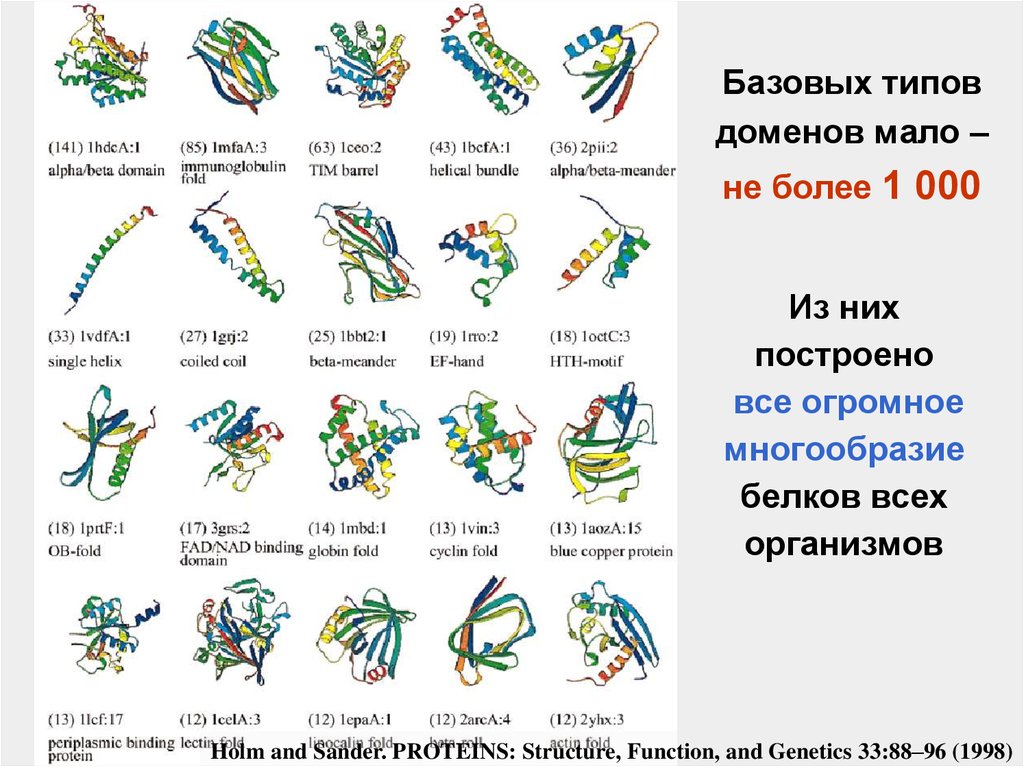
Базовых типовдоменов мало –
не более 1 000
Из них
построено
все огромное
многообразие
белков всех
организмов
Holm and Sander. PROTEINS: Structure, Function, and Genetics 33:88–96 (1998)
62.
Белки разных биологических видовс одной функцией – похожи
по пространственной форме
Хотя первичная последовательность может сильно отличаться
63.
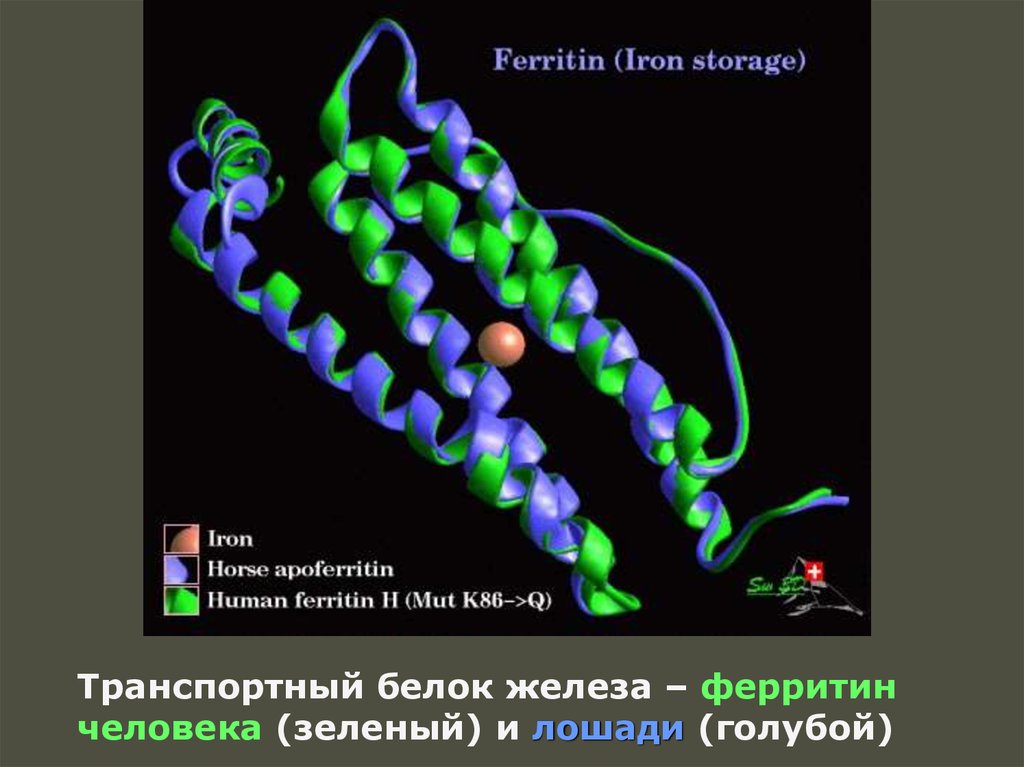
Транспортный белок железа – ферритинчеловека (зеленый) и лошади (голубой)
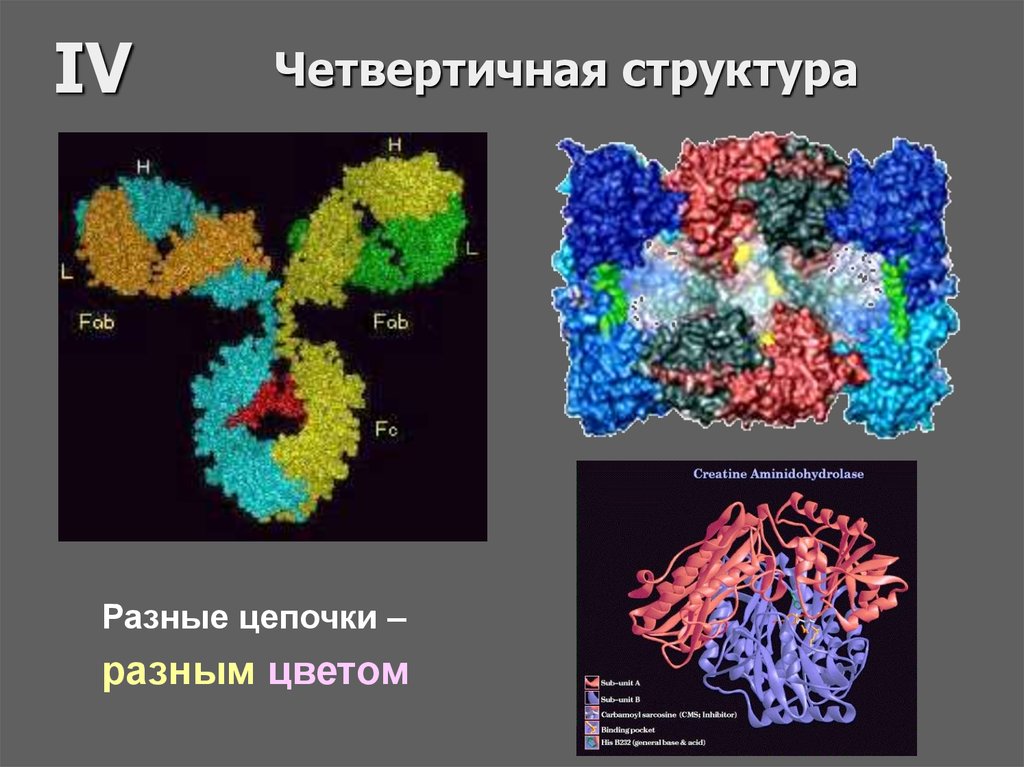
64. Четвертичная структура
IVЧетвертичная структура
Объединение двух и более (до 20)
полипептидных цепочек в один белок.
Одна цепочка = субъединица
Связи – те же, что при
формировании третичной.
Четвертичную структуру
имеют не все белки
(меньше половины)
+
65.
IVЧетвертичная структура
Разные цепочки –
разным цветом
66. Домашнее задание
Уметь нарисовать аминокислоту ипептидную связь.
Знать, что такое I, II, III и IV
структура
всё!























 Химия
Химия








