Похожие презентации:
Получение фосфорной кислоты
1. Получение фосфорной кислоты
Без фосфора не будет мысли.- Ludwig Buchner (1824-1899)
Производство минеральных удобрений
2. Сырьё
Фосфориты• 3Са3(РО4)2·СаСО3·Са(ОН, F)2
• Фосфоритная мука: измельчают добытые
Са3(РО4)2 и используют для нейтрализации
кислых почв.
Апатиты
Са3(РО4)2∙ nCaF2 ~ Са5(РО4)3F – фторапатит
Из апатитов получают фосфорную кислоту →
минеральные удобрения
3. В 1930 г. Ферсман А.Е. открыл залежи апатит-нефелиновых руд на Кольском п-ве около о. Имандра. Был построен завод по
В 1930 г. Ферсман А.Е. открыл залежи апатитнефелиновых руд на Кольском п-ве около о. Имандра.Был построен завод по производству апатитового
концентрата, который вели в центральную часть СССР
для производства фосфорной кислоты и минеральных
удобрений.
4. Сырьё
Добычу руды ведут открытым способом. Это связано:o С большим водопотреблением
o Образованием многотоннажных твердых отходов в
виде хвостов обогащения (до 40 % нефелинового
концентрата nSiO2∙Al2O3). Перерабатывать его
дорого и экономически невыгодно.
o Повышение уровня радиации (U в фосфатных рудах)
5.
СырьёРазделяют апатиты и нефелины флотационным
методом, предварительно измельчив руду.
К апатиту прилипают пузырьки воздуха и всплывают
пеной на поверхность Са5(РО4)3F – это пена-апатит.
Нефелин nSiO2∙Al2O3 в виде песка оседает на дно и
выводится с водой
6.
7.
Получение экстракционной фосфорной кислотыСтарейшим и более дешевым способом получения
фосфорной кислоты является вскрытие фосфатного
сырья (пена после флотации) концентрированной
серной кислотой. Получается фосфорная кислота с
образованием нерастворимого гипса, который затем
удаляют фильтрованием.
Основная реакция получения фосфорной кислоты:
2Ca5(PO4)3F + 10H2SO4 + 20H2O → 10CaSO4 ∙2H2O + 6H3PO4 + 2HF↑
Фосфогипс легко фильтруется, но загрязнен
фторидами (по F – 1,5%, Р – до 1%)
8.
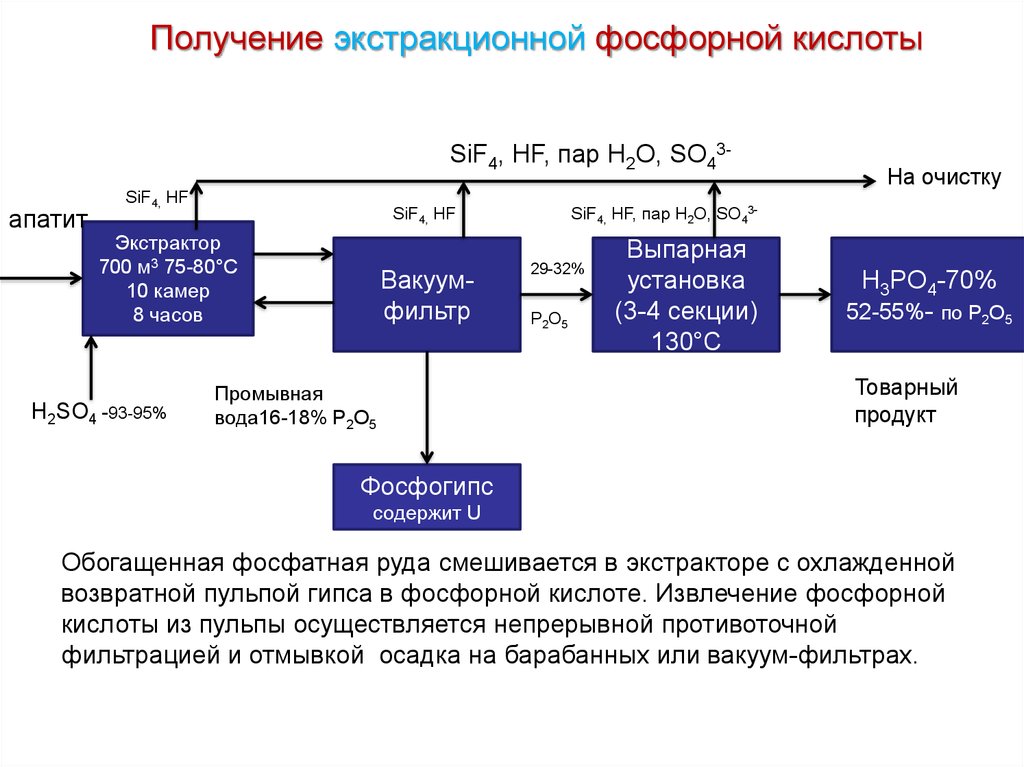
Получение экстракционной фосфорной кислотыSiF4, HF, пар H2O, SO43апатит
SiF4, HF
H2SO4 -93-95%
SiF4, HF, пар H2O, SO43-
SiF4, HF
Экстрактор
700 м3 75-80°С
10 камер
8 часов
Вакуумфильтр
Промывная
вода16-18% P2O5
На очистку
29-32%
Р2О5
Выпарная
установка
(3-4 секции)
130°С
H3PO4-70%
52-55%- по P2O5
Товарный
продукт
Фосфогипс
содержит U
Обогащенная фосфатная руда смешивается в экстракторе с охлажденной
возвратной пульпой гипса в фосфорной кислоте. Извлечение фосфорной
кислоты из пульпы осуществляется непрерывной противоточной
фильтрацией и отмывкой осадка на барабанных или вакуум-фильтрах.
9. Производство фосфорных удобрений кислотным методом
Суперфосфат - смесь Ca(H2PO4)2*H2O и CaSO4.Наиболее распространённое простое минеральное
фосфорное удобрение.
Получение суперфосфата
Гипс
балласт
Ca5(PO4)3F2(изб.) + H2SO4 + H2O →CaSO4↓+Ca(H2PO4)2 + HF↑
10.
Получение двойного суперфосфата:Называется так потому что из апатита сначала получают
фосфорную кислоту, а потом суперфосфат.
Отличается от простого суперфосфата небольшим содержанием гипса,
поэтому является более концентрированным удобрением.
Ca3(PO4)2 СaF2 + H3PO4→4Ca(H2PO4)2 + 2HF↑
11. Как распределяются фториды, которые были в исходном сырье?
• 3,5 % переходит в отходящие газы SiF4, HF• 15-17% переходит в фоcфогипс
• 80% в фосфорную кислоту, но после
упаривания 90% из них переходит в
газовую фазу на выпарной установке
12. Очистка отходящих газов от летучих соединений фтора
Образование фторсодержащих выбросов 15-30 г/м3 – этосамый концентрированный остро-токсический выброс F в
мире (действует на костную ткань).
Наиболее опасные соединения: HF и SiF4.
Для улавливания газов используют воду или дешевые
щелочные реагенты (Na2CO3,NH4OH, СаСО3,Са(ОН)2).
Реакции протекают с образование осадка.
Полученный раствор HF можно использовать при:
- изготовлении стекла, хрусталя;
- получения фторидов натрия, алюминия, кальция,
криолита, которые нужны в промышленности.
13. Очистка отходящих газов от летучих соединений фтора
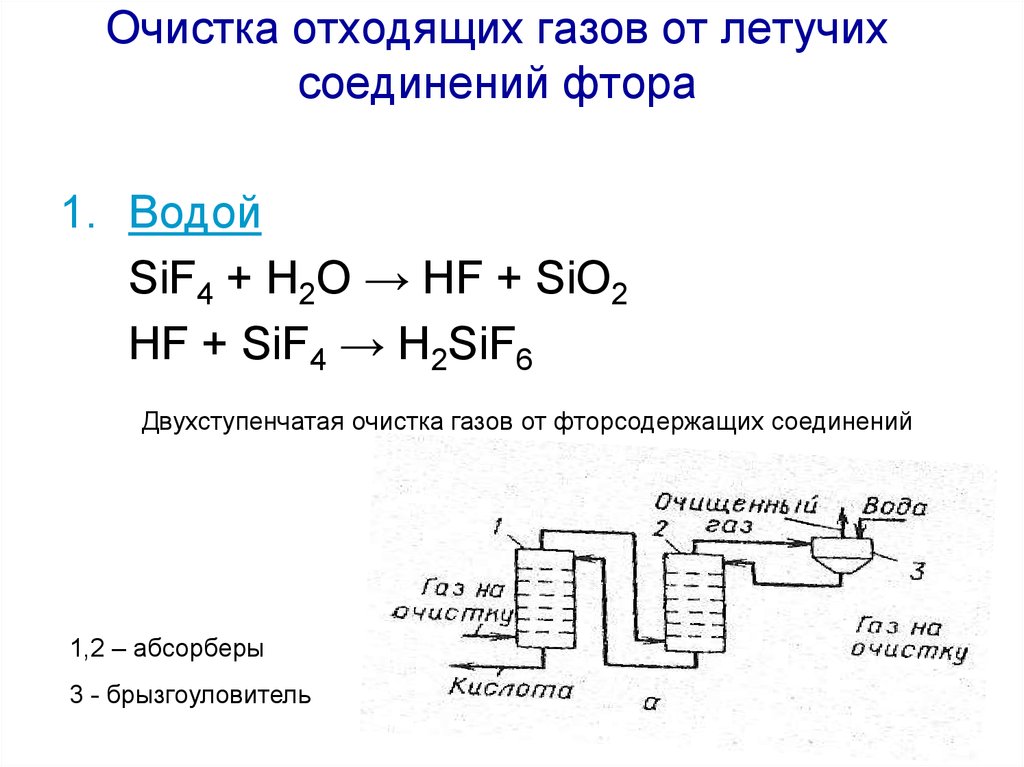
1. ВодойSiF4 + H2O → HF + SiO2
HF + SiF4 → H2SiF6
Двухступенчатая очистка газов от фторсодержащих соединений
1,2 – абсорберы
3 - брызгоуловитель
14. Очистка отходящих газов от летучих соединений фтора
2. СодойNa2CO3 + HF → NaF(мр.) + H2O + CO2
Недостатки:
Малорастворимый NaF забивает все
аппараты (насадки, тарелки и т.д).
Поэтому чаще используют процесс –
абсорбция аммонийных солей.
До 30 тыс. м3/час пропускная способность
в этих процессах.
15. Очистка отходящих газов от летучих соединений фтора
3.Аммонийно-карбонатный метод
2HF + (NH4)2CO3 → 2NH4F + H2O + CO2
HF + NH4OH → NH4F + H2O
SiF4 + 2NaF → Na2SiF6
NH4F + Na2CO3 → NaF(малораств.) + (NH4)2CO3
16.
Очистка отходящих газов от летучихсоединений фтора
4. Абсорбция Al(OH)3.
При использовании в качестве абсорбента Al(OH)3 получают
AlF3, необходимый для получения криолита Na3AlF6. Его
добавляют в сырьё для производства алюминия.
Н2SiF6 + Al(OH)3 → 2AlF3 + 4H2O + SiO2
3HF + Al(OH)3 → 2AlF3 + 3H2O
Н2SiF6 + 2Na2CO3 → 6NaF + 2CO2 + SiO2
NaF + AlF3 → Na3AlF6 – синтетический криолит
Процесс себя оправдывает, когда производство минеральных
удобрений и алюминия находятся рядом
17.
Очистка отходящих газов от летучихсоединений фтора
5. Адсорбция кусковым известняком.
350-450°С
HF + СаСО3 → СаF2↓ + H2O + СO2 – реакция идет
быстро
СаF2 – откалывается на грохотах
СаF2 + Н2SO4 → 2HF(конц) + CaSO4
CaSO4 – чистый гипс, используется в медицине
HF – концентрированная, если пропускать воду, то
получается товарная HF.
18. ФОСФОГИПС
На одну тонну экстракционной фосфорной кислоты (в пересчете на
100% Н3РО4) образуется 5-7 тонн фосфогипса.
• Существует 2 направления утилизации фосфогипса:
1. Жидкостной метод получения сульфата аммония – азотного
минерального удобрения. Имеет смысл, когда суточное производство
(NH4)2SO4 ˃ 300 т/сут.
(NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3↓
1- реактор для приготовления (NH4)2CO3 ;
2- мельница;
3- реакторы двойного замещения;
4- барабанный фильтр;
5- реактор-нейтрализатор;
6- выпарной аппарат
19. ФОСФОГИПС
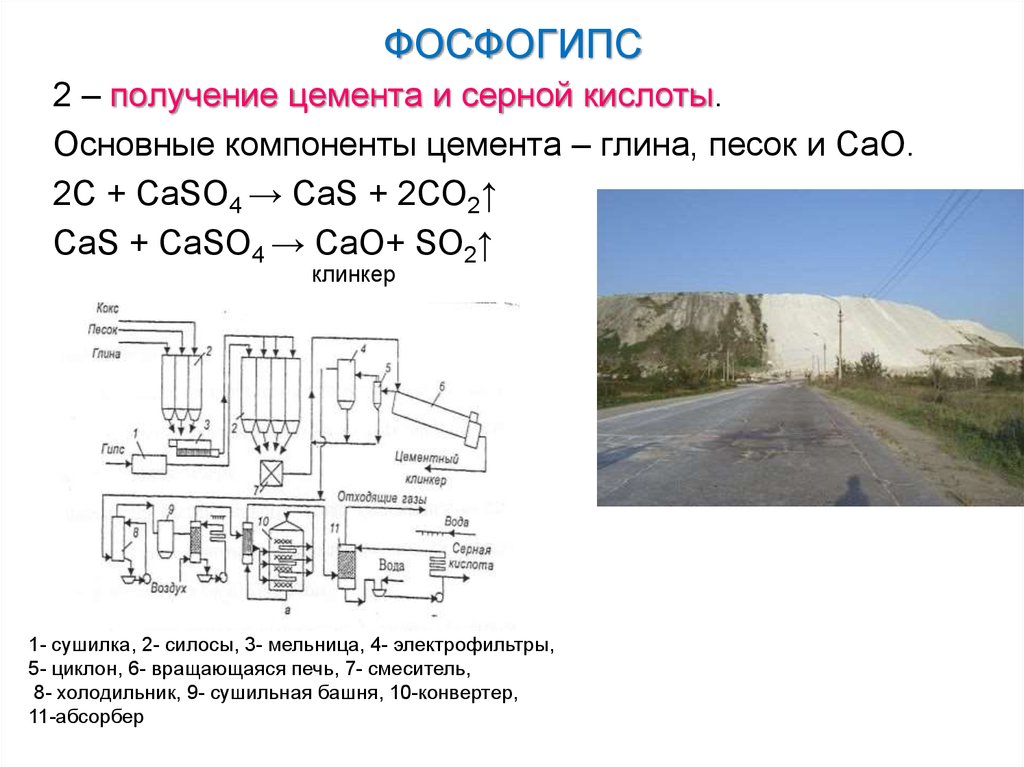
2 – получение цемента и серной кислоты.Основные компоненты цемента – глина, песок и СаО.
2С + CaSO4 → CaS + 2СO2↑
CaS + CaSO4 → СаО+ SO2↑
клинкер
1- сушилка, 2- силосы, 3- мельница, 4- электрофильтры,
5- циклон, 6- вращающаяся печь, 7- смеситель,
8- холодильник, 9- сушильная башня, 10-конвертер,
11-абсорбер
20. СТОЧНЫЕ ВОДЫ
Образование сточных вод:- При производстве 1 т суперфосфата на стадии
гранулирования образуется/расходуется от 1,5 до 3 м3
воды.
- При производстве 1 т фосфорной кислоты на стадии
промывки фосфгипса – 25-200 м3 воды.
- На 1 т двойного суперфосфата – 10-15 м3 свежей воды.
Сточные воды кислые, содержат РO43- . Фосфор биогенный
элемент→эвтрофикация водоема → O2↓ → заиливание и
гниение.
ПДКв водоеме= 0,01 мг/л по Р; ПДКв реках= 0,002-5 мг/л по РO43ПДКпит.= 3,5 мг/л; ПДКв водопр.= 0,4 мг/л → Ca3(PO4)2 остается
в трубах, идет зарастание труб.
21. СТОЧНЫЕ ВОДЫ
Очистка сточных вод1. Добавляют 10% суспензию известкового молока
Са(ОН)2 или СаСО3
2. Затем на барабанных фильтрах отфильтровывают
осадки CaF2 и Ca3(PO4)2
3. Шлам захоранивают


















 Химия
Химия








