Похожие презентации:
Конденсированное состояние
1. Конденсированное состояние
ВоГУЛекция 9
Конденсированное
состояние
Кузина Л.А.,
к.ф.-м.н., доцент
2015 г.
1
2. План
23.
Реальный газИдеальный газ: пренебрегали
1) межмолекулярным взаимодействием
2) собственным объёмом молекул
При больших плотностях газа и при низких
температурах модель идеального газа не работает:
надо учитывать
взаимодействие молекул
собственный объём молекул
3
4.
Межмолекулярные взаимодействияМежмолекулярные силы действуют на расстояниях r 10 9 м
Между молекулами действуют как силы притяжения,
так и отталкивания:
Fотт.
1
~ 13
r
Суммарная сила:
1
Fприт. ~ 7
r
F Fотт. Fприт.
4
5.
Межмолекулярные взаимодействия5
6.
Межмолекулярные взаимодействияРавновесное расстояние:
минимум потенциальной
энергии взаимодействия
молекул
dEпот.
F
dr
6
7.
Межмолекулярные взаимодействияkT E0
kT E 0
kT E 0
7
8.
Уравнение состояния реального газа(Уравнение Ван дер Ваальса)
Модель Ван дер Ваальса учитывает:
собственный объём молекул
взаимодействие молекул
p Vm RT
p p Vm b RT
поправка на давление
поправка на объём
8
9.
Поправка на объём bp p Vm b RT
в расчёте на одну молекулу 1 4 d 3
запрещённый объём:
2 3
4
d3
3
В расчёте на один моль запрещённый объём:
1 4
3
b NА d
2 3
3
4 d
b 4 NА
3 2
Поправка b на объём равна
учетверённому собственному
объёму одного моля молекул
9
10.
p’ – поправка на давлениеp p Vm b RT
Сила притяжения двух слоёв газа друг к другу
пропорциональна числу молекул в каждом слое
F ~ n.n
Концентрация :
NA
n
Vm
Дополнительное молекулярное давление:
F
1
2
p ~ n ~
S
Vm2
p
a
Vm2
10
11.
Уравнение Ван дер Ваальсаa
p
V b RT
m
2
Vm
Для произвольной массы газа:
Vm
V
2
p a V b RT
2
V
11
12.
Уравнение Ван дер Ваальсаa
p
V b RT
m
2
Vm
Замечание 1: при высоких температурах и низких плотностях (низком
давлении) молярный объём большой:
a
p , уравнение Ван дер Ваальса переходит в
Vm >> b и
2
Vm
уравнение Менделеева-Клапейрона:
a
p
V b RT
m
2
Vm
12
13.
Уравнение Ван дер Ваальсаa
p
V b RT
m
2
Vm
Замечание 2: уравнение Ван дер Ваальса – одна из возможных моделей.
Эта модель приближённо описывает характер взаимодействия молекул:
13
14.
Изотермы реального газа. Критические параметрыОбозначение:
V Vm
a
p
V b RT
m
2
Vm
a
p
V b V 2 RT V 2
V2
p V 3 pb RT V 2 aV a b 0
14
15.
Изотермы реального газа. Критические параметрыp V 3 pb RT V 2 aV a b 0
Это уравнение третьей степени относительно объёма
В общем случае оно имеет три корня
при T=Tк все три действительных корня совпадают;
График имеет точку перегиба
Температура Tк называется критической,
как и соответствующая этой температуре изотерма.
Давление pк и молярный объём Vк реального газа,
соответствующие точке перегиба – тоже критические
15
16.
Изотермы реального газа. Критические параметрыp V 3 pb RT V 2 aV a b 0
Критическая изотерма
Критическая точка
Эксперимент
По уравнению Ван дер Ваальса
16
17.
Изотермы реального газа. Критические параметрыp V 3 pb RT V 2 aV a b 0
Критическая изотерма
переохлаждённый пар
перегретая жидкость
Растянутая жидкость
17
18.
Критическое состояниеКритическое состояние – особое состояние вещества,
пограничное между паром и жидкостью
Критическая точка – точка, в которой состояния жидкости
и пара совпадают
Плотность пара равна плотности жидкости, поэтому
нет вообще границы между ними
Нет поверхностного натяжения, коэффициент
поверхностного натяжения обращается в ноль
19.
Критическое состояниеМожно найти связь между критическими параметрами
pк , Tк и Vк и поправочными коэффициентами a и b в
уравнении Ван дер Ваальса
В критической точке уравнение Ван дер Ваальса имеет три
одинаковых корня, поэтому его можно записать через куб
разности (V-Vк):
pк V Vк 0
3
19
20.
Критическое состояниеСвязь между критическими параметрами pк , Tк и Vк и
поправочными коэффициентами a и b в уравнении Ван дер
Ваальса
pк V Vк 3 0
p V 3 pb RT V 2 aV a b 0
pк b RTк 3 pк Vк
2
a 3 pкVк
ab pкVк3
20
21.
Критическое состояниеpк b RTк 3 pк Vк
a 3 pкVк2
ab pкVк3
Vк 3b
a
pк
2
27
b
8a
Tк 27 R b
Vк
b
3
a 3 p V 2
к
к
21
22.
Внутренняя энергия реального газаВнутренняя энергия реального газа равна сумме:
кинетической энергии хаотического движения молекул
потенциальной энергии взаимодействия молекул
U m Eкин. Eпот. CV T Eпот.
Силы притяжения в модели Ван дер Ваальса создают дополнительное
давление p’:
a
p
Vm2
Работа по преодолению сил притяжения при увеличении объёма на dVm
идёт на увеличение потенциальной энергии:
dAm p dVm dEпот.
22
23.
Внутренняя энергия реального газаdAm p dVm dEпот.
p
a
Vm2
dEпот. a
p
2
dVm
Vm
a
Eпот.
Vm
U m Eкин. Eпот. CV T Eпот.
a
U m CV T
Vm
a
a
U U m CV T
CV T
V
V
2
Внутренняя энергия
произвольного
количества газа 23
24.
Фазы и фазовые переходыФаза – термодинамически равновесное однородное по физическим свойствам
состояние вещества
Фаза – совокупность однородных частей системы
Примеры:
Вода в закрытом сосуде – это равновесие
двух фаз: жидкости и насыщенного пара
При 00С могут сосуществовать 3 фазы воды:
лёд, жидкость и пар
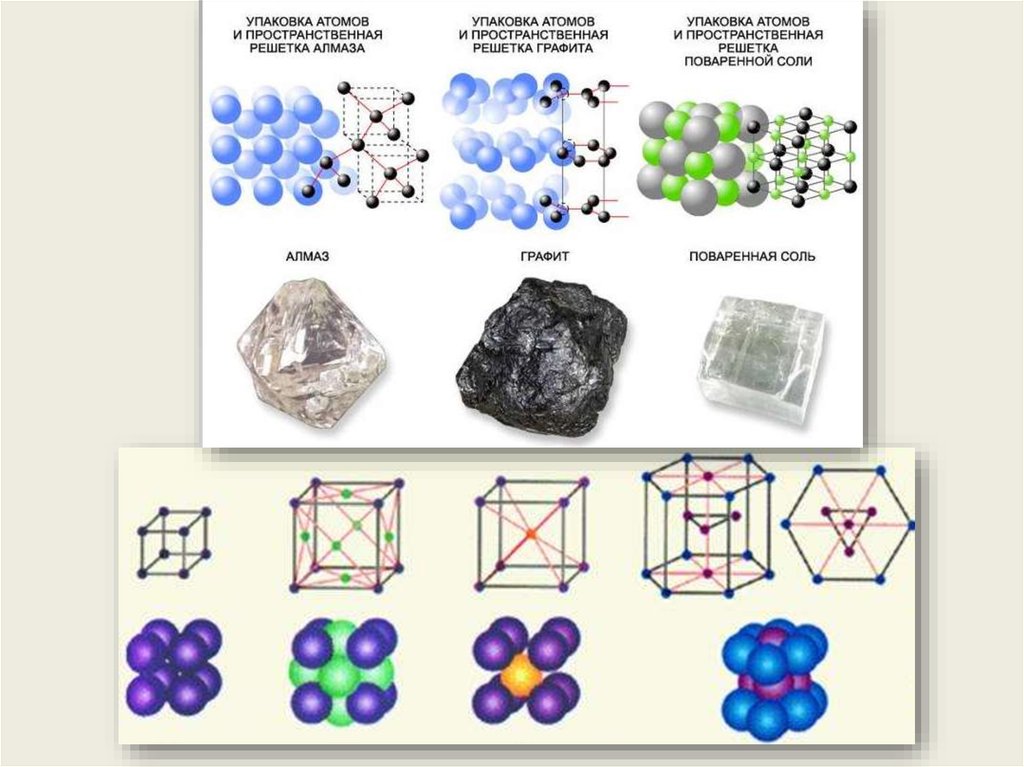
Графит и алмаз – это две разных фазы твёрдого углерода;
они имеют существенно разные физические свойства
Лёд может существовать в нескольких (более десятка) различных фазах;
они отличаются структурой кристаллических решёток, и как следствие,
различными свойствами
24
25.
Фазовая диаграммадаёт представление об условиях существования той или иной фазы
Фазовая диаграмма воды
25
26.
Фазы и фазовые переходы26
27.
Фазы и фазовые переходыРавновесие
трёх фаз
27
28.
Фазы и фазовые переходыФазовым переходом первого рода называется
фазовый переход с поглощением или выделением
теплоты
Все агрегатные превращения – это фазовые переходы
первого рода:
парообразование, конденсация, сублимация, возгонка,
кристаллизация, плавление
Фазовый переход первого рода сопровождается резким изменением плотности
вещества
При фазовых переходах первого рода теплоёмкость вещества обращается в
бесконечность: C
Q
dT
, поскольку теплота поглощается (выделяется) ,
а температура не изменяется
28
29.
Для фазовых переходов первого рода уравнение Клапейрона-Клаузиуса:Qперехода
dp
dT Tперехода V2 V1
ΔQперехода – теплота, выделяющаяся (поглощаемая) при фазовом переходе
Tперехода – температура, при которой происходит переход
(V2 – V1) – изменение объёма при переходе
29
30.
Фазы и фазовые переходыФазовый переход второго рода
не сопровождается поглощением или выделением теплоты
При фазовых переходах второго рода
скачкообразно меняются свойства вещества:
теплоёмкость, вязкость, ферромагнитные свойства,
электрические свойства…
Примеры фазовых переходов второго рода:
переход ферромагнетик-неферромагнетик при температуре Кюри
переход в сверхпроводящее состояние при сверхнизких температурах
переход жидкого гелия в сверхтекучее состояние при сверхнизких
температурах
переход кристалла из одной модификации в другую (металлы, графиталмаз, лёд и т.д.)
полимерные переходы жидких кристаллов; при этом меняются
оптические свойства
30
31.
Фазы жидких кристалловнематик
смектик
холестерик
31
32.
Жидкое состояниеГаз
kT E0
Газ занимает
весь объём
Молекулы
движутся
хаотично
– промежуточное между газом и твёрдым телом:
сочетает свойства того и другого.
Жидкость
kT E0
Силы притяжения удерживают
частицы на определённых
расстояниях друг от друга
Молекулы жидкости колеблются
около своего положения
равновесия в течение некоторого
времени. Затем перескакивают в
соседнее положение равновесия
Ближний порядок в расположении
частиц: упорядоченность на
небольших расстояниях,
сравнимых с межатомными
Твёрдое тело
kT E0
Сохраняет не только
объём, но и форму
Частицы колеблются
около своего положения
равновесия
Дальний порядок в
расположении частиц:
упорядоченность
сохраняется на больших
расстояниях
32
33.
Жидкое состояниеТеории жидкости, объясняющей все её свойства, нет.
Некоторые проблемы жидкости разработаны Френкелем.
По его теории, молекулы жидкости колеблются около своего положения
равновесия в течение некоторого времени, которое называется временем
оседлой жизни.
Затем перескакивают в соседнее положение равновесия. Время оседлой
жизни примерно равно τ≈10-12÷10-10 с и сильно зависит от температуры:
E
e
0
пот
kT
Тепловое движение молекул жидкости носит групповой характер
С возрастанием температуры молекулы становятся более подвижными
33
34.
Аморфное телоВязкость жидкости при понижении температуры может так сильно
увеличиваться, что такая жидкость теряет текучесть и превращается в
аморфное тело
Примеры: стекло, смола, воск
Аморфное тело – переохлаждённая жидкость
Свойства аморфных тел:
Сохраняют форму, как кристаллические
Нет определённой температуры плавления
Ближний порядок в расположении частиц, как у жидкостей
Изотропны, как жидкости
34
35.
Кристаллические телаАморфные тела
Жидкости
Дальний порядок
Анизотропны
Ближний порядок
Изотропны
35
36.
Жидкие кристаллыВ жидких кристаллах в пределах значительного объёма
наблюдается одинаковая ориентация молекул (если, например,
молекулы длинные с боковыми отростками)
ЖК анизотропны
Дальнего порядка в ЖК может и не быть
36
37.
Поверхностное натяжениеРадиус молекулярного действия
rмд 10 9 м
Сфера молекулярного действия – сфера с радиусом, равным радиусу
молекулярного действия.
Любая молекула, находящаяся в сфере молекулярного действия данной
молекулы, взаимодействует с ней (притягивается); вне сферы – не
взаимодействует с ней
rм.д.
r>rм.д.
38.
Для перемещения молекулы из глубины жидкостина поверхность молекула должна затратить
энергию, следовательно, за счёт своей кинетической
энергии приобретает поверхностную
потенциальную энергию
Поверхностная потенциальная энергия пропорциональна площади
свободной поверхности жидкости:
EПОВ.ПОТ. S
EПОВ .ПОТ .
S
Дж Н
2
м
м
38
39.
EПОВ.ПОТ. SРавновесие: Eпов.пот. – минимальна
Площадь S свободной поверхности жидкости минимальна
Жидкость принимает форму шара т.к. шар имеет
минимальную площадь поверхности при заданном объёме
Капли воды на МКС
39
40.
Работа, совершаемая при перемещении контура на dx:dA Fdx
dA dEПОВ.ПОТ.
dEПОВ.ПОТ. dS
dS l dx
Fdx l dx
F
l
α - коэффициент поверхностного натяжения численно равен силе
поверхностного натяжения, приходящейся на единицу длины контура
40
41.
Давление под искривлённой поверхностью.Формула Лапласа
Поверхностная плёнка стремится к сокращению → создаётся
дополнительное давление Δp на жидкость по сравнению с
плоской поверхностью
41
42.
Формула ЛапласаНайдём избыточное давление Δp для выпуклой сферической поверхности с
радиусом кривизны R и радиусом сегмента r :
FП.Н. l 2 r
Fy FП.Н. cos
2
2 r cos 2 cos
p
p
R
S
r
r2
2
S r
R cos r
Fy
42
43.
Давление под сферической поверхностью:Выпуклая:
Вогнутая:
R>0, Δp>0
R<0, Δp<0
2
p
R
Для плоской поверхностиR=0, Δp=0
Для произвольной поверхности любой формы – формула Лапласа:
1
1
p
R1 R2 43
44.
Давление под искривлённой поверхностью.Формула Лапласа
Высота поднятия жидкости в капилляре:
Избыточное давление под
искривлённой поверхностью
жидкости уравновешивается
гидростатическим давлением
столба жидкости высотой h:
2 2 cos
p
g h
R
r
44
45.
Поверхностное натяжениеСмачивание:
Несмачивание:
краевой угол – острый
краевой угол – тупой
Силы притяжения молекул:
Fж-ж<Fж-т
Fж-ж>Fж-т
45
46.
Твёрдые телакристаллические
монокристаллические
аморфные
поликристаллические
дальний порядок в расположении частиц
ближний порядок в
расположении частиц
изотропны
изотропны
анизотропны
Примеры:
Кварц
Алмаз
NaCl
Лёд
Органические вещества в
твёрдом состоянии (белки,
нуклеиновые кислоты…)
Полупроводники
Металлы
Воск
Смолы (битум, янтарь)
Стёкла (обсидиан , опал)
Клеи
Полимеры с нерегулярной
последовательностью
звеньев
Аморфные металлы (при
быстром охлаждении)
46
47.
Твёрдые телакристаллические
дальний порядок в
расположении частиц
аморфные
ближний порядок в
расположении частиц
47
48.
Твёрдые телаКристаллы анизотропны
Их свойства различны в зависимости от направления внутри
кристалла, потому что на отрезках одинаковой длины в
кристалле укладывается разное число атомов:
48
49.
Кристаллическое состояниеСуществует 230 видов кристаллических решёток с различным
типом симметрии
Простые формы кристаллов:
Всякий кристалл может быть
получен периодическим
повторением в трёх направлениях
одного и того же структурного
элемента – элементарной ячейки
49
50.
51.
Простейшая решётка – кубическаяпростая
объёмоцентрированная
гранецентрированная
N – число атомов, приходящихся на одну ячейку:
1
N 8 1
8
каждый из 8
атомов в
вершинах куба
принадлежит
данной ячейке и
семи соседним
1
N 8 1 2
8
добавляется один атом
в центре куба,
принадлежащий только
данной ячейке
1
1
N 8 6 4
8
2
добавляются 6 атомов в
центре каждой грани,
причём каждый из них
принадлежит данной
ячейке и соседней
51
52.
Физические типы решётокВ зависимости от природы частиц в узлах кристаллической
решетки и характера сил взаимодействия между ними
различаются 4 типа решёток
Примеры:
Ионные решётки
Атомные решётки
NaCl
алмаз, графит, германий, кремний
Металлические решётки
Молекулярные решётки
все металлы
органические вещества, лёд,
газы в твёрдом состоянии
52
53.
Физические типы решётокСвязь между атомами:
Ионные решётки
Атомные решётки
Частицы в узлах
кристаллической решётки:
Ионная (гетерополярная) Положительные и
отрицательные ионы
Ковалентная (гомеополярная) Нейтральные атомы
Металлические решётки
Молекулярные решётки
Металлическая связь
осуществляется с помощью Положительные
обобществлённых
ионы
валентных электронов
Ван-дер-Ваальсовские силы и
водородные связи
Молекулы
53
54.
Тепловое расширение твёрдых телПричина теплового расширения твёрдых тел – ангармоничность
колебаний частиц
Кривая зависимости потенциальной энергии взаимодействия
двух частиц от расстояния между ними несимметрична
С увеличением температуры и
полной энергии колебаний
среднее расстояние r между
частицами увеличивается
55.
Тепловое расширение твёрдых телЛинейные размеры тела при температуре t0 C равны:
l l0 1 t
Изменение длины при нагревании: l l l0 l0 t
l
l0 T
Коэффициент линейного теплового расширения α численно равен
относительному увеличению длины тела при нагревании на 10 С
1
1
K град
56.
Объём тела при температуре t0 C равен:V V0 1 t
Изменение объёма при нагревании: V V V0 V0 t
V
V0 T
1
1
K град
Коэффициент объёмного теплового расширения β численно равен
относительному увеличению объёма тела при нагревании на 10 С
Для аморфных тел и кристаллов с кубической решёткой:
3
57.
Теплоёмкость твёрдых телПо теореме о равнораспределении
E1
k T
2
Число колебательных степени свободы i=3
E1
k T k T
2
2
Кинетическая
энергия
Энергия одного атома (иона):
Потенциальная
энергия
Eатома i kT 3kT
Внутренняя энергия одного моля кристалла, состоящего из NА частиц
(химически простое тело):
U m N А Eатома N А 3kT 3RT
58.
Теплоёмкость твёрдых тел. Закон Дюлонга и ПтиU m 3RT
Молярная теплоёмкость:
dU m
CV
3R
dT
Молярная теплоёмкость всех химически простых тел одинакова, не
зависит от температуры и равна:
Дж
CV 3R 25
Это – закон Дюлонга и Пти:
моль К
Для химических соединений число частиц в одном моле вещества в z раз
больше (z – число атомов в молекуле)
Пример: в моле NaCl содержится NА атомов натрия и NА атомов хлора; z =2
CV 3Rz
59.
Теплоёмкость твёрдых тел. Закон Дюлонга и ПтиЭксперимент:
Классическая статистика не годится;
нужно использовать квантовые статистики


























































 Физика
Физика








