Похожие презентации:
Кремний. Получение кремния. Свойства кремния
1.
2. К р е м н и й
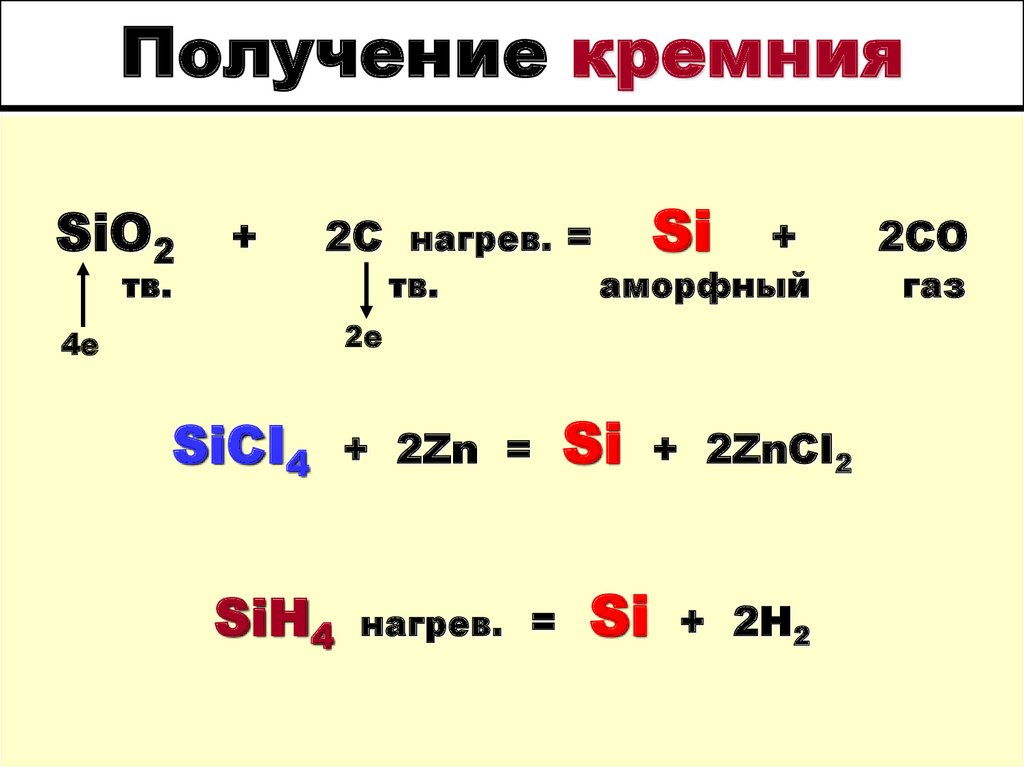
Кремний3. Получение кремния
SiO2+
2C нагрев. =
тв.
тв.
Si
+
аморфный
2е
4е
SiCI4
SiH4
+ 2Zn =
нагрев. =
Si
Si
+ 2ZnCI2
+ 2H2
2СО
газ
4. Свойства кремния
СвойстваSi
кремния
аморфный – инертный,
не реагирует с О2 ,
Si
Н2О , кислотами.
растворяется в щелочах :
Siаморфн. + 2NaOH + H2O = Na2SiO3
4е
+ 2H2
1е
Под действием кислот
Si пассивируется !
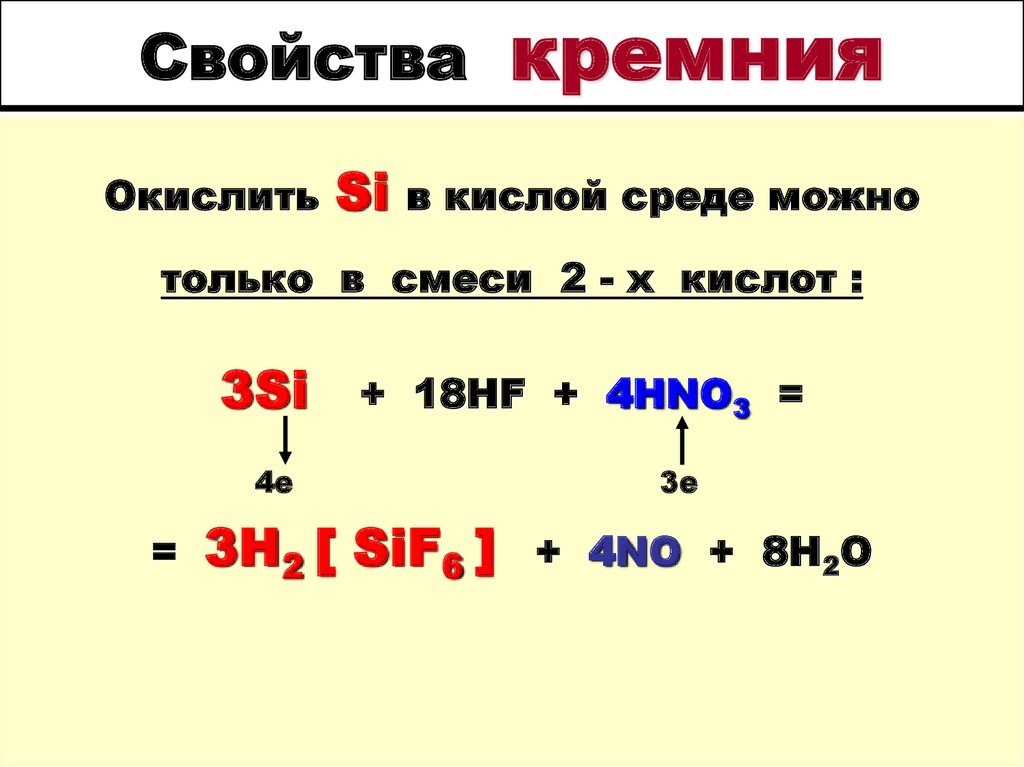
5. Свойства кремния
СвойстваОкислить
Si
кремния
в кислой среде можно
только в смеси 2 - х кислот :
3Si
+ 18HF + 4HNO3 =
4е
=
3H2 [ SiF6 ]
3е
+ 4NO + 8H2O
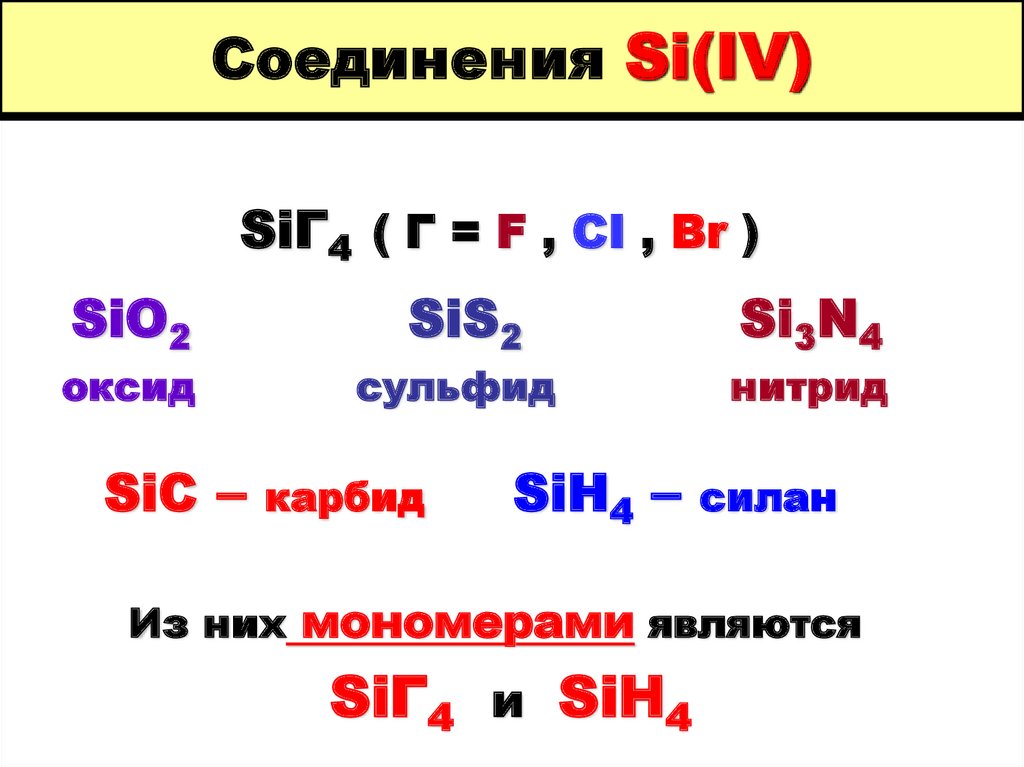
6. Соединения Si(IV)
SiГ4 ( Г = F , CI , Br )SiO2
оксид
SiC –
SiS2
сульфид
карбид
SiH4 –
Si3N4
нитрид
силан
Из них мономерами являются
SiГ4 и SiH4
7. Соединения Si(IV)
Большинство соединений кремнияявляются, как правило, полимерами :
(SiO2)n
SiC
и др.
Агрегатные состояния :
СО2 – газ
SiO2 – твердое
(SiO2)n - сетчатый полимер
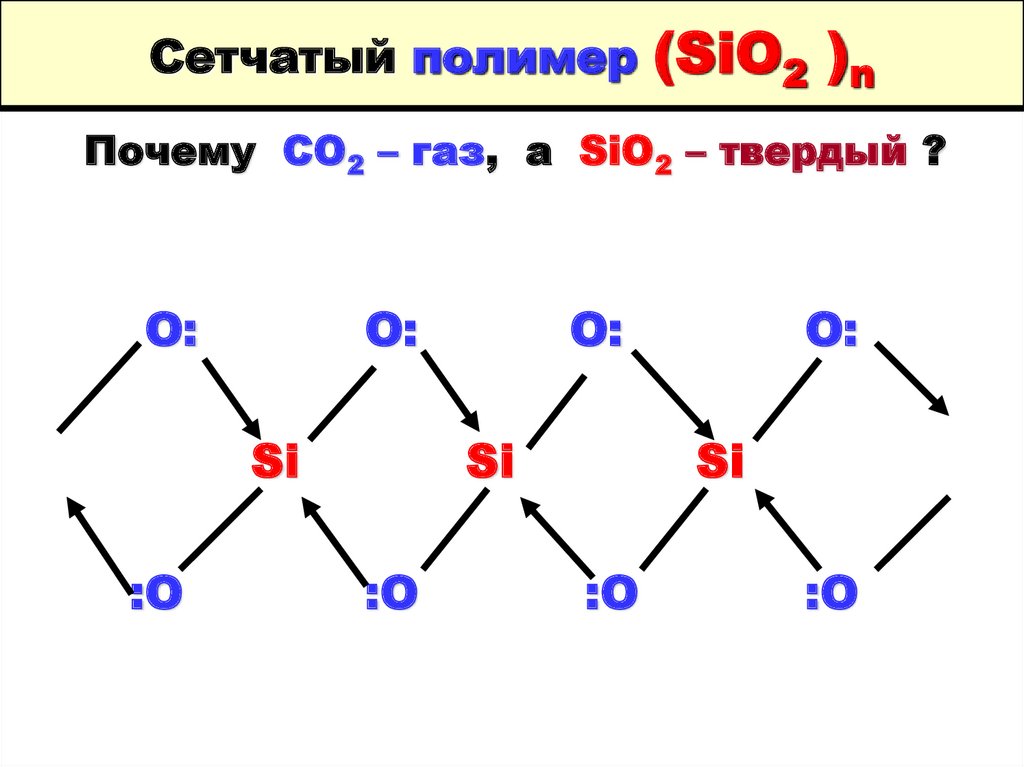
8. Сетчатый полимер (SiO2 )n
Почему СО2 – газ, а SiO2 – твердый ?О:
О:
Si
:O
О:
Si
:O
О:
Si
:O
:O
9. Кислотные свойства соединений Si(IV)
SiO2 + 2KOH = H2O + K2SiO3метасиликат
SiH4 + 2KOH + H2O = K2SiO3 + 4H2
SiS2 + CaS = CaSiS3 - тиосиликат
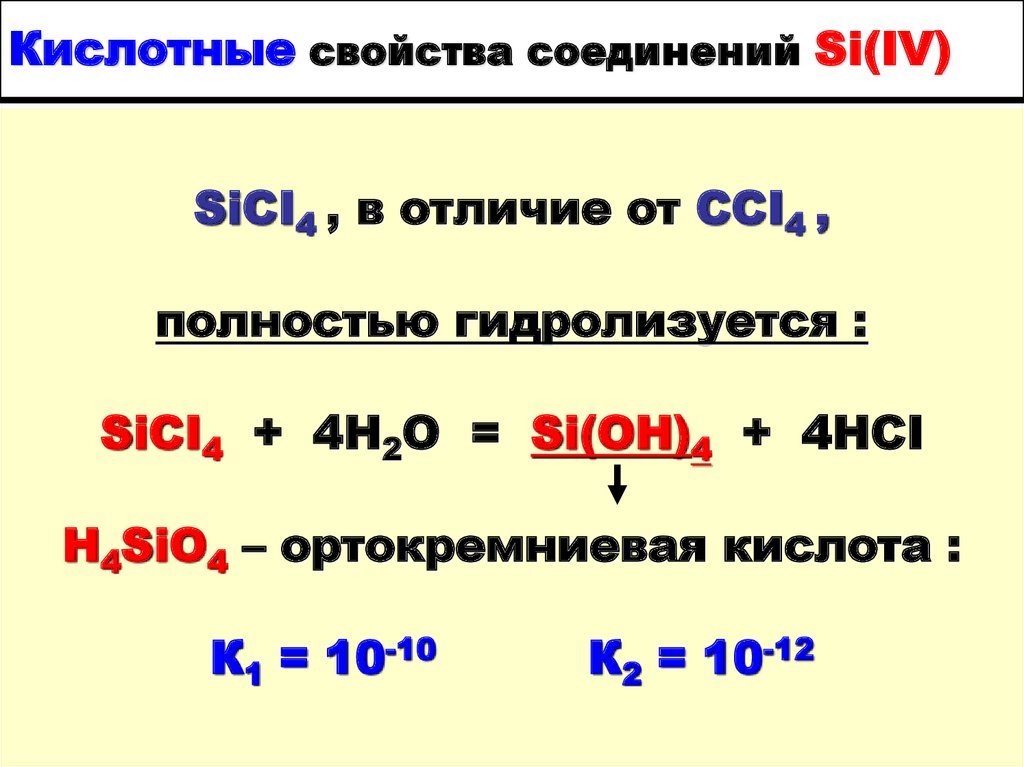
10. Кислотные свойства соединений Si(IV)
SiCI4 , в отличие от CCI4 ,полностью гидролизуется :
SiCI4 + 4H2O = Si(OH)4 + 4HCI
H4SiO4 – ортокремниевая кислота :
К1 = 10-10
К2 = 10-12
11. Кислотные свойства соединений Si(IV)
В водных растворах ортокремниевойкислоты протекают процессы
поликонденсации :
Si(OH)4 + (HO)4Si = H2O + H6Si2O7
12. Силикагель
При низких значениях рН образуютсякремниевые изополикислоты , мало
растворимые в Н2О
Состав осадка :
( H2SiO3 )n ( H2O )m
n , m – очень большие числа
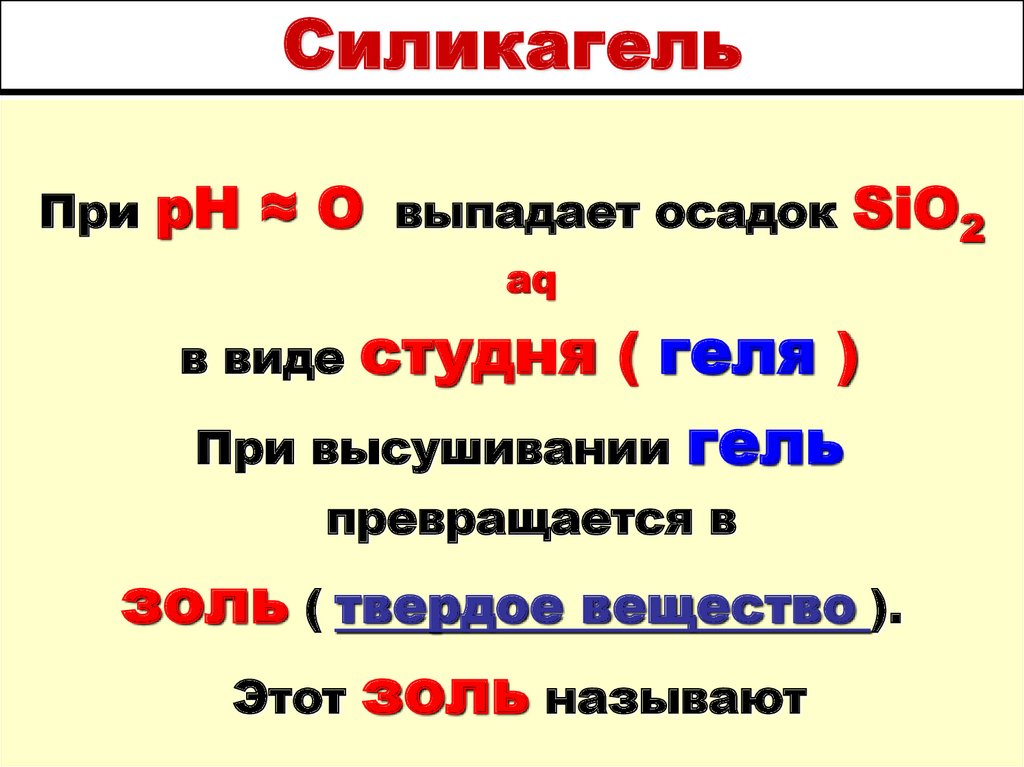
13. Силикагель
ПрирН ≈ О выпадает осадок SiO2
aq
студня ( геля )
При высушивании гель
в виде
превращается в
золь ( твердое вещество ).
Этот золь называют
14. Силикагель
Силикагельимеет
огромную поверхность,
формуется в гранулы и используется
в качестве
очень
эффективного адсорбента ! !
!
15. Галогениды Si(IV)
SiF4 – сильная кислота Льюиса :SiF4 + 2HF = H2SiF6 гексафторокремниевая кислота
H2SiF6 – кислота сильная ,
сравнимая с
H2SO4
16. Галогениды Si(IV)
H2SiF6- соединение легколетучее
Cоль
Na2SiF6
– гексафторосиликат натрия
17. Галогениды Si(IV)
SiHCI3SiCI4
используются в качестве
исходных веществ для синтеза
кремнийорганических соединений
18. Гидриды кремния (силаны)
Гомологический ряд :Силаны
Sin H2n+2
по свойствам похожи на
углеводороды , но менее разнообразны
по составу, функциональным группам,
классам и
менее устойчивые.
19. Гидриды кремния (силаны)
Снова отмечаембольшое сродство
Si к кислороду :
SiH4 + 2O2 = SiO2 + 2H2O
∆H = - 1288 кДж/м
Получение:
Mg2Si
+ 4HCI = 2MgCI2 +
силицид магния
SiH4
силан
20. Свойства кремнезема SiO2
SiO2SiO2
+ 2F2 =
+ 6HF =
+ 2NaOH =
SiO2
SiF4
H2SiF6
SiO2
+ O2
+ 2H2O
Na2SiO3
+ H2O
с водой не взаимодействует
21. Свойства кремнезема SiO2
Получение кремниевой кислоты :Na2SiO3 + 2HCI = H2SiO3 + 2NaCI
Образуется полимерная форма :
( H2SiO3 )n ( H2O )m
( гель , золь , силикагель )
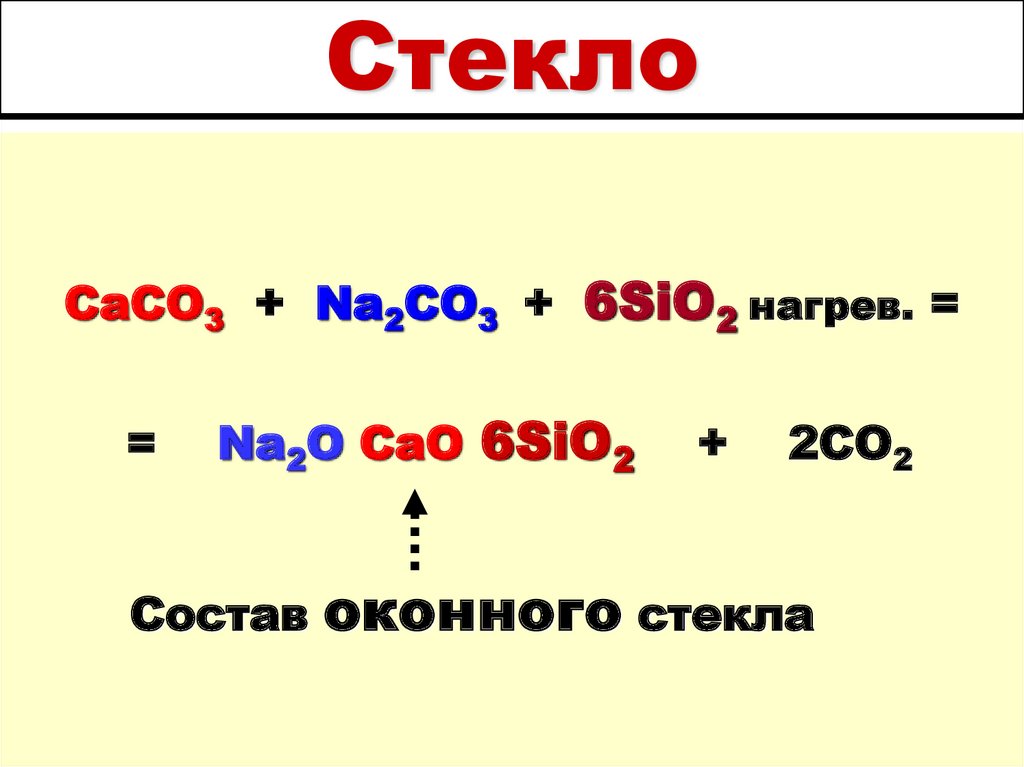
22. Стекло
CaCO3 + Na2CO3 + 6SiO2 нагрев. ==
Na2O CaO 6SiO2
Состав
+
2CO2
оконного стекла
23.
В жару недавно клокотало,Бросало брызги, замирало,
Текло тяжелою струей,
Вздувалось, в формах застывало
И под резцом ещё стонало
До той поры пока не стало
Застывшею симфонией стекла

















 Химия
Химия








