Похожие презентации:
Электродные процессы. Электроды. Потенциометрия
1.
Электродныепроцессы.
Электроды.
Потенциометрия.
2.
Электродный процессZn0 = Zn2+ + ne−
Zn
─
─
─
3.
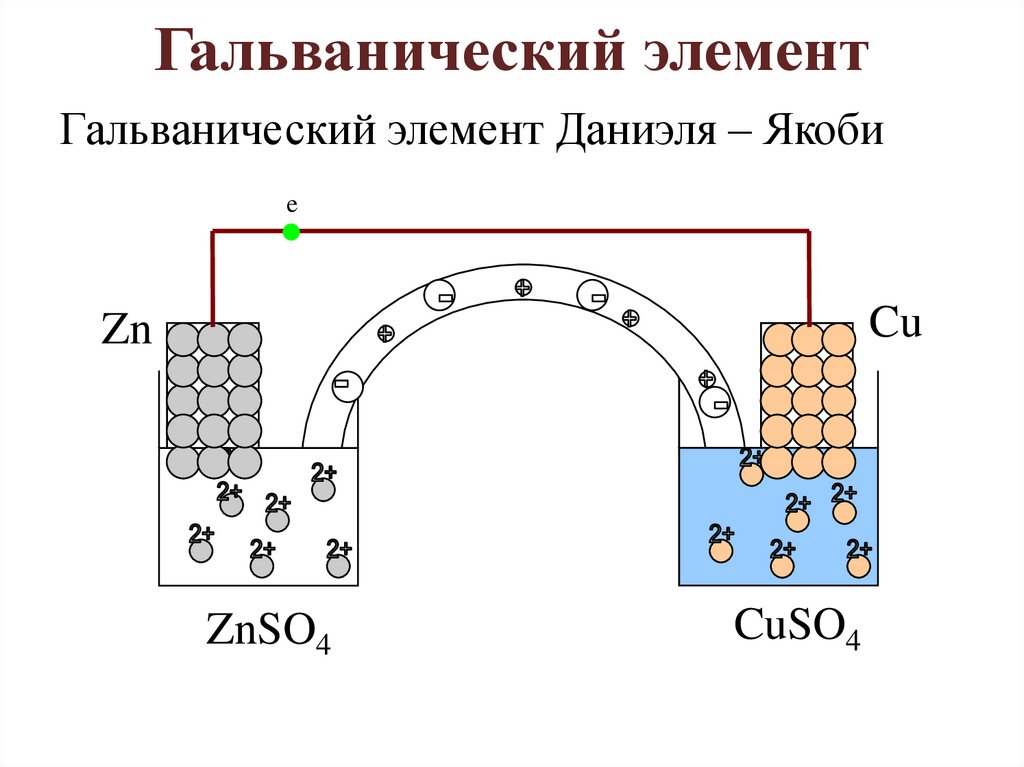
Гальванический элементГальванический элемент Даниэля – Якоби
e
Cu
Zn
ZnSO4
CuSO4
4.
• Zn│ZnSO4││CuSO4│Cu.Zn – 2ē → Zn2+ – анодное окисление;
Cu2+ + 2ē → Cu0 – катодное восстановление;
Zn + Cu2+ → Zn2+ + Cu0 – токообразующая
реакция.
• Работа гальванического элемента
E = Eкатода – Eанода
5.
Уравнение Нернста6.
Водородный электродСхема:
(Pt) H2 H+
Уравнение
электродной реакции:
H2 ⇄ 2Н+ + 2е– .
Уравнение Нернста:
ЕH
2
/ 2H
ЕH
2 / 2H
E 0 H 2 / 2 H 0,059 lg aH
0,059 pH
7.
Ряд напряжений металлов8.
Классификация электродов:1) По природе электродной реакции:
I рода
II рода
Окислительно-восстановительные (RedOx)
Ионоселективные (ионообменные)
2) По назначению:
индикаторные (электроды определения)
электроды сравнения
мембранные
9.
Электроды 1 родаM
• Обратимы относительно катиона
• Схема:
Меn+/ Mе0 (Ag, Zn, Cu, Cd)
• Электродный процесс:
Mez+ + zе– ⇄ Mе0
• Уравнение Нернста:
R T
Е E
ln aMez
z F
0
0,059
Е E
lg a Me z
z
0
2,3R T
0,059
F
Mn+
10.
Электроды II рода• Обратимы относительно аниона
• Схема:
Ме | МеAn | Anz─
• Электродный процесс:
МеAn + zе– ⇄ Ме + Anz─
• Уравнение Нернста:
EMe, MeAn / An z
EMe, MeAn / An z
RT
E
ln a An z
z F
0
2,3RT
E
lg a An z
z F
0
11.
Электроды II рода• Хлорсеребряный
12.
Электроды II рода• Хлорсеребряный электрод
• Схема: Аg|АgCl, KCl или Аg|АgCl, НCl.
• Электродный процесс:
АgCl + е– ⇄ Аg + Cl─
• Уравнение Нернста:
EMe, MeAn / An z
RT
E
ln a An z
z F
0
E Ag , AgCl / Cl 0,2224 0,059 lg aCl
13.
Электроды II рода• Каломельный
1 – металлический
контакт;
2 – слой Hg2Cl2;
3 – ртуть H;
4 – раствор КCl.
14.
Электроды II рода• Каломельный электрод
• Схема: Нg|Нg2Cl2, KCl
• Электродный процесс:
Нg2Cl2 + 2е– ⇄ 2Нg + Cl─
• Уравнение Нернста:
EHg ,Hg Cl
2
/
Cl
2
E 0 0,059 lg aCl
15.
ОВ электроды (RedOx)• Схема: Pt | Ох, Red
• Электродный процесс:
Ох + zе– ⇄ Red
• Уравнение Нернста:
EPt / Ox,Re d
0,059 aRed
E
lg
z
aOx
0
• Примеры: Pt | Fe3+, Fe2+
16.
ОВ электроды (RedOx)Пример: Pt | Fe3+, Fe2+
Электродный процесс:
Fe3+ + е– ⇄ Fe2+
Fe2+ ⇄ Fe3+ + е–
17.
ОВ электроды (RedOx)• Пример: Pt | MnO4─, Mn2+
• Электродный процесс:
MnO4─ +8Н+ +5ē ⇄ Mn2+ + 4Н2О
• Уравнение Нернста:
18.
Критерии самопроизвольногопротекания ОВ-реакций
• если ∆G < 0 и ∆Е > 0.
(-) К
(+) А
Со3+ + Fe2+ → Fe3+ + Со2+ :
∆Е = Eкатода – Eанода = +1,84 – 0,77 =1,07В
19.
ОВ электроды (RedOx)• Хингидронный электрод – потенциал
зависит от рН
• Схема: Pt | C6H4O2, HO-C6H4-OH, H+
• Электродный процесс:
C6H4O2 + 2H+ + zе– ⇄ HO-C6H4-OH
• Уравнение Нернста:
Е E 0,059 lg aH
0
Е E 0,059 pH
0
20.
Ионоселективные электродыа2(Хz+) = const
а1(Хz+)
Е2
Исследуемый раствор
Е1
Внутренний раствор
0,0592
a1 (X z )
0,0592
z
Е М Е1 Е 2
lg
lg
a
(
X
)
1
Е
z
0
z
a 2 (X )
z
21.
Ионоселективные электроды• Стеклянный электрод
• Схема: Ag ∣ AgCl,KCl ∣ стекло ∣ Н+ ∣ раствор
• Электродный процесс:
Na+(стекло) + Н+ (р-р) = Н+ (ст.) +Na+ (р-р)
• Уравнение Нернста:
0,0592
a1 (X z )
0,0592
z
Е М Е1 Е 2
lg
lg
a
(
X
)
1
Е
z
0
z
a 2 (X )
z
Е
Е
0
0,059 lg a H
Е
0
0,059 pH
22.
Потенциометрия• Сравнения (Хлорсеребряный)
• Индикаторный (Стеклянный)





















 Химия
Химия








