Похожие презентации:
Электроды. Потенциометрия, ионометрия
1. Электроды. Потенциометрия, ионометрия
Физическая и коллоидная химия2.
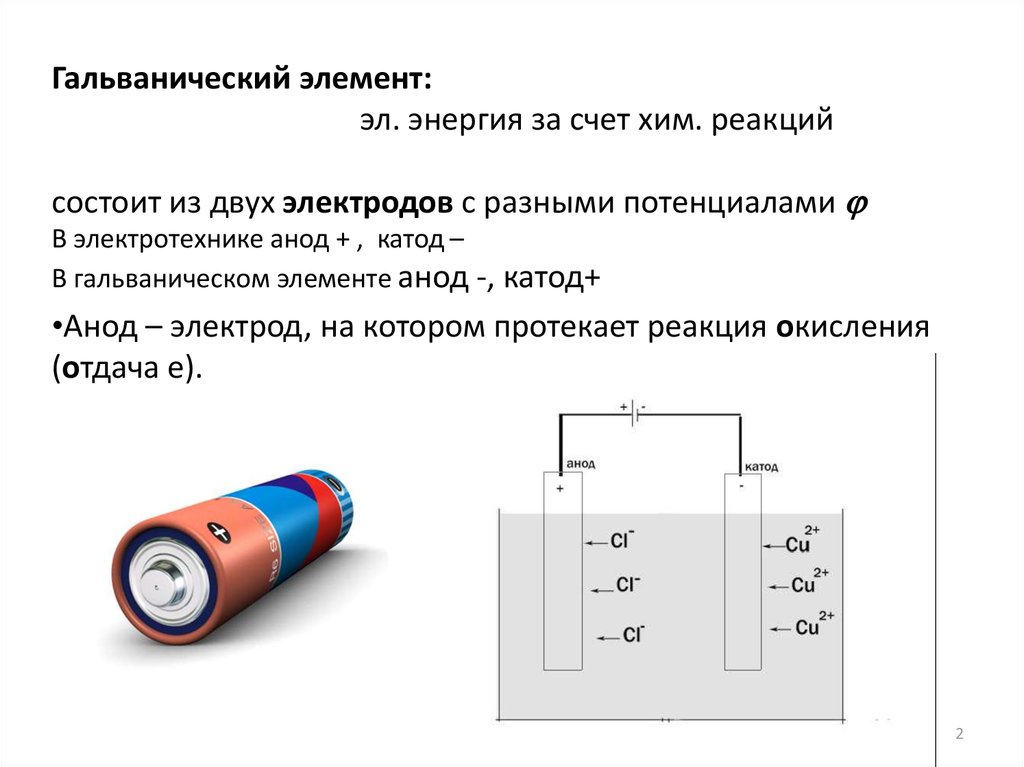
Гальванический элемент:эл. энергия за счет хим. реакций
состоит из двух электродов с разными потенциалами
В электротехнике анод + , катод –
В гальваническом элементе анод -, катод+
•Анод – электрод, на котором протекает реакция окисления
(отдача e).
2
3.
Электроды :• первого рода,
• второго рода
• окислительно-восстановительные
Электроды первого рода - зависит от концентрации только
одного иона (катиона или аниона).
Примеры – металлические электроды ( от С катионов металла),
водородный электрод (от С Н+)
3
4.
Механизм возникновения электродного потенциалаМеталлическая пластинка в растворе (металлический электрод).
М Мn+ + nē
ox-red равновесие, может быть смещено в ту или другую сторону.
( Zn в растворе ZnCl2):
Zn Zn2+ + 2е-
Cu Cu2+ + 2е-
Металл (-)
Металл(+)
( Cu в растворе CuCl2):
4
5.
Образование отрицательного заряда на электродеZn Zn2+ + 2е-
Zn
--
Zn2+
Zn2+
Zn2+
Zn2+
Zno ––> Zn2+ + 2еокисление анод –
Zno -2е- ––> Zn2+
Отдает e
--
Zn2+
Zn2+
Zn2+
5
6.
Образование положительного заряда на электродеCu Cu2+ + 2еCu
Равновесие
Cu2+ + 2е- = Cu
Cu2+
++
Восстановление
Катод +
Cu2+
++
6
7.
Основное уравнение потенциала электродаРеакция – запись всегда
«от окисленной формы к восстановленной».
в общем случае:
ox + nē red
металлический эл-д:
Мn+ + nē М
уравнение Нернста
0,059 a (ox )
lg
n
a ( red )
0
( M / M
0,059
lg a (M n )
n
0
n
)
в общем случае
для металлического
электрода
0 – стандартный электродный потенциал (в справочнике).
В растворах: при а= 1 моль/л.
В газах: при P= 1 атм, 25 °C.
.
7
8.
Дополнительный материал: Вывод уравнения НернстаЭлектрическая работа nF∆
совершается за счет
работы хим реакции (-∆G).
ур. изотермы
Gr Gr0 RT ln П P
nF∆ = – Gr
Gr
nF
Gr0 RT a( red )
ln
nF nF
a(ox )
Переходя от ln к lg (ln=2,3lg) и используя R= 8,31 , F= 94500, T= 298 К:
RT
a(ox)
ln
nF a(red )
0
a(ox)
0,059
lg
n
a(red )
0
8
9.
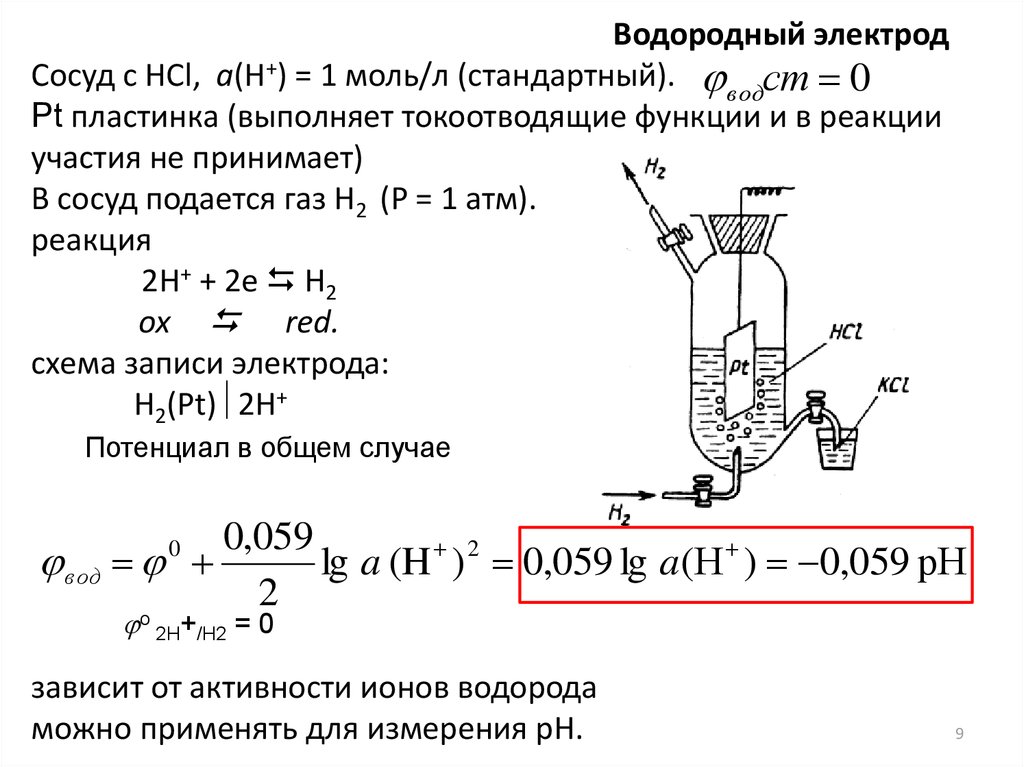
Водородный электродСосуд с HCl, а(Н+) = 1 моль/л (стандартный). водст 0
Pt пластинка (выполняет токоотводящие функции и в реакции
участия не принимает)
В сосуд подается газ Н2 (Р = 1 атм).
реакция
2H+ + 2e H2
ox red.
схема записи электрода:
H2(Pt) 2H+
Потенциал в общем случае
0,059
вод
lg a (H ) 2 0,059 lg a(Н ) 0,059 рН
2
o
0
2H+/H2
=0
зависит от активности ионов водорода
можно применять для измерения рН.
9
10.
Электроды второго рода обратимы к катионам и анионам,т.е. их потенциал зависит от концентрации двух ионов.
Металл, покрытый слоем труднорастворимой соли и
погруженный в раствор легкорастворимой соли с
одноименным анионом.
Схема записи: M MAn, Anхлоридсеребряный и каломельный электроды
10
11.
Хлоридсеребряный электрод: Ag AgCl, ClХС зависит от а (Ag+), которая зависит от а(Cl ) через ПРAgCl
Ag+ + e Ag
Ag+ + Cl AgCl
ПРAgCl=a(Ag+) a(Cl-)
0
,
059
a
(
Ag
)
хс Ag / Ag
lg
1
a( Ag )
ПР AgCl
0
Ag / Ag 0,059 lg
a(Cl )
0
0 Ag / Ag 0,059 lg ПР AgCl 0,059 lg a(Cl )
хс0 = 0,222 (В)
хс = oхс 0,059 lg а(Cl )
ХС насыщенный
В насыщ. растворе избыток твердого KCl гарантирует
постоянство концентрации Cl и хс нас сохраняется в течение
длительного времени – практическое использование
хс нас= 0,202 (В)
(стандартный электрод)
11
12.
Окислительно-восстановительными называют электроды,которых зависит от концентрации ox и red форм.
Состоят из Pt пластинки, погруженной в раствор, где
возможна ox - red реакция. Pt не принимает участия в
электродной реакции
Пример – хингидронный электрод.
12
13.
С6Н4(ОН)2 → С6Н4О2 + 2Н+ +Хингидронный электрод
Pt Х, ГХ, Н+
Электродная реакция Х + 2Н+ +2e= ГХ
O
OH
+ 2Н+ + 2е
O
OH
O
OH
O
+
OH
O
OH
хингидрон
гидрохинон
(диссоциирует)
ГХ
O
хинон
Х
OH
ox
Х,
red
Н+
хг хг
ГХ
0
концентрации Х и ГХ равны,
поэтому зависит только от рН
0,059 a( Х ) a( Н )2
0
lg
хг 0,059 lg a( Н )
2
a( ГХ )
0хг = 0,699 (В)
хг = 0,699 – 0,059 рН
13
14.
Гальванический элементНа примере элемента Даниэля – Якоби (медно-цинковый)
0
Zn /Zn Zn
/Zn
2
2
0,059
lg a (Zn 2 )
2
при С = 1 моль/л Zn /Zn
более отрицательный
2 ,
0,74 В
0
Cu /Cu Cu
/Cu
2
2
0,059
lg a (Cu 2 )
2
при С = 1 моль/л Cu /Cu2 0,34В
более положительный
анод –
Zno ––> Zn2+ + 2е-
катод +
Сu2+ + 2е - ––> Сuo
окисление
восстановление
Суммарный процесс (токообразующая реакция) :
Сu2+ + Zno ––> Сuo + Zn2+
14
15.
Разность потенциалов ∆ - «электродвижущая сила» (ЭДС) ,другое принятое обозначение Е.
Схема записи: слева - анод, справа – катод
от анода к катоду (от – к +)
(! стандартный водородный электрод всегда записывают слева).
Zn | Zn2+ || Cu2+ | Cu
катод +
0
0
катода
анода
анод
ЭДС :
0,059
0,059
0
2
lg a (Cu 2 )) ( Zn
lg
a
(Zn
))
2
/Zn
n
n
0,059 a (Cu2 )
0
Zn /Zn 2 )
lg
2
a ( Zn 2 )
0
( Cu
/С/ 2
0
( Cu
/Cu 2
15
16.
Химические и концентрационныегальванические элементы
Химические
Концентрационные
ГЭ состоит из двух
электродов различной
хим. природы:
медного и цинкового,
водородного и
хлоридсеребряного, и т.д.
ГЭ состоит из двух электродов
одинаковой хим. природы, но
концентрации растворов
у катода и анода различны.
.
Пример: медный конц. элемент
Сu|Cu2+ (a1) || Cu2+ (a2) |Cu,
анод
катод
a2 > a1
0,059 a2
lg
n
a1
16
17.
Рабочие электроды и электроды сравненияРабочий (или индикаторный, или электрод определения)
электрод выбирают в зависимости от того какие ионы надо
определять (должен быть обратим относительно этих ионов).
Для определения рН (концентрации H+ ) –
водородный и хингидронный электроды.
Электрод сравнения – потенциал которого известен и
постоянен в условиях эксперимента (хлоридсеребряный)
17
18.
ПотенциомерияПотенциомерия – метод определения активности ионов,
основанный на измерении рабочего электрода
(т.е.обратимого по отношению к определяемым ионам).
Необходимы рабочий электрод и электрод сравнения.
Пример: нужно определять рН :
– рабочий водородный электрод (обратим относительно H+ ) ,
– электрод сравнения - хлоридсеребряный насыщенный.
18
19.
Определение рН раствора(на примере ХС и водородного электродов)
1. Определить какой электрод – катод (более положительный)
хс нас = 0,202 В
катод
>
вод0 = 0
анод
катода > анода
2. Записать схему цепи (от анода к катоду)
- H (Pt)|H+ ||AgCl, KCl(нас.) | Ag +
2
3. Записать уравнение для ЭДС, раскрыть катода и анода
∆ = хс нас – вод = 0,202 – (–0,059 рН)
∆ (ЭДС) – измеряемая опытная величина !
4. Выразить искомую величину – С или рН
рН =
∆ – 0,202
0,059
19
20.
Определение рН раствора с помощью концентрационного ГЭ издвух хингидронных электродов
(пример: исследуемый р-р – моча рН > 2,
электрод сравнения ХГ с рН = 2 стандарт)
1. Определение катода: хг = 0,699 – 0,059 рН
Если рН больше - хг меньше
исследуемый раствор
раствор в электроде сравнения
pHx ( рН > 2) анод
рНстанд (рН = 2) катод
- Pt х, гх, Н+ Н+, х, гх Pt+
2. Схема
иссл станд
3. Уравнение Нернста
∆ =( 0,699 – 0,059рНстанд.)- (0,699 - 0,059pHx) =
= – 0,059рНстанд. +0,059pHx =0,059 (–рНстанд. +pHx )
4. Выразить рН
рН х
рН станд
0,059
рН х
2
0,059
наш пример
20
21.
МХастанд
(стандартный)
- -
M+
ИСМ
+ +
МХ
а1
исследуемый
Ионометрия
Ионометрия – измерение активности
ионов с использованием
ионоселективных электродов (ИСЭ).
мембр.
ИСЭ – электрод с относительно высокой
специфичностью к отдельному иону
или типу ионов.
В основе – ионоселективная мембрана
(ИСМ).
ИСМ проницаема для ионов М+
Переход ионов → разность потенциалов по обе стороны мембр
21
22.
Потенциал ИСМ определяется соотношением активностейиона в контактирующих растворах:
a1
2,3RT
мембр
lg
,
nF
aстанд
при Т=298 К
мембр const
0,059
lg a1
n
мембр const S lg a1
в идеале
на практике
S – крутизна электродной функции
(угловой коэффициент)
(+) для катионов ,
(–) для анионов.
22
23.
Устройство иономераV
2
ИСЭ
3
Электрод
сравнения
1
1 – ионоселективная мембрана
2 – стандартный раствор в ИСЭ
3 – исследуемый раствор
2,3RT
const
lg a М n
n F
0
0 const S lg a М n , ЭДС связана с активностью
определяемого иона Мn+
23
24.
Вид электродной функции для иона М+График строится на основании измерения ЭДС стандартных
растворов (с известными рМ -2, 3, 4, 5, 6, 7 и т.д. )
∆φ, В
1) определить «Нернстовскую область» – линейный участок;
2) определить угловой коэффициент наклона прямой – крутизну
электродной функции (S);
3) измерить ЭДС исследуемого раствора ∆φоп и по графику
определить его концентрацию pМопр
∆φ оп
6
4
pМопр
2
рМ
0
(например, рН, или рNa)
24
25.
Ионселективные электродыв зависимости от типа мембраны:
• твердофазные (с тв. мембраной, стеклянные),
• жидкофазные (ионактивное вещество – жидкость, Первичные
закрепленная в порах твердой матрицы).
• газовые и ферментные
25
26.
Стеклянные электродыМембрана из натриевого (SiO2-Na2O-CaO)
или литиевого (SiO2-Li2O-CaO) стекла.
Обладает катионообменными свойствами.
Ag, AgCl HCl стекл. мембрана Н+
(внутренний р-р, 0,1 М)
(внешний раствор)
Если ионы Na или Li (стекла) могут обмениваться c ионами H+
внутреннего и внешнего раствора:
H+(раствор) + Na+(стекло) H+(стекло) + Na+(раствор)
стеклянная мембрана является проницаемой для ионов Н+
- рН-селективная
Кроме рН чаще всего - Na-селективный электрод pNa
(особые сорта стекла)
26
27.
Стеклянные электродырабочий
электрод
электрод
сравнения
стандартный
раствор
ИСМ
27
28.
Твердофазные электродыМатериал мембран – LaF3,
AgCl, Ag2S, CuS, др.
Монокристаллические
Поликристаллические
Возможно определение ионов, входящих в состав
мембраны, а также ионов, способных взаимодействовать с
ее активными центрами.
Важнейшие твердофазные электроды –
pAg, pF, pCl, pS, pBr, pCN, pCu, pPb
Фторид-селективный электрод можно использовать для
определения F– до 10–7 М, не мешают избытки других ионов.
Применяют для определения pF в питьевой, морской и сточной
водах, при исследовании костей, зубов, мочи, слюны, зубных
28
паст и т.д.
29.
Электроды с жидкой мембранойОснову мембраны составляет несмешивающаяся с водой
жидкость – раствор активного компонента в пористой
диафрагме.
Активный компонент – ионообменные смолы (жидкие
катиониты или аниониты) или нейтральные молекулы –
комплексоны, способные к образованию хелатов.
Важнейшие жидкостные электроды – pK, pCa, pMg, pNO3
Для решения экологических проблем – электроды, селективные к
ПАВ (определение загрязнений моющими средствами) и к
ацетилхолину (определение загрязнений фосфорорганическими
ядохимикатами и карбаматами).
29
30.
Газовые электродыМембрана – полимерная пленка, проницаемая для газа.
разделяет исследуемый раствор от вспомогательного, куда
помещены ИСЭ электрод и электрод сравнения.
В основе действия – реакция с участием воды, в результате
которой изменяется характер среды:
CO2 + H2O H+ + HCO3
NH3 + H2O OH + NH4+.
Газовые электроды: pCO2, pNH3, pH2S
30
31.
Ферментные электродыДля определения концентрации участников ферментативной
реакции.
Глюкоза + О2
глюкозооксидаза Глюконовая кислота + Н О
2 2
Для определения содержания глюкозы используют ферментный
электрод с глюкозооксидазой (биоселектор).
Контроль – по изменению концентрации глюконовой кислоты
(с помощью стеклянного электрода рН)
Мочевина + Н2О
уреаза
NH3 + CO2
используют ферментный электрод с уразой. Контроль – по
изменению NH3 (с помощью стеклянного электрода pNH4 или
газового аммачного pNH3
У ферментных электродов короткий срок жизни
31
32.
Применение ионометрии в медицинеКонтроль (в том числе автоматический)
• биологически активной концентрации ионов и молекул
биосред (H+, K+, Na+, Ca2+, HPO42-, глюкоза, мочевина и др.);
• состояния воздуха (СО, СО2, NO, NO2, SO2, H2S и др.);
• состояния природных вод (H+, Ca2+, Mg2+, Hg2+, Pb2+, NH4+, S2-,
HPO42-, NO3-, остатки пестицидов, гербицидов и др.)
32






























 Химия
Химия








