Похожие презентации:
Химическая кинетика. Лекция 2
1. Лекция 2. Химическая кинетика
2. Химическая кинетика изучает:
• Механизм процесса (характер ипоследовательность элементарных актов)
• Закономерности его протекания
• Зависимость скорости процесса от
различных факторов
• Возможность регулирования скорости
процесса
3. Классификация реакций
• простые реакции - осуществляются посредствомоднотипных элементарных актов
• Элементарный акт – превращение исходных
веществ или промежуточных частиц в
продукты(при этом изменяется химическое
строение частиц)
• сложные реакции осуществляются посредством
разнотипных элементарных актов
(последовательных, параллельных, цепных,
сопряженных и т.д.)
• лимитирующая стадия реакции – элементарный
акт, определяющий скорость реакции в целом.
4. Механизмы сложных реакций
а) Последовательные реакции - протекаютнесколько процессов с участием одних и тех
же исходных веществ. Идут через ряд стадий
с образованием промежуточных веществ –
интермедиатов. Для последовательных
реакций лимитирующей реакцией является
самая медленная стадия; Простейший случай
две стадии
• k1
k2
А В Р
5. Механизмы сложных реакций
б) Параллельные реакции – образованиеконечного продукта из исходных веществ
через ряд промежуточных продуктов.
• Для параллельных реакций лимитирующей
является самая быстрая стадия
в)Цепные реакции протекают с участием
свободных радикалов.
г) Сопряженные реакции.
6. Механизмы реакций
• Гомогенные реакции – протекают впределах одной фазы.
• Гетерогенные реакции – на границе
раздела фаз.
7. Молекулярность химической реакции – число частиц в единичном столкновении реакции
МОНОМОЛЕКУЛЯРНЫЕJ2 ↔ 2J
CaCO3 → CaO + CO2
БИМОЛЕКУЛЯРНЫЕ
• H2 + J2 ↔ 2HJ
ТРИМОЛЕКУЛЯРНЫЕ
H2 + 2NO → N2O + H2O
•?
• 4NH3 + 5O2 → 4NO + 6H2O
8. Скорость реакции (Vr)
• Скорость реакции (Vr) – число химическихвзаимодействий, приводящих к образованию
продукта в единицу времени (τ) в единице
объема (для гомогенных реакций)
• или на единице площади поверхности (для
гетерогенных реакций).
• Измеряется скорость реакции изменением
концентраций исходных веществ или продуктов.
9. Зависимость скорости реакции от концентрации реагирующих веществ
• Средняя скорость реакцииC
Vr
• Истинная скорость реакции
C
dC
Vr lim
d
0
10. Изменение концентрации реагирующего вещества во времени.
cv
tg
t
11. Скорость реакции
• зависит от факторов:• природы реагирующих веществ;
• ПРИРОДЫ РАСТВОРИТЕЛЯ
концентрации реагирующих веществ;
температуры;
наличия катализатора;
величины поверхности раздела фаз (для
гетерогенных реакций);
12. Порядок реакции
- величина, равная сумме показателей степениконцентраций реагентов в кинетическом уравнении.
-
aА + bВ → dD
v = −dc(А) /dτ = −dc(В) /dτ
= k·c(A)p·c(B)q
c(A), c(B) – концентрации реагентов, моль/л;
k – константа скорости реакции, равная скорости при
концентрациях реагирующих веществ 1 моль/л;
p – порядок реакции по реагенту А;
q – порядок реакции по реагенту В.
13. −dc /dτ = k·cn
−dc /dτ =Vr
n
k·c
n=0
0<n<1
n=1
n>1
C
14. Кинетические уравнения
• N2O4 = 2NO2 – мономолекулярная• В мономолекулярной реакци A + В продукты
• v = k c(A)
• H2 + I2 = 2HI – простая бимолекулярная
В бимолекулярной реакци 2A продукты
• v = k c2(A)
• 2NO + Cl2 = 2NOCl – простая тримолекулярная
• В тримолекулярной реакци 2A + В продукты
• v = k c2(A) c(В)
15. Период полупревращения
• - время, за которое в реакцию вступает половинаисходного вещества.
• Для радионуклидов аналогичная величина называется
периодом полураспада.
16. Дифференциальные и интегральные уравнения для реакций различного порядка
Дифференциальное Интегральноекинетическое
уравнение
уравнение
Период
полупревращени
я
(τ0,5)
n
−dc /dτ = k·c
1
2
0
lnco/cτ = k·τ
τ0,5= ln2/k
−dc /dτ =k·c2 1/cτ−1/co = k·τ
τ0,5=1/k·co
−dc /dτ = k co − cτ = k·τ
τ0,5= co/2k
17. Зависимость скорости реакции от температуры
правило Вант-ГоффаT1
T2
k1
10
=
k2
γ – температурный коэффициент
скорости реакции
18. Распределение частиц по энергии для температур Т1 и Т2 (Т2>T1); N/No – доля частиц с энергией Е.
Распределение частиц по энергии длятемператур Т1 и Т2 (Т2>T1); N/No – доля
частиц с энергией Е.
19. Теория активных соударений
• -столкновение частиц• - достаточный запас энергии
• - определенная ориентация частиц
20. Уравнение Аррениуса
-Eak=Ae
RT
А – предэкспоненциальный множитель, A = p·Z;
p – стерический фактор, показывающий вероятность
столкновений в направлении, которое благоприятно для
перераспределения связей, особенно этот фактор важен для
больших разветвленных молекул органической природы
(0<p<1), в остальных случаях р→1;
Z – частотный фактор, пропорциональный общему числу
соударений
21. Энергия активации
• минимальная избыточная энергия, посравнению со средней энергией частиц,
необходимая для протекания реакции,
называется энергия активации
(обозначается Еа; выражается в
кДж/моль).
22. Ориентация частиц (стерический фактор)
1. RCOOH + ROH↔
2. RCOOH + HOR ↔
3. HOOR + ROH ↔
4. HOOR + HOR ↔
23. уравнение Аррениуса для двух температур:
k2 Ea (T2 T1)ln =
k1
RT1T2
24. Расчет энергии активации
Ea =k2
RT1T2 ln k
1
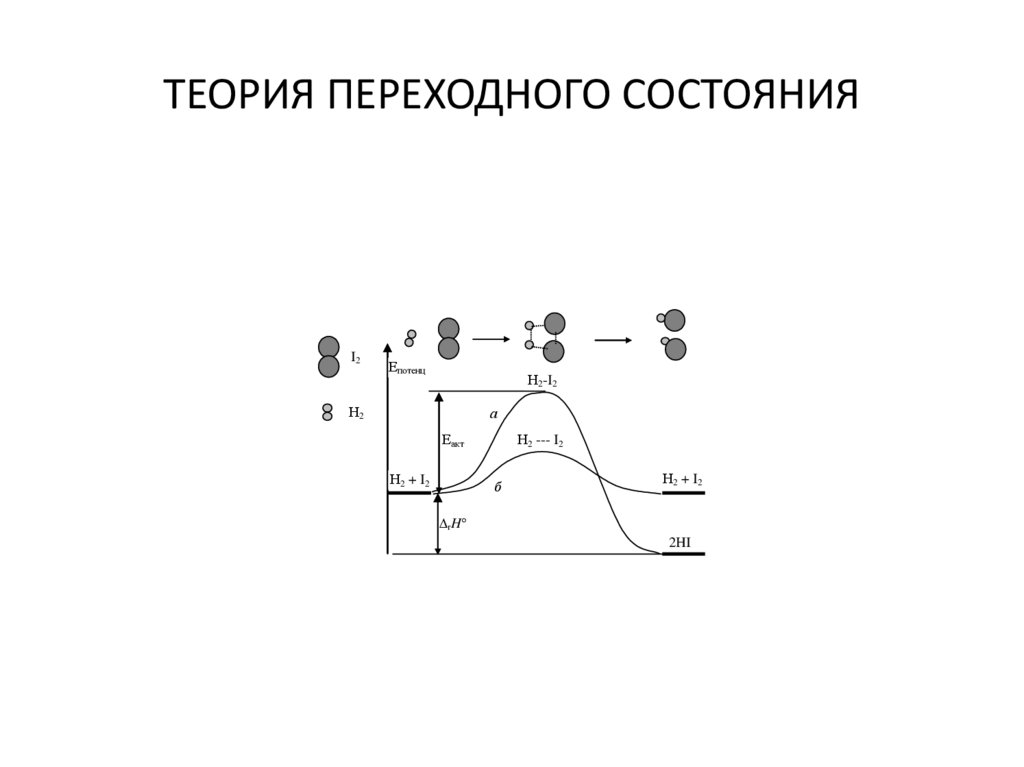
25. ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ
I2Епотенц
Н2-I2
Н2
а
Еакт
Н2 + I 2
Н2 --- I2
б
Н2 + I 2
rH
2HI
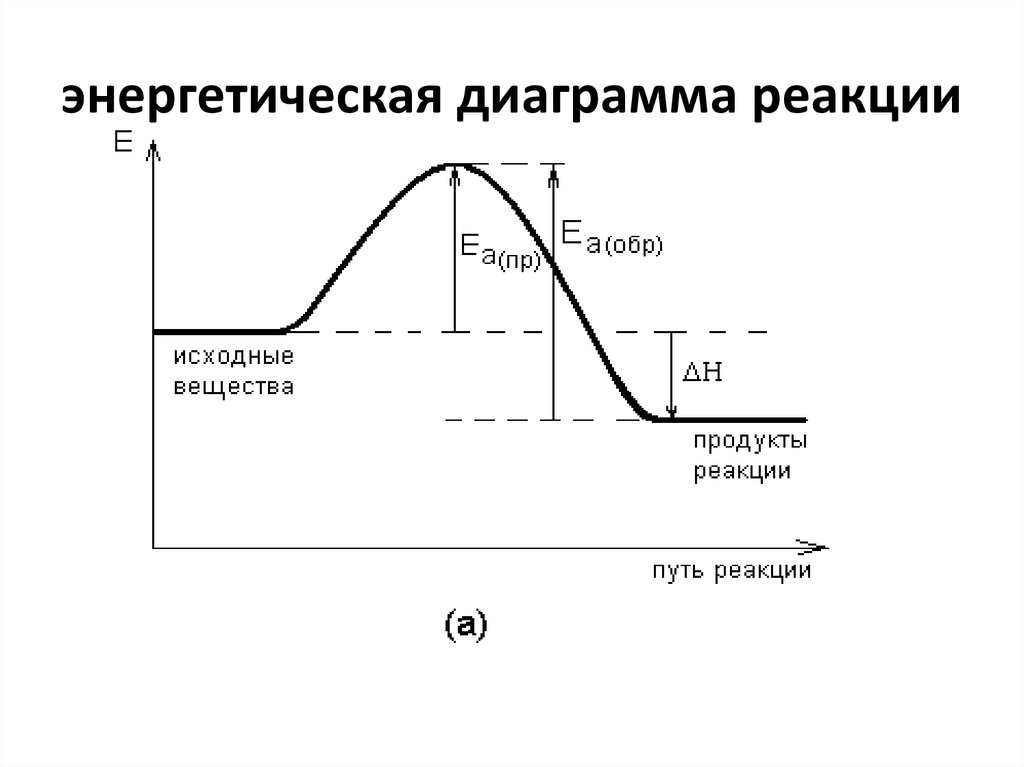
26. энергетическая диаграмма реакции
27. Катализ
• Катализ – селективное ускорение химическихреакций в присутствие веществ(катализаторов),
которые принимают участие в промежуточных
процессах, но регенерируются в конце реакции..
В зависимости от фазового состояния
реагирующих веществ и катализатора различают
два вида катализа – гомогенный и гетерогенный.
28. Механизм действия катализатора A+B D
BA +B+K A K +B A K +B A K
интермедиат
D+ K
29. Энергетическая диаграмма процесса без катализатора (1) и с катализатором (2)
Е[А…В]
в
Еа
А…К
Еа2
[А..К]+В
А+В
А+В+К
Еа1
Н
АК+В
С
С+К
КООРДИНАТА РЕАКЦИИ
30. механизм ферментного катализа Учебник, стр419
ES, фермент-субстратный комплекс31. уравнение Михаэлиса — Ментен
V = VмаксcS
c S + Kм
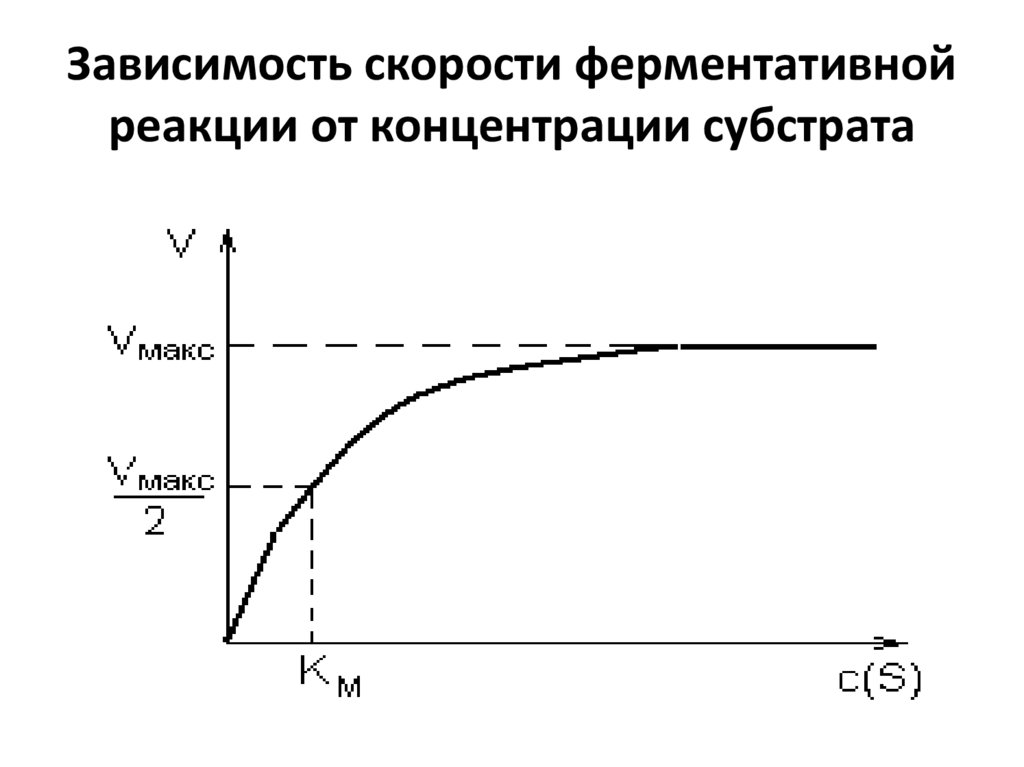
32. Зависимость скорости ферментативной реакции от концентрации субстрата
33. Анализ уравнения
1) с(S)<<КмVмакс
V =
Kм
cS
2) с(S) >>КМ
V = Vмакс
3) c(S)=Км
V=Vmax/2





























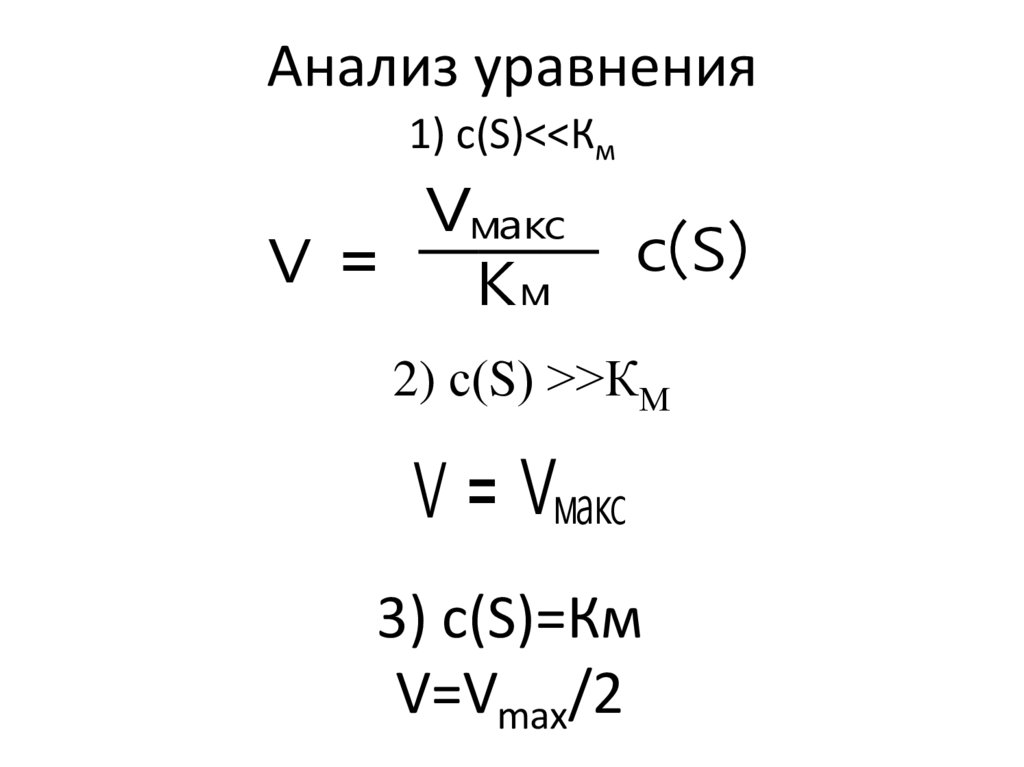
 Химия
Химия








