Похожие презентации:
Получение, свойства и применение алкенов
1. Задание на повторение:
а) H2C = CH – CH - CH2 - CH3б)
CH3
3 – метилпентен – 1
в) H2C = CH – CH - CH2 – CH2 - CH3
CH3
3 – метилгексен – 1
H3C - CH = C - CH2 - CH3
CH3
3 – метилпентен – 4
г)
H3C – CH2 – CH – CH2 - CH3
CH3
3 - метилпентан
2. «Получение, свойства и применение алкенов»
Тема урока:«Получение, свойства и
применение алкенов»
3. Цель урока:
рассмотреть различные способы полученияалкенов, их физические и химические
свойства и применение через работу с
различными источниками информации.
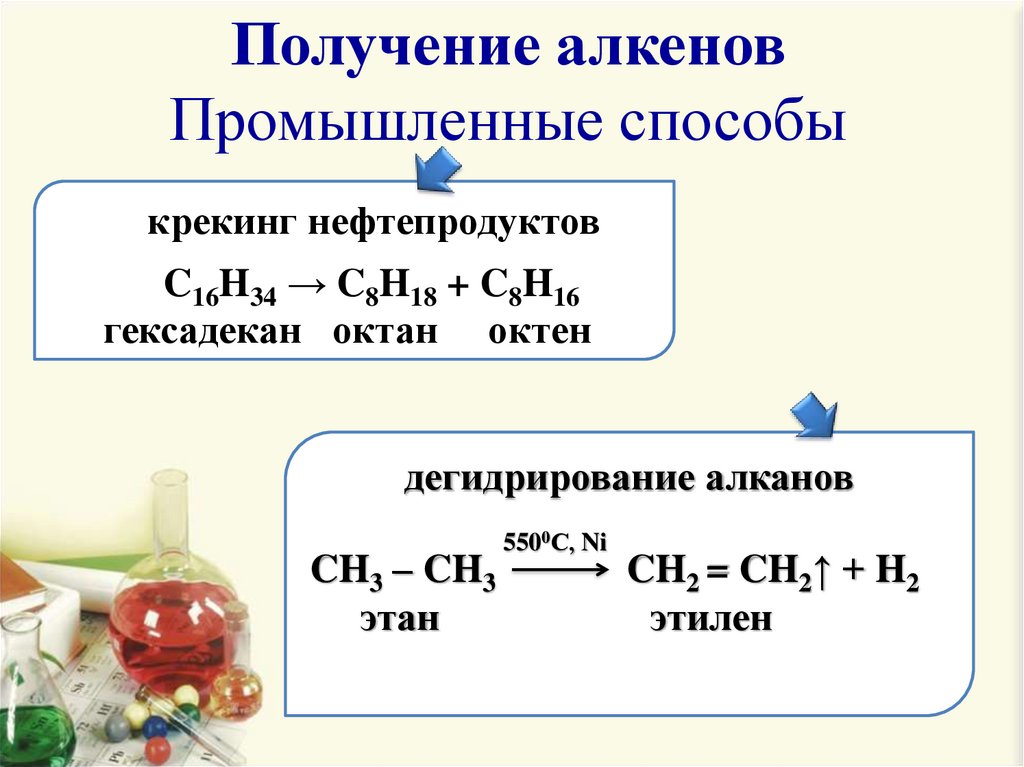
4. Получение алкенов Промышленные способы
крекинг нефтепродуктовC16H34 → C8H18 + C8H16
гексадекан октан октен
дегидрирование алканов
CH3 – CH3
этан
5500С, Ni
CH2 = CH2↑ + H2
этилен
5. Получение алкенов Лабораторные способы
дегидратация спиртовC2H5OH
t > 1400С, H2SO4(конц)
CH2 = CH2↑ + H2O
дегалогенирование дигалогеналканов
CH3 – CHBr – CHBr – CH3 + Zn → CH3 – CH = CH – CH3 + ZnBr2
2,3 – дибромбутан
бутен - 2
дегидрогалогенирование галогеналканов
CH3 – CHBr – CH2 – CH3 + NaOH
2 – бромбутан
спирт, t
CH3 – CH = CH – CH3 + NaBr + H2O
бутен - 2
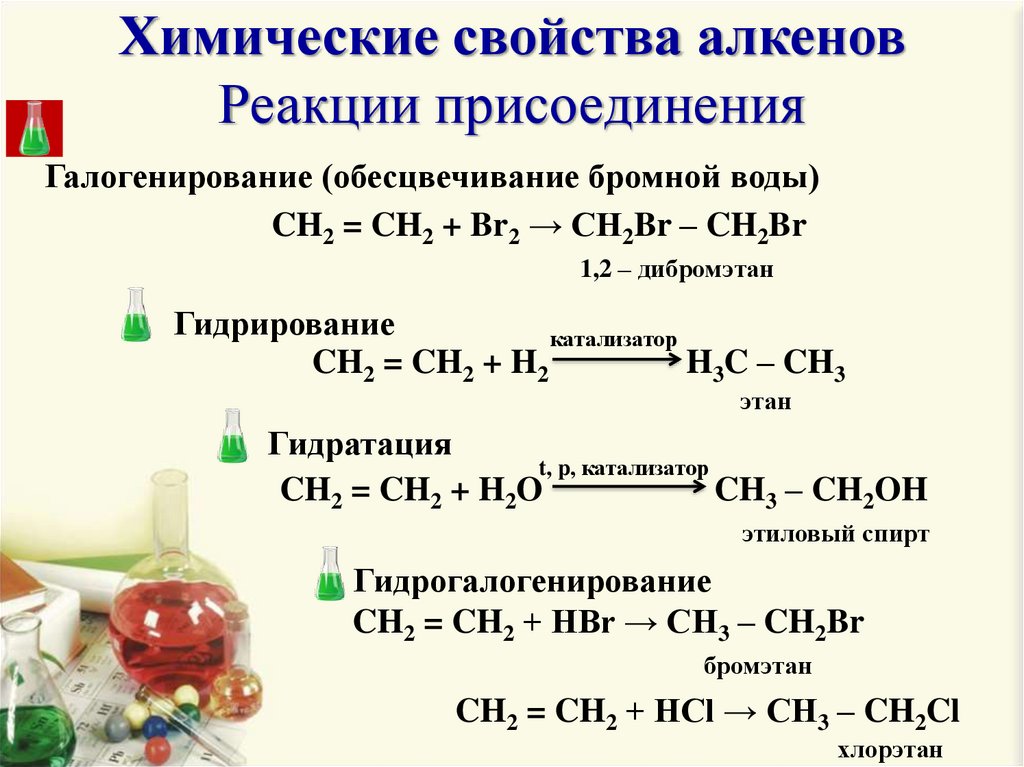
6. Химические свойства алкенов Реакции присоединения
Галогенирование (обесцвечивание бромной воды)CH2 = CH2 + Br2 → CH2Br – CH2Br
1,2 – дибромэтан
Гидрирование
катализатор
CH2 = CH2 + H2
H3C – CH3
этан
Гидратация
t, p, катализатор
CH2 = CH2 + H2O
CH3 – CH2OH
этиловый спирт
Гидрогалогенирование
CH2 = CH2 + HBr → CH3 – CH2Br
бромэтан
CH2 = CH2 + HCl → CH3 – CH2Cl
хлорэтан
7.
Химические свойства алкеновРеакции окисления
Горение на воздухе
CH2 = CH2 + 3O2 → 2CO2 + 2H2O
Мягкое окисление (обесцвечивание раствора KMnO4)
CH2 = CH2 + [O] + H2O → HO – CH2 – CH2 – OH
этиленгликоль
Частичное окисление этилена кислородом воздуха
2CH2 = CH2 + O2 → 2CH2 – CH2
O
оксид этилена
8.
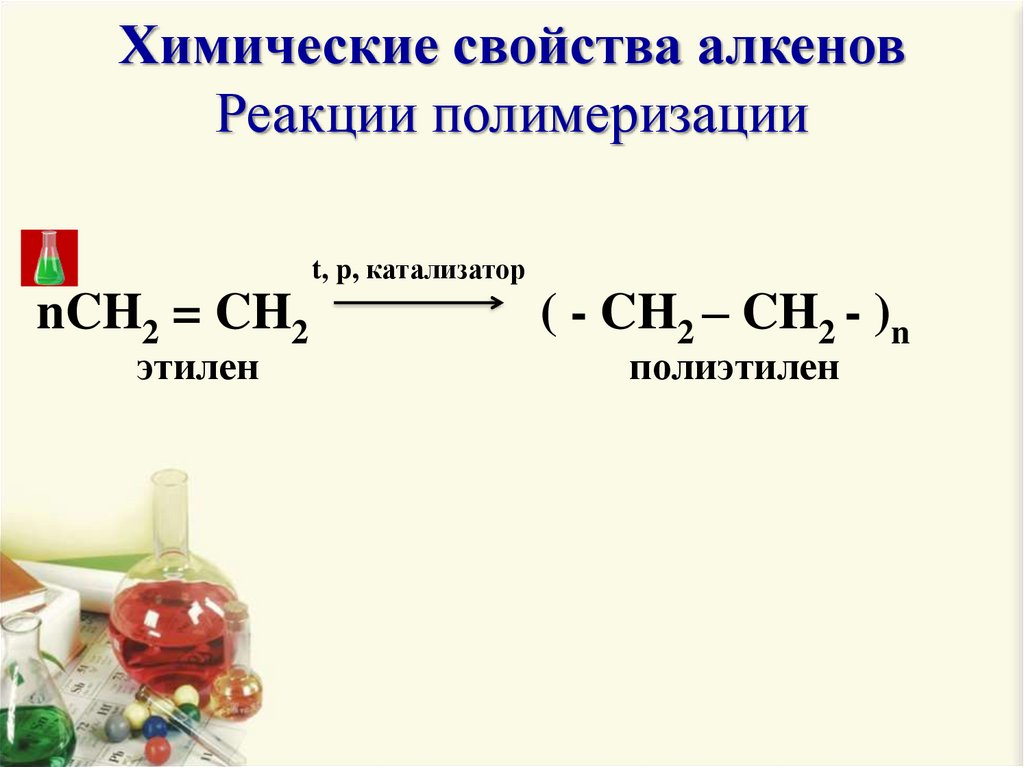
Химические свойства алкеновРеакции полимеризации
t, p, катализатор
nCH2 = CH2
этилен
( - CH2 – CH2 - )n
полиэтилен
9.
Физические свойства алкеновЭтилен
– бесцветный газ, почти без запаха, немного легче воздуха,
плохо растворим в воде, растворим в спирте и диэтиловом эфире
Формула - название
t кип., 0С
C2H4 – этилен
-103,8
C3H6 - пропилен
-47,7
Агрегатное
состояние
газы
-6,3 (бутен-1)
C4H8 - бутен
C5H10 - пентен
+30,1 (пентен-1)
C6H12 - гексен
+63,5
C7H14 - гептен
+93,6
жидкие
C18H36 - октадецен
C19H38 - нонадецен
твердые
При увеличении молекулярной массы соединений
закономерно повышаются температуры кипения и
плавления
10. Применение алкенов
Этилен: исходное веществодля производства этанола,
этиленгликоля, эпоксидов,
дихлорэтана, полиэтилена
(упаковочная пленка, посуда,
трубы, электроизоляционные
материалы).
н.
Пропилен: глицерин,
ацетон, изопропанол,
растворители,
полипропилен.
11. Задание на закрепление
И для этана, и для этилена характерны:1. реакции хлорирования;
2. sp3 – гибридизация атомов углерода в
молекуле;
3. наличие π-связи в молекулах;
4. реакции гидратации;
5. горение на воздухе;
6. взаимодействие с раствором KMnO4;
7. малая растворимость в воде;
8. газообразное состояние.
Ответы:
1, 5, 7, 8
12. Цель урока:
рассмотреть различные способы полученияалкенов, их физические и химические
свойства и применение через работу с
различными источниками информации.
13. Оцени себя на уроке
Я на уроке:Работал
Отдыхал
Помогал
другим
14.
Спасибоза
урок!











 Химия
Химия








