Похожие презентации:
Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение
1.
СТРОЕНИЕ,ИЗОМЕРИЯ,ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ
СВОЙСТВА АЛКЕНОВ.
СПОСОБЫ ПОЛУЧЕНИЯ
АЛКЕНОВ.ПРИМЕНЕНИЕ.
2.
ГОМОЛОГИЧЕСКИЙ РЯДАЛКЕНОВ
АЛКЕНЫ
СnH2n
Молекулярная Название Тривиальное
формула
C2H4
Этен
Этилен
C3H6
Пропен
Пропилен
C4H8
Бутен
Бутилен
С5H10
Пентен
Пентилен
3.
СТРОЕНИЕ АЛКЕНОВПризнаки
АЛКЕНЫ
Тип гибридизации
sp2 гибридизация
Валентный угол
1200
Форма молекулы
плоский
треугольник
Длина связи
0,134нм
4.
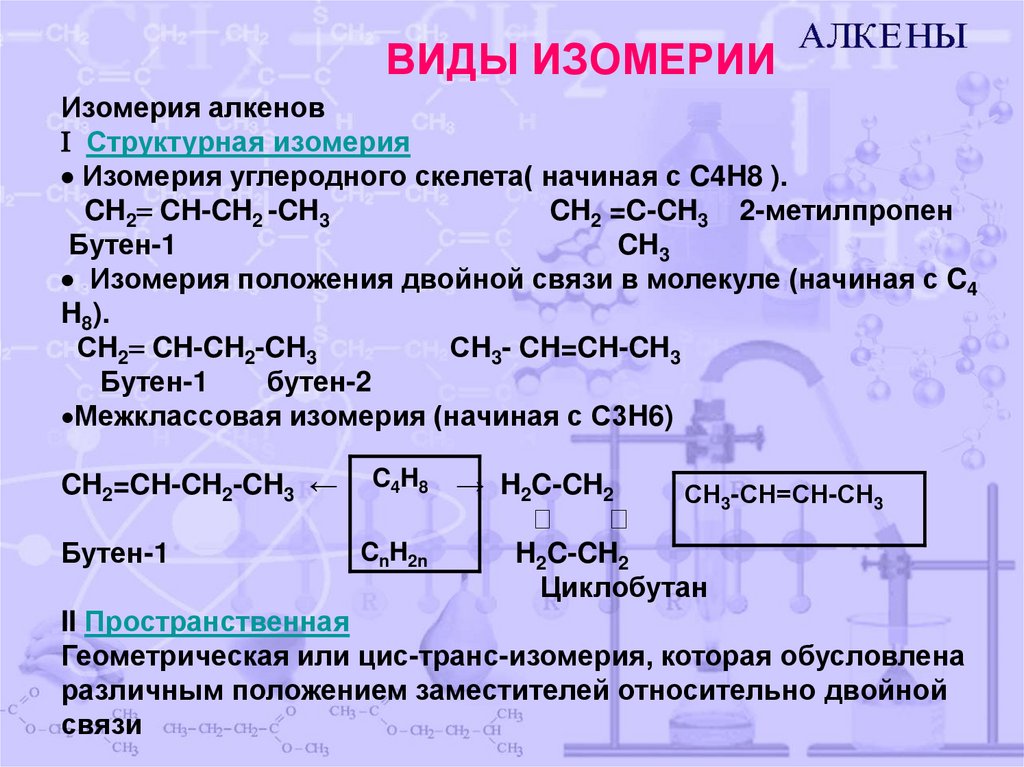
ВИДЫ ИЗОМЕРИИИзомерия алкенов
Структурная изомерия
Изомерия углеродного скелета( начиная с C4H8 ).
CH2 CH-CH2 -CH3
CH2 =C-CH3 2-метилпропен
Бутен-1
CH3
Изомерия положения двойной связи в молекуле (начиная с C4
H8).
СH2 CH-CH2-CH3
СH3- CH=CH-CH3
Бутен-1
бутен-2
Межклассовая изомерия (начиная с С3H6)
CH2=CH-CH2-CH3 ←
C4H8
Бутен-1
CnH2n
→ H2C-CH2
СН3-СН=СН-СН3
H2C-CH2
Циклобутан
II Пространственная
Геометрическая или цис-транс-изомерия, которая обусловлена
различным положением заместителей относительно двойной
связи
5.
Физические свойства алкеновАлкены имеют молекулярную
кристаллическую решетку
С1 -С4- бесцветные газы
С5-С17-бесцветные жидкости
С18-твердые вещества
6.
ХИМИЧЕСКИЕ СВОЙСТВААЛКЕНОВ
1. Галогенирование
CH2 – CH2
CH2 = CH2 + Br2
Br
Br
1, 2 – дибромэтан
2. Гидрирование протекает при умеренном
нагревании, повышенном давлении и в присутствии
металлических катализаторов (Pt, Pd или Ni)
H2C = CH2 + H2
p, t, Ni
H3C – CH3
7.
ХИМИЧЕСКИЕ СВОЙСТВААЛКЕНОВ
3. Гидрогалогенирование
H2 С = CH2 + НBr
CH3 – CH2Br
этен
бромэтан
Правило Марковникова:
Атом водорода присоединяется к более
гидрированному, а атом галогена – к менее
гидрированному атому углерода при двойной связи.
4. Гидратация
CH2 = CH2 + Н – ОН t, H2SO4 СН3 – СН2ОН
этиловый спирт
5. Реакция полимеризации
nCH2 = CH2 t, p, кат.
( – CH2 – CH2 – )n
8.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ6. Горение
C2H4 +3O2
2CO2 + 2H2O
Этилен с кислородом образует взрывоопасную смесь.
7. Реакция окисления
3СН2 = СН2 + 2KMnO4 + 4H2O 3CH2 – CH2 + 2KOH + 2MnO2
OH
OH
9.
ПОЛУЧЕНИЕ АЛКЕНОВ1)Крекинг нефтепродуктов.
C16H34 C8H18+C8H16
гексадекан октан
октен
2)Дегидрирование предельных углеводов.
CH2=CH-CH2-CH3+H2
бутен-1
CH3-CH=CH-CH3+H2
бутен-2
CH3-CH2-CH2-CH3
3)Дегидратация спиртов (отщепление воды).
H2SO4, 170-180 C
CH3-CH2-OH
CH2=CH2+H2O
4)Дегидрогалогенирование(отщепление
галогеноводорода).
Br
спирт
CH3-CH-CH2-CH3+NaOH
CH3-CH=CH-СН3+NaBr+H2O
2-БРОМБУТАН
бутен-2
5)Дегалогенирование.
Br Br
CH3-CH-CH-CH3+Zn
CH3-CH=CH-CH3+ZnBr2
10.
Получение этена (этилена) влабораторных условиях.
1) В пробирку поместили 6 мл 96% концентрированной
серной кислоты, 3мл этилового спирта и несколько
крупинок оксида алюминия (Al2O3) для равномерного
кипения смеси при нагревании.
2) Закрыли пробирку пробкой с газоотводной трубкой и
нагрели пробирку в пламени спиртовки.
3) Выделяющейся газ пропустили в отдельную пробирку
с раствором перманганата калия.
4) Убедились в том, что раствор перманганата калия
быстро обесцвечивается.
5) Затем подожгли газ у конца газоотводной трубки.
Отметим цвет пламени. (Этилен горит светящимся
11.
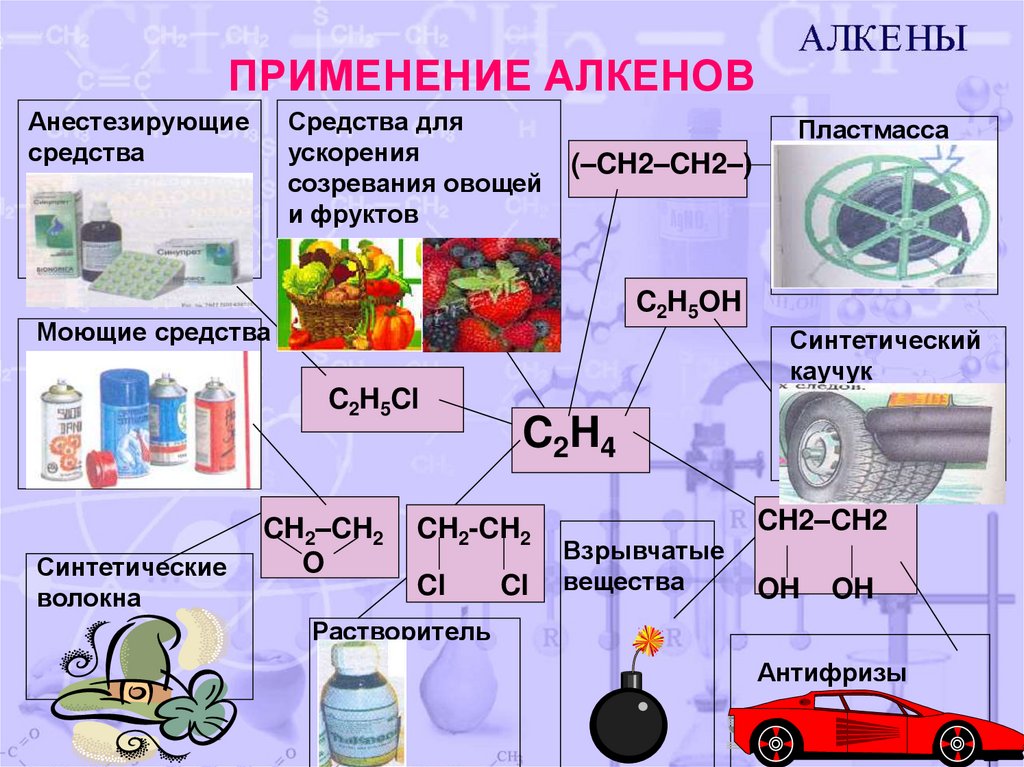
ПРИМЕНЕНИЕ АЛКЕНОВАнестезирующие
средства
Средства для
ускорения
созревания овощей
и фруктов
Пластмасса
(–CH2–CH2–)
C2H5OH
Моющие средства
Синтетический
каучук
C2H5Cl
Синтетические
волокна
CH2–CH2
O
C 2H 4
CH2-CH2
Cl
Cl
CH2–CH2
Взрывчатые
вещества
OH
OH
Растворитель
Антифризы










 Химия
Химия








