Похожие презентации:
Алгоритмы решения задач
1.
2.
3.
При окислении 160г оксида серы(IV) кислородом удалось получить180 г оксида серы(VI). Вычислите выход продукта реакции от теоретически
возможного для условий, в которых проводилась реакция.
Последовательность
выполнения
действий
Оформление решения задачи
С помощью соответствующих
обозначений запишем условие
задачи, найдем молярные массы
веществ, о которых идет речь в
условии задачи
Дано:
m(SO2)=160г
mnp(S03)=180г
η=?%
M(SO2)=64 г/моль
M(SO3)=80 г/моль
Найдем количество вещества
исходного
реагента
Запишем уравнение реакции.
Расставим коэффициенты
Над формулами веществ
запишем данные о количествах
веществ, найденных из условия
задачи, а под формулами —
стехиометрические
соотношения, отображаемые
уравнением реакции
Вычислим количество вещества
продукта реакции. Для этого
составим пропорцию
Найдем массу продукта реакции
при 100%-м выходе продукта
(теоретически возможную массу)
Найдем выход продукта реакции
от теоретически возможного.
Для этого составим пропорцию и
решим уравнение.
Запишем ответ
Решение:
160 г
n(SO2)= 64 г / моль =2,5моль
2SO2 + O2 = 2SO3
2,5моль
? моль
2S02 + 02 = 2S03
2моль
2 моль
2,5 моль
хмоль
2 моль = 2 моль
откуда х=2,5моль.
Следовательно, теоретически
n(SO3)=2,5моль
m(SO3)=n(S03)•M(S03)
mт(SO3)=2,5моль•80г/моль=200г
200г SO3 образуется при выходе 100%
180г SO3 образуется при выходе а %,
а•200=180•100%,
а=90%.
Следовательно, η=90%.
Ответ: η=90%
4.
5.
Вычислите массу оксида серы(IV), который потребуется для получения 180г оксидасеры(VI), если выход продукта реакции составит 90 % от теоретически возможного.
Последовательность выполнения
действий
С помощью соответствующих
обозначений запишем условие
задачи, найдем молярные массы
веществ, о которых идет речь в
условии задачи
Найдем количество вещества,
которое требуется получить в
результате реакции
Оформление решения задачи
Дано:
m(SO3)=180г
η=90%
---------------mnp(S02)=?г
М(SО2)=64г/моль
M(SO3)=80г/моль
Решение:
180 г
n(SO3)= 80 г / моль =2,25моль
Запишем уравнение реакции.
Расставим коэффициенты
Над формулами веществ
запишем данные о количествах
веществ, найденных из условия
задачи, а под формулами —
стехиометрические соотношения,
отображаемые уравнением
реакции
Вычислим количество вещества
реагента. Для этого составим
пропорцию
2SO2 + O2 = 2SO3
Найдем массу исходного
вещества
при 100%-м выходе продукта
теоретически требуемую массу)
Найдем массу исходного
вещества с учетом выхода (mnp).
Для этого составим пропорцию и
решим уравнение
m(SO2)= n(SO2)•M(SO2)
m(SO2)=2,25моль•64г/моль=144г
Запишем ответ
Ответ: mnp(SO2)=160г
? моль
2,25 моль
2SO2 + О2 = 2SO3
2 моль
2 моль
хмоль 2,25 моль
2 моль = 2 моль
откуда х=2,25моль.
Следовательно, n(SO2)=2,25 моль
144г SO2 соответствует 90 %,
а г SO2 соответствует 100 %.
а•90%=144•100%, а=160г.
Следовательно, mnp(SO2)=160г
6.
7.
Вычислите массу железа, которое можно получить при восстановлении464 г железной окалины Fe3O4 водородом, если в ней содержится 10% примесей.
Последовательность
выполнения действий
Оформление решения задачи
С помощью соответствующих
обозначений запишем условие
задачи, найдем молярные массы
веществ, о которых идет речь в
условии задачи
Дано:
mисх(Fе304)=464г
wnp=10%
--------------m(Fe)= ?г
M(Fe3O4)=232г/моль
M(Fe)=56г/моль
Решение:
w(Fe3O4)=100%-10%=90%
Вычислим массовую долю
основного реагента в порции
исходного вещества
Вычислим массу основного
реагента в порции исходного
вещества
Найдем количество вещества
исходного реагента
m(Fe304)=mисх(Fe304)•w(Fe3O4)
m(Fe3O4)=464г•0,9=417,6г
или пропорция:
464г исх. вещества соответствует 100%
а г Fe3O4 соответствует 90%,
откуда а= 417,6г
417,6 г
n(Fe3O4)= 232 г / моль =1,8моль
Запишем уравнение реакции.
Расставим коэффициенты
Над формулами веществ
запишем данные о количествах
веществ, найденных из условия
задачи, а под формулами —
стехиометрические
соотношения, отображаемые
уравнением реакции
Вычислим количество продукта
реакции. Для этого составим
пропорцию
Fe3O4 + 4H2 = 3Fe + 4H2O
Найдем массу продукта реакции
m(Fe)=n(Fe)•M(Fe)
m(Fe)=5,4моль•56г/моль=302,4г
Ответ: m(Fe)=302,4г
Запишем ответ
1,8 моль
? моль
Fe3O4 + 4Н2 = 3Fe + 4Н2О
1 моль
3 моль
1,8 моль
хмоль
1моль = 3 моль
откуда х=5,4моль.
Следовательно, n(Fe)=5,4 моль
8.
9.
При восстановлении порции железной окалины Fe3O4 массой 464г водородомобразовалось 302,4г железа. Вычислите массовую долю Fe3O4 в данной порции
железной окалины и массовую долю примесей в ней.
Последовательность
выполнения действий
Оформление решения задачи
С помощью соответствующих
обозначений запишем условие
задачи, найдем молярные массы
веществ, о которых идет речь в
условии задачи
Дано:
mисх(Ре304)=464г
m(Fe)=302,4г
----------------------w(Fe304)=?%; wnp=?%
M(Fe3O4)=232г/моль
M(Fe)=56г/моль
Решение:
302,4 г
n(Fe)= 56 г / моль =5,4моль
Fe3O4 + 4Н2 = 3Fe + 4Н2О
Найдем количество вещества
продукта реакции
Запишем уравнение реакции.
Расставим коэффициенты
Над формулами веществ
надпишем данные о количествах
веществ, найденных из условия
задачи, а под формулами —
стехиометрические
соотношения, отображаемые
уравнением реакции
Вычислим количество вещества
реагента. Для этого составим
пропорцию
Найдем массу исходного
вещества (основного реагента),
вступившего в реакцию
Найдем массовую долю
основного реагента в порции
исходного вещества. Для этого
составим пропорцию и решим
уравнение
Найдем массовую долю
примесей в порции исходного
вещества
Запишем ответ
? моль
5,4 моль
Fe3O4 + 4H2 = 3Fe + 4H2O
1 моль
3 моль
хмоль
5,4 моль
1моль = 3 моль
откуда х=1,8моль.
Следовательно, для чистого Fe3O4
n(Fe3O4)=1,8моль
m(Fe304)=n(Fe304)•M(Fe304)
m(Fe3O4)=1,8моль•232г/моль = 417,6г
464г составляет 100% массы исходного
вещества
417,6 г составляет а %,
а•464=417,6•100%, откуда
а=90%.
Следовательно, w(Fe3O4)=90%
wnp=100%-90%=10%
Ответ: w(Fe3O4)=90%; wnp=10%
10.
11.
Вычислите массу железной окалины Fe3O4, содержащей 10% примесей,необходимой для получения 302,4г железа.
Последовательность выполнения
действий
С помощью соответствующих
обозначений запишем условие
задачи, найдем молярные массы
веществ, о которых идет речь в
условии задачи
Найдем количество вещества,
которое требуется получить в
результате реакции
Оформление решения задачи
Дано:
m(Fe)=302,4 г
wnp=10%
---------------------mисх(Fe304)=?г
M(Fе3О4)=232г/моль
M(Fe)=56г/моль
Решение:
302,4 г
n(Fe)= 56 г / моль =5,4моль
Запишем уравнение реакции.
Расставим коэффициенты
Над формулами веществ
запишем данные о количествах
веществ, найденных из условия
задачи, а под формулами —
стехиометрические соотношения,
отображаемые уравнением
реакции
Вычислим количество вещества
исходного реагента. Для этого
составим пропорцию
Fe3O4 + 4H2 = 3Fe + 4H2O
Найдем массу исходного
вещества (основного реагента)
без учета примесей
Вычислим массовую долю
основного реагента в порции
исходного вещества
Найдем массу исходного
вещества с учетом содержания
примесей. Для этого составим
пропорцию и решим уравнение
m(Fe304)=n(Fe304)•M(Fe304)
m(Fe3O4)=1,8моль•232г/моль= 417,6г
Запишем ответ
? моль
5,4 моль
Fe3O4 + 4Н2 = 3Fe + 4Н2О
1 моль
3 моль
хмоль
5,4 моль
1моль = 3 моль
откуда х=1,8моль.
Следовательно, n(Fe3O4)=1,8моль
w(Fe3O4)=100%-10%=90%.
417,6г Ре3О4 соответствует 90 %
а г Fе3О4 с примесями соответствует
100%,
а•90%=417,6•100%,
а=464г.
Следовательно, mисх(Fе3О4)=464г
Ответ: mисх(Fе3О4)=464г
12.
13.
Какая масса оксида меди(II) провзаимодействует с 150 г. 5% раствора солянойкислоты.
Последовательность выполнения действий
С помощью соответствующих обозначений
запишем условие задачи, найдем молярные
массы веществ, о которых идет речь в
условии задачи
------------------------m(CuO)=?
M(CuO)=80г/моль
M(HCl)=36,5г/моль
Найдем массу растворенного вещества,
содержащуюся в растворе.
Найдем количество растворенного
вещества.
Напишем уравнение реакции, расставим
коэффициенты.
Над формулами веществ надпишем данные
о количествах веществ, найденных из
условия задачи, а под формулами —
стехиометрические соотношения,
отображаемые уравнением реакции
Вычислим количество вещества другого
реагента. Для этого составим и решим
пропорцию.
Найдем массу другого реагента.
Запишем ответ
Оформление решения задачи
Дано:
mр-ра(HCl)=150г.
w(HCl)=5%
mр.в.=wр.в.•mр-ра
m(HCl)=0,05•150г=7,5г
7,5г
n(HCl)= 36,5г / моль =0.205моль
CuO + 2HCl = CuCl2 + H2O
x моль 0,205 моль
CuO + 2HCl = CuCl2 + H2O
1 моль 2 моль
хмоль 0,205 моль
1моль = 2 моль , откуда
х=0,1025моль
m(CuO)=0,1025моль•80г/моль=8,2г
Ответ: m(CuO)=8,2г
14.
15.
Какая масса 10% раствора серной кислоты потребуется для поглощения 11,2 ламмиака при нормальных условиях.
Последовательность выполнения действий
Оформление решения задачи
С помощью соответствующих обозначений
Дано:
запишем условие задачи, найдем молярные
V(NH3)=11,2г.
массы веществ, о которых идет речь в
w(H2SO4)=10%
условии задачи
------------------------mр-ра(H2SO4)=?
M(H2SO4)=98г/моль
Vm=22,4л/моль
Найдем количество вещества известного
вещества.
Напишем уравнение реакции, расставим
коэффициенты.
Над формулами веществ надпишем данные
о количествах веществ, найденных из
условия задачи, а под формулами —
стехиометрические соотношения,
отображаемые уравнением реакции
Вычислим количество вещества другого
реагента. Для этого составим и решим
пропорцию.
Найдем массу другого реагента.
Найдем массу раствора другого реагента
Запишем ответ
11,2 л
n(NH3)= 22,4 л / моль =0,5моль
2NH3 + H2SO4 = (NH4)2SO4
0,5моль хмоль
2NH3 + H2SO4 = (NH4)2SO4
2 моль 1моль
0,5 моль хмоль
2 моль = 1моль , откуда
х=0,25моль
m(H2SO4)=0,25моль•98г/моль=25,4г
m( р.в.)
mр-ра= w( р.в.)
25,4 г
mр-ра(H2SO4)= 0,1 =245г.
Ответ: mр-ра(H2SO4) = 245г.
16.
17.
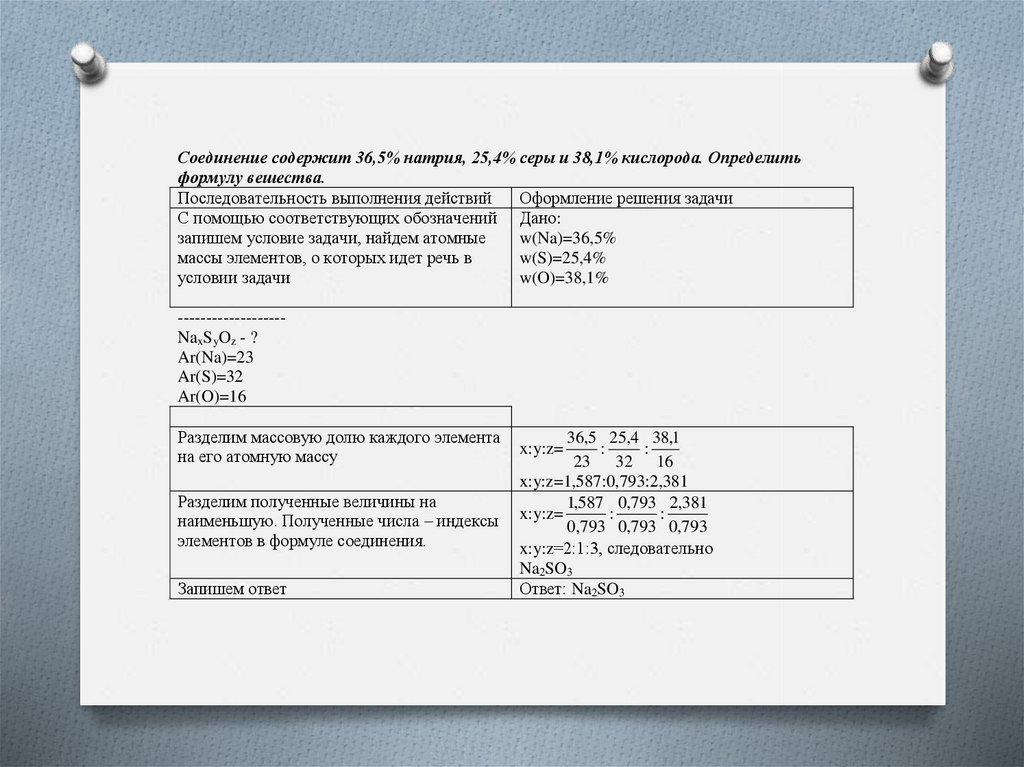
Соединение содержит 36,5% натрия, 25,4% серы и 38,1% кислорода. Определитьформулу вешества.
Последовательность выполнения действий
Оформление решения задачи
С помощью соответствующих обозначений Дано:
запишем условие задачи, найдем атомные
w(Na)=36,5%
массы элементов, о которых идет речь в
w(S)=25,4%
условии задачи
w(O)=38,1%
------------------NaxSyOz - ?
Ar(Na)=23
Ar(S)=32
Ar(O)=16
Разделим массовую долю каждого элемента
на его атомную массу
Разделим полученные величины на
наименьшую. Полученные числа – индексы
элементов в формуле соединения.
Запишем ответ
36,5 25,4 38,1
:
:
23 32 16
x:y:z=1,587:0,793:2,381
1,587 0,793 2,381
x:y:z=
:
:
0,793 0,793 0,793
x:y:z=2:1:3, следовательно
Na2SO3
Ответ: Na2SO3
x:y:z=
18.
19.
Вещество содержит 37.5 % С, 12.5 % Н и 50 % О. Определите формулу вещества,если плотность его паров по азоту при н.у. равна 1,143
Последовательность выполнения действий
Оформление решения задачи
С помощью соответствующих обозначений
Дано:
запишем условие задачи, найдем атомные
w(C)=37,5%
массы элементов и молярные массы
w(H)=12,5%
соединений, о которых идет речь в условии
w(O)=50%
задачи
DN2=1,143
--------------CxHyOz -?
Ar(C)=12
Ar(H)=1
Ar(O)=16
M(N2)=28
Найдем молярную массу вещества по
формуле M=dy(x)*M(y)
Найдем массу углерода
M(CxHyOz)=1,143•28=32г/моль
w(c ) * M
100%
37,5% * 32 г / моль
100%
m(C)=
=12г/моль
m(C)=
Найдем число атомов углерода, разделив
массу углерода на относительную атомную
массу углерода
Аналогично найдем массу и число атомов
водорода
Аналогично найдем массу и число атомов
кислорода
Запишем ответ
12
n(C)= 12 =1моль
12,5% * 32 г / моль
100%
m(H)=
=4г/моль
4
n(H)= 1 =4
50% * 32 г / моль
100%
m(O)=
=16г/моль
16
n(O)= 16 =1
Таким образом, формула вещества CH4O
или СH3OH
Ответ: СH3OH
20.
21.
При сжигании 5 г. вещества получено 14,26 г. СО2, 3,33 г. Н2О. Определите формулувещества, если плотность его паров по кислороду равна 3,375 при н.у.
Последовательность выполнения действий
Оформление решения задачи
С помощью соответствующих обозначений
Дано:
запишем условие задачи, найдем молярные
m(вещества)=5г
массы соединений, о которых идет речь в
m(CO2)=14,26г
условии задачи
m(H2O)=3,33г
dO2=3,375
--------------------------Формула вещества-?
M(CO2)=44г/моль
M(H2O)=18г/моль
M(O2)=32г/моль
Найдем молярную массу вещества по
M(в-ва)=3,375•32г/моль=108г/моль
формуле M=dy(x)*M(y)
Найдем количество вещества искомого
5г
вещества
108
г
/ моль =0,0463моль
n=
Найдем количество вещества углекислого
14,26 г
газа. Количества вещества углерода
n(CO2)= 44 г / моль =0,324моль,
численно равно найденному значению
n(C)=0,324моль
Найдем количество вещества воды.
3,33г
Количество вещества атомов водорода
n(H2O)= 18г / моль =0,185моль
равно найденному значению, умноженному n(H)=2•0,185моль=0,37моль
на 2
Найдем соотношение углерода и водорода.
x:y=0,324:0,37
Найденные числа разделим на количество
0,324
0,37
вещества искомого вещества
0
,
0463
0
x:y=
: ,0463
x:y=7:8, поэтому C7H8
Найдем молекулярную массу вещества с
M(C7H8)=7•12+8•1=92г/моль
найденной формулой. Разница между
m(O)=108г/моль-92г/моль=16г/моль
истинной молекулярной массой и
16
рассчитанной – масса кислорода. Найдем
n(О)= 16 =1, такис образом, формула
число атомов кислорода.
вещества C7H8О или С6Н5-СН2-ОН
Запишем ответ
Ответ: С6Н5-СН2-ОН
22.
23.
Обозначение важнейших физико-химических величинВеличина
1. Масса
2. Масса молекулы
3. Масса атома
4. Относительная
атомная масса
5. Относительная
молекул. масса
6. Молярная масса
Обозначение
m
m0
ma
Ar
Размерность
г, кг, т
г, кг
г, кг
-
Mr
-
M
7. Объем
8. Количество вещества
9. Плотность
10. Относительная
плотность
11. Температура
12. Давление
13. Скорость химич.
реакции
V
n
г/моль,
кг/кмоль
л, м3, мл
моль, кмоль
кг/м3, г/мл
-
14. Массовая доля
15. Объемная доля
16. Мольная доля
17. Молярная
концентрация
18. Выход продукта
реакции
19. Время
20. Число Авогадро
21. Молярный объем
газа при н.у.
22. Средняя молярная
масса воздуха
ω
φ
χ
C
d
toC, T
p
о
η
С, К
Па, атм
моль
моль
л * с , кв . м * с
%
%
%
моль
л
%
t
NA
VM
с
6*1023 1/моль
22,4 л/моль
M(возд.)
29 г/моль
24.
Формулы по химииI. Масса
m=m0*N ; m=ρ*V ; m=M*n
II. Объем
m
V=Vm*n ; V=
III. Число молекул
N=NA*n
IV. Количество вещества
m
n= M ; n=V/VM ; n=N/NA
V. Молярная масса
m
M=m0*NA ; M= n ; M=dy(x)*M(y) ; Mгаза = газа*VM
VI. Плотность
m
ρ= V ; ρгаза=M/Vm
VII. Относительная плотность газа Х по газу Y
M ( x)
dy(x)= M ( y ) ;
25.
VIII. Массовая доляn * Ar
а) элемента ω= Mr
б) растворенного вещества
m( р.в )
ω= m( р ра )
в) вещества в смеси
m(в ва )
ω= m(смеси )
IX. Молярная концентрация
n( раств.вещ.)
C= V ( раствора)
X. Выход продукта реакции
m(практ )
V (практ )
n(практ )
η= m(теорет) ; η= V (теорет) ; η= n(теорет)
XI. Скорость реакции.
=k[A]n[B]m, где n и m – коэффициенты уравнения.
=V1*γ∆t/10
























 Математика
Математика








