Похожие презентации:
Углерод. Электронная формула
1. УГЛЕРОД
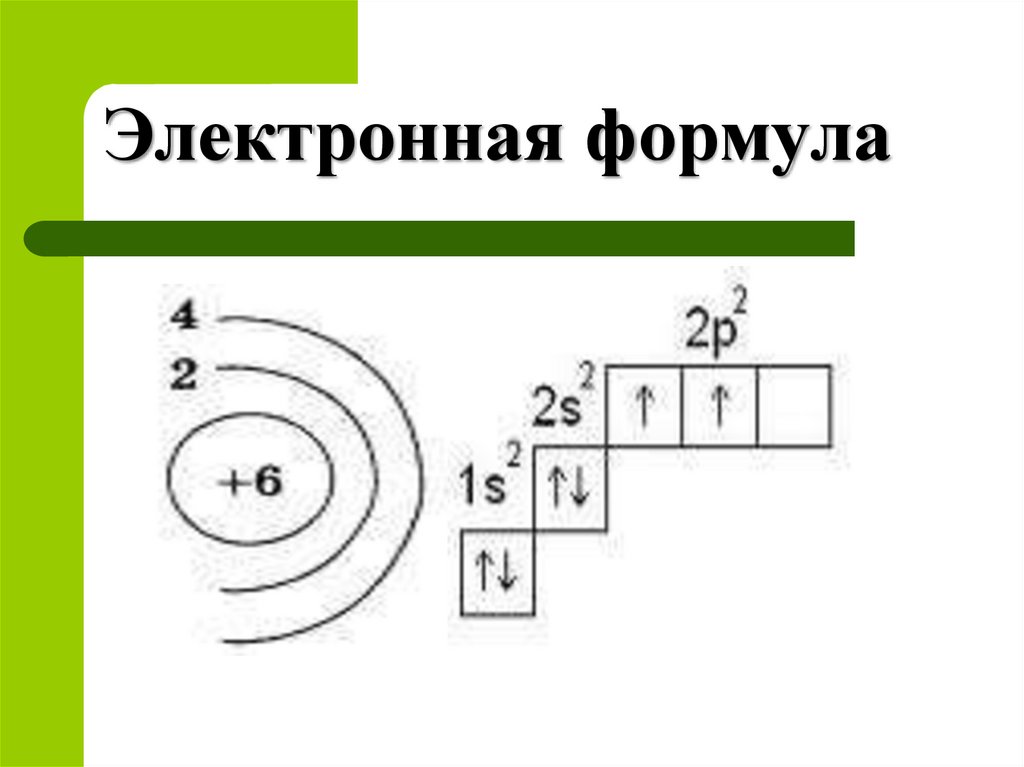
2. Электронная формула
3.
Аллотропия-способностьатомов одного элемента
образовывать несколько
простых веществ.
4. Аллотропия углерода
Алмаз- это прозрачноекристаллическое вещество, самое
твердое из всех прозрачных
веществ. Это обусловлено
структурой его атомной
кристаллической решетки.
Кристаллы алмаза обычно
бесцветные, но бывают синего,
красного и черного цвета.
5.
Фуллерены - удивительныеполициклические структуры
сферической формы. Это новая
модификация углерода, для которой, в
отличие от трех ранее известных
модификаций (алмаза, графита и
карбина), характерна не полимерная, а
молекулярная структура, т.е. молекулы
фуллеренов дискретны.
6.
Карбин - черный порошок, решеткапостроена из прямолинейных цепочек
С∞ ,полупроводник. Наиболее
стабильная модификация углерода.
7.
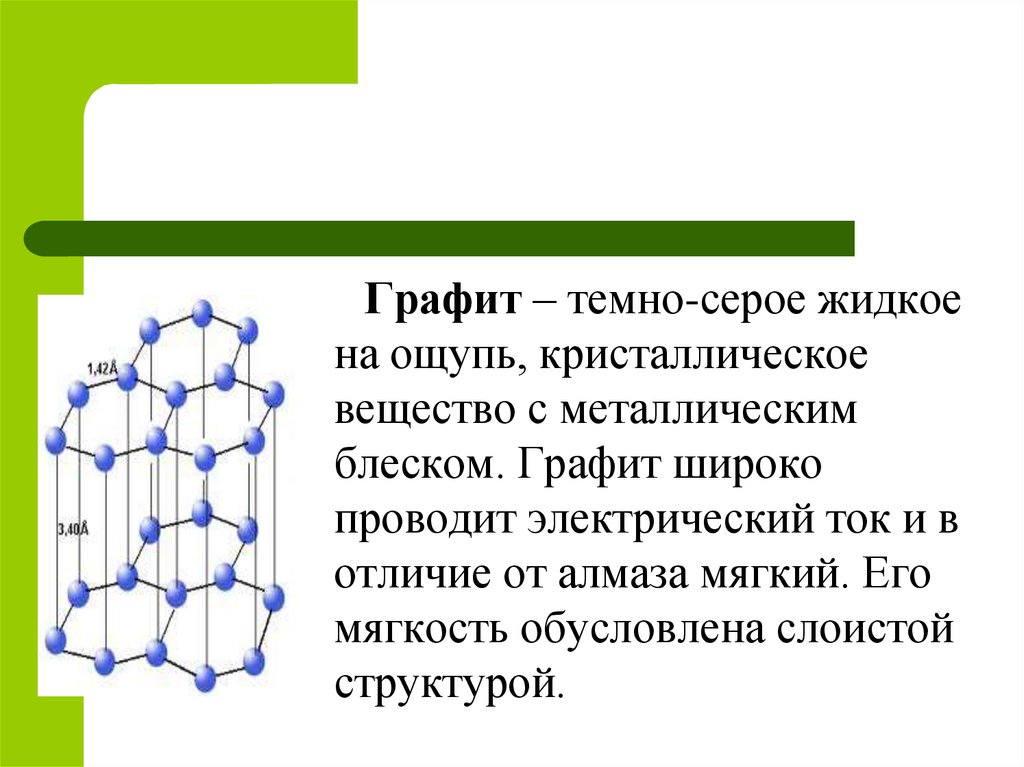
Графит – темно-серое жидкоена ощупь, кристаллическое
вещество с металлическим
блеском. Графит широко
проводит электрический ток и в
отличие от алмаза мягкий. Его
мягкость обусловлена слоистой
структурой.
8.
Адсорбция - поглощениегазообразных или
растворённых веществ
поверхностью твёрдого
вещества, а выделение этих
веществ - десорбция
9. Химические свойства
С – малоактивен, на холодереагирует только с фтором(СF4).
Химическая активность проявляется
при высоких температурах.
10.
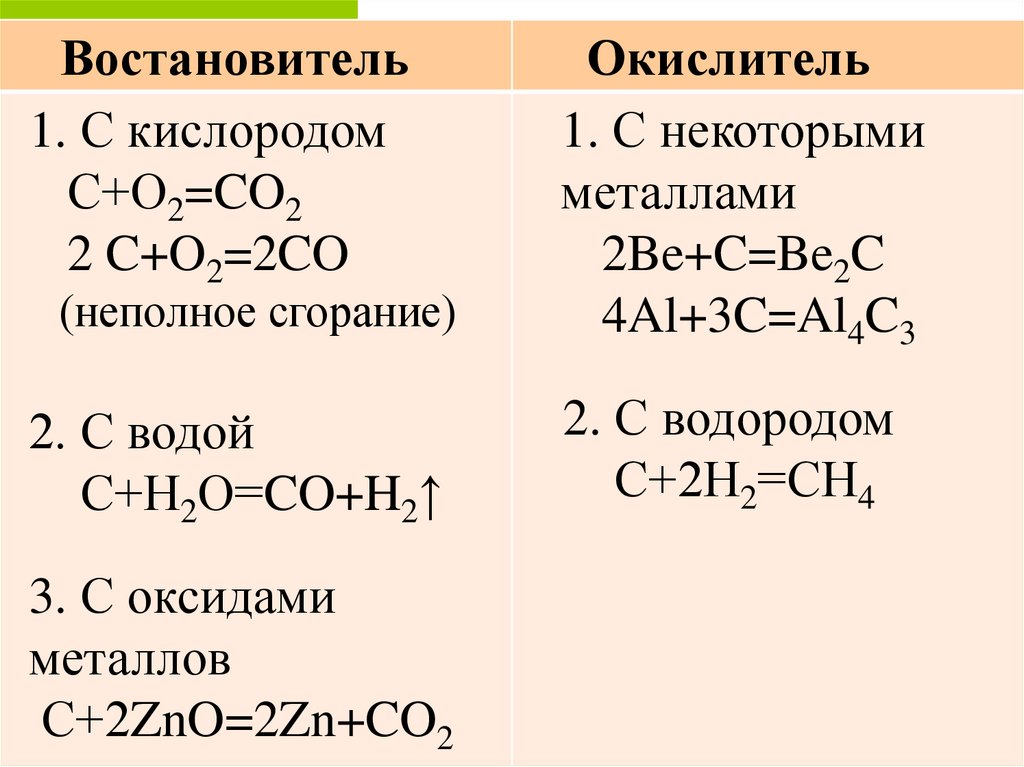
Востановитель1. С кислородом
С+О2=CO2
2 C+O2=2CO
Окислитель
1. С некоторыми
металлами
2Be+C=Be2C
4Al+3C=Al4C3
2. С водой
С+Н2О=CO+H2↑
2. С водородом
С+2Н2=СН4
(неполное сгорание)
3. С оксидами
металлов
С+2ZnO=2Zn+CO2
11.
12.
13.
Домашняяработа
14.
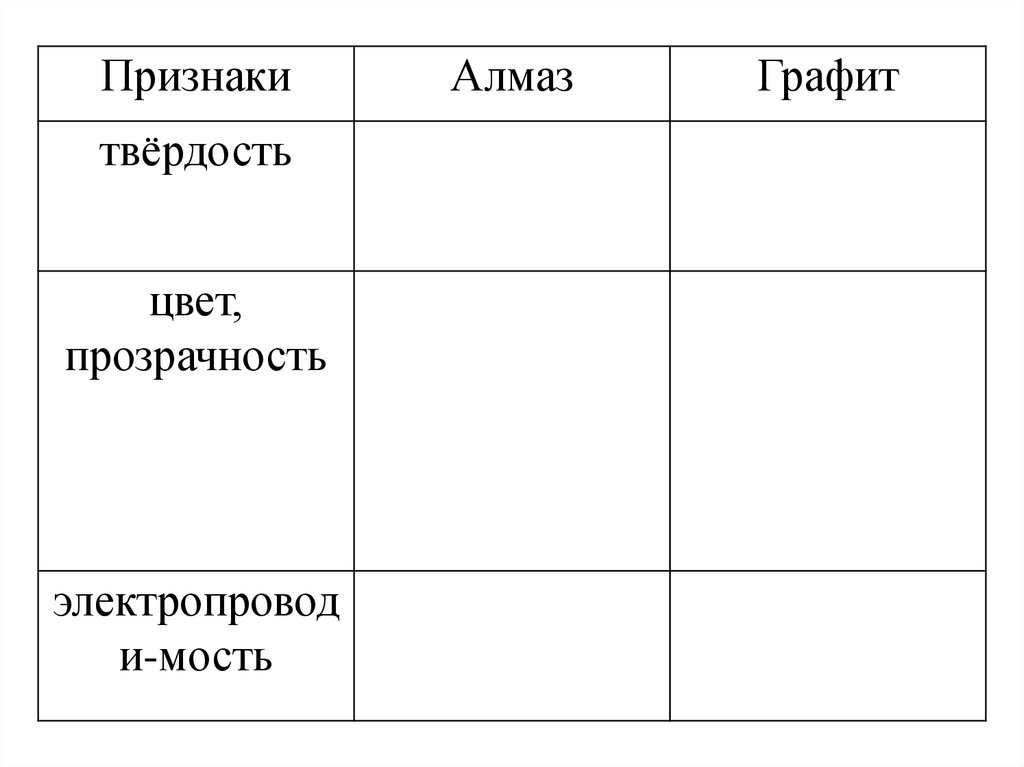
Признакитвёрдость
цвет,
прозрачность
электропровод
и-мость
Алмаз
Графит
15.
С→СаС2→С2Н2→СО2→СО








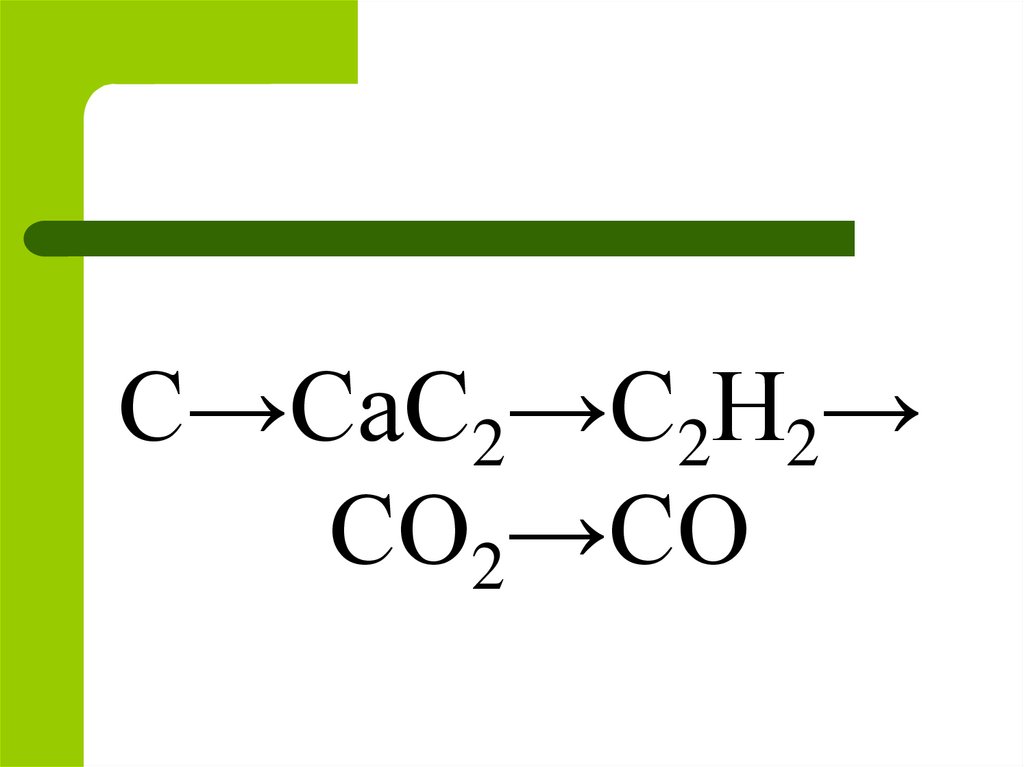
 Химия
Химия








