Похожие презентации:
Диссоциация кислот, оснований и солей
1.
2.
профессора Химкина3.
Положительно (+)заряженный электрод
Анод
4.
Положительно (+)заряженные частицы
Катионы
5.
Отрицательно(-)заряженный электрод
Катод
6.
Вещества, водныерастворы которых не
проводят
электрический ток
Неэлектролиты
7.
Отрицательно (-)заряженные частицы
Анионы
8.
Вещества, водныерастворы которых
проводят
электрический ток
Электролиты
9.
Процесс распадаэлектролита на ионы
Электролитическая
диссоциация
10.
•Кто автор теорииэлектролитической
диссоциации?
•В каком году была
открыта эта теория?
С. Аррениус;
1887 год.
11.
КатионыЭлектролиты
Диссоциация
кислот,
оснований, солей
Слабые
электролиты
Неэлектролиты
Теория
ОО
электролитической
диссоциации
С. Аррениус
Анионы
Катод
Анод
12.
Наш девиз:«Либо я найду путь, либо проложу его»
13.
14.
Уважаемый руководитель детективного агентства «Истина где- торядом» и его сотрудники!
К вам обращаются ваши коллеги с просьбой, помочь нам в разрешении
одной проблемы. Сегодня ночью в нашем офисе побывал кто- то
неизвестный. После себя он оставил множество следов, и в одном из
кабинетов была обнаружена лужа неизвестного происхождения. Наши
эксперты смогли установить, что в этом растворе присутствуют ионы
SO42- Са2+ Cl - Н+ ОН- Na + .
Но они не могут установить, растворы каких веществ мог разлить
преступник?
Какие свойства могут проявлять эти вещества и от чего зависят эти
свойства?
Если можно, ответьте на эти вопросы и пришлите нам ответ в форме,
которую мы прилагаем. С уважением и надеждой на скорейшее разрешение
проблемы ваши коллеги из детективного агентства «Лунный свет».
15.
Игра16.
формулы кислотназови их
NaОH
CaCO3
H3PO4
HCl
SO2
H2SO4
формулы солей
назови их
Na2SiO3
HCl
HNO3
H2S
K2SO4
CuСО3
формулы
оснований
назови их
NaОH
H2S
Сa(ОH) 2
HClO
КОH
NaH
17.
Инструктаж по техникебезопасности:
Запрещается использовать посуду, имеющую
трещины и отбитые края.
18.
Осторожно: кислоты и щёлочи – едкиевещества. Разрушают ткани, раздражают
кожу, слизистые оболочки.
19.
После завершения работы тщательно помытьруки с мылом под проточной водой.
20.
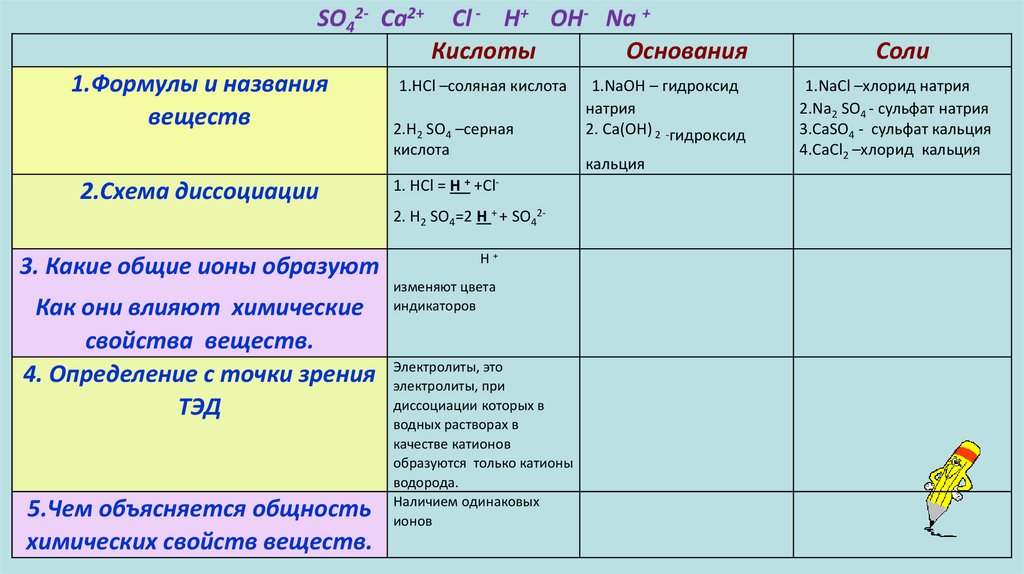
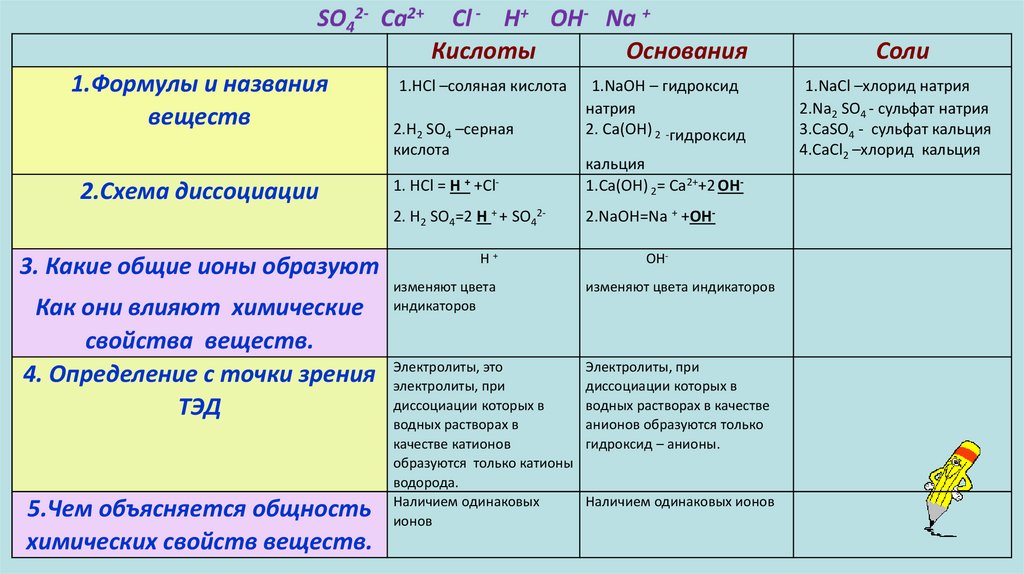
Кислоты1.Формулы и названия
веществ
2.Схема диссоциации
3. Какие общие ионы образуют
Как они влияют химические
свойства веществ.
4. Определение с точки зрения
ТЭД
5.Чем объясняется общность
химических свойств веществ.
Основания
Соли
21.
Кислоты1.Формулы и названия
веществ
2.Схема диссоциации
3. Какие общие ионы образуют
Как они влияют химические
свойства веществ.
4. Определение с точки зрения
ТЭД
5.Чем объясняется общность
химических свойств веществ.
1.HCl –соляная кислота
2.H2 SO4 –серная
кислота
Основания
1.NaOH – гидроксид
натрия
2. Са(ОН) 2 -гидроксид
кальция
Соли
1.NaCl –хлорид натрия
2.Na2 SO4 - сульфат натрия
3.СаSО4 - сульфат кальция
4.СaCl2 –хлорид кальция
22.
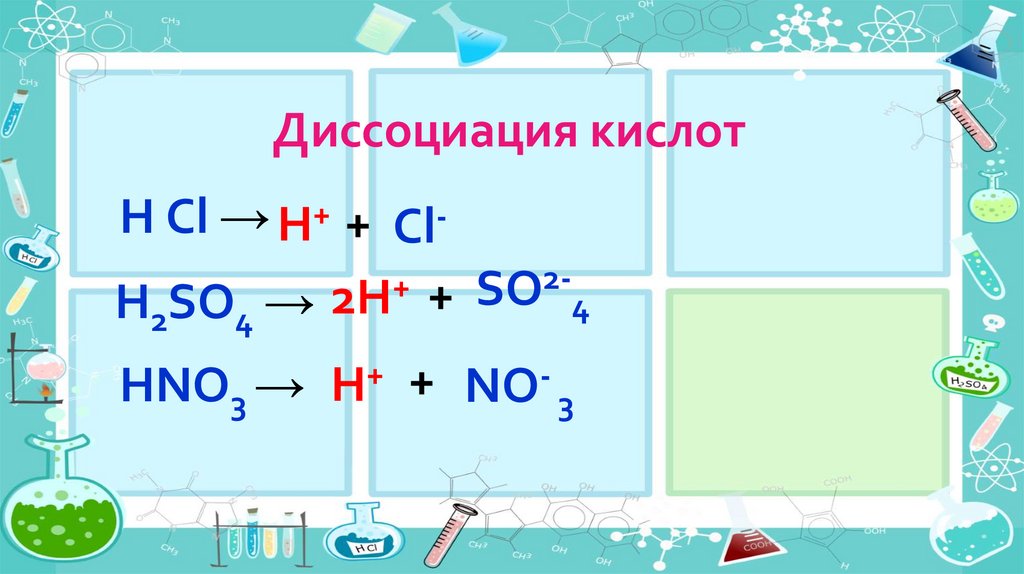
Диссоциация кислотH Cl → H+ + Cl2+
H2SO4 → 2H + SO 4
HNO3 →
+
H
+ NO- 3
23.
Многоосновные кислоты диссоциируют ступенчатоH2SO4 ( серная кислота)
1) Образование гидросульфат ионов
H2SO4 ↔ H+ + HSO42) Образование сульфат-ионов
HSO4- ↔ H+ + SO42-
24.
Лабораторный опыт № 1«Выявление катионов водорода»
В пробирки налейте по 1—2 мл растворов соляной и серной кислот,
В каждую пробирку добавьте несколько капель раствора лакмуса.
По изменению цвета определите кислотность среды.
25.
Какие общие химические свойства проявляют кислоты?изменяют окраску индикатора
При диссоциации кислот образуются
катионы водорода
26.
Кислотами называютсяэлектролиты, при
диссоциации которых…
в качестве катионов
образуются только
катионы водорода
27.
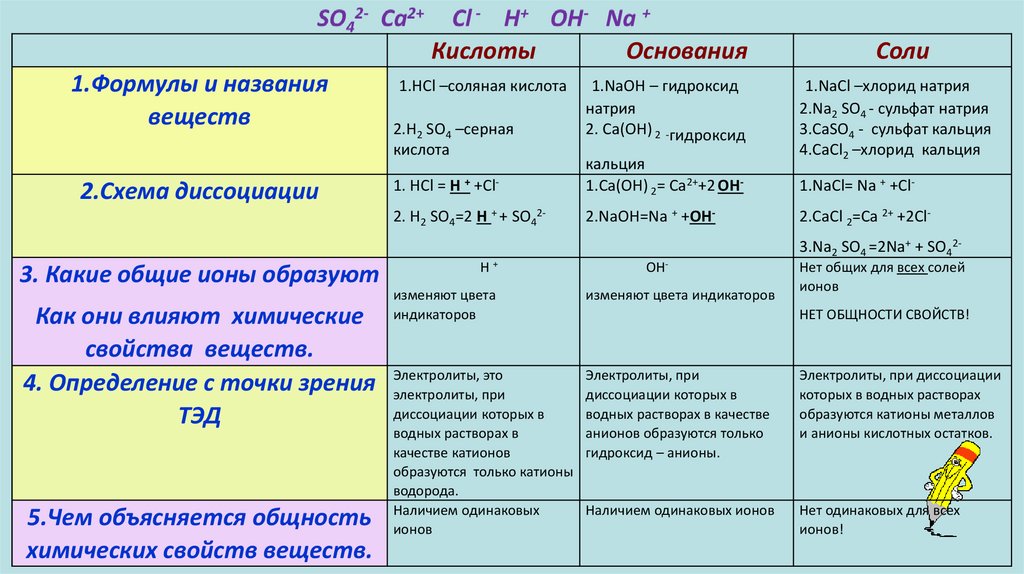
Кислоты1.Формулы и названия
веществ
2.Схема диссоциации
1.HCl –соляная кислота
2.H2 SO4 –серная
кислота
1. HCl = H + +Cl2. H2 SO4=2 H + + SO42-
3. Какие общие ионы образуют
Как они влияют химические
свойства веществ.
4. Определение с точки зрения
ТЭД
5.Чем объясняется общность
химических свойств веществ.
H+
изменяют цвета
индикаторов
Электролиты, это
электролиты, при
диссоциации которых в
водных растворах в
качестве катионов
образуются только катионы
водорода.
Наличием одинаковых
ионов
Основания
1.NaOH – гидроксид
натрия
2. Са(ОН) 2 -гидроксид
кальция
Соли
1.NaCl –хлорид натрия
2.Na2 SO4 - сульфат натрия
3.СаSО4 - сульфат кальция
4.СaCl2 –хлорид кальция
28.
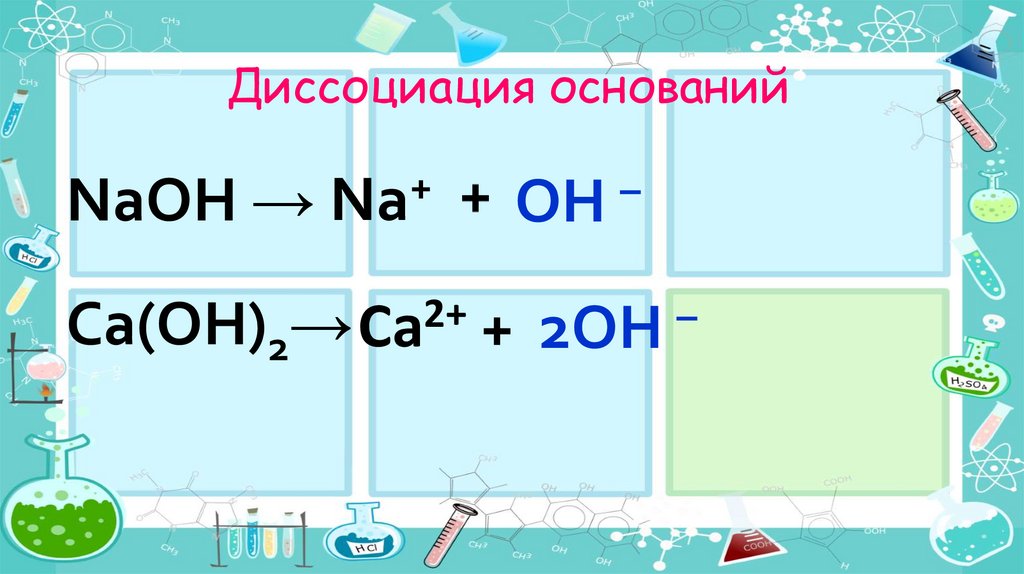
Диссоциация основанийNaOH →
+
Na
2+
Ca(OH)2→ Ca
OH
–
+ 2OH
–
29.
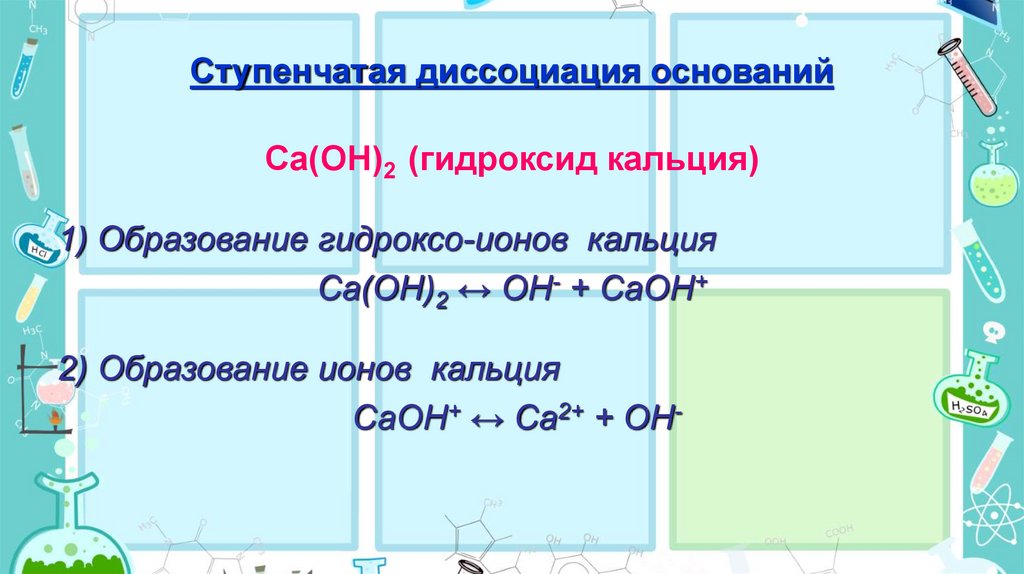
Ступенчатая диссоциация основанийСa(OH)2 (гидроксид кальция)
1) Образование гидроксо-ионов кальция
Сa(OH)2 ↔ OH- + СaOH+
2) Образование ионов кальция
СaOH+ ↔ Сa2+ + OH-
30.
Лабораторный опыт № 2«Выявление гидроксид анионов»
В пробирки налейте по 1—2 мл растворов гидроксида натрия и
гидроксида кальция,
В каждую пробирку добавьте несколько капель раствора лакмуса.
По изменению цвета определите кислотность среды.
31.
Какие общие химические свойства проявляют основания?изменяют окраску индикатора
При диссоциации оснований образуются
гидроксид анионы
Индикатор, изменяя цвет в щелочной
среде, обнаруживает наличие
гидроксид аниона
32.
Основанияминазываются
электролиты, при
диссоциации которых
в качестве анионов
образуются только
гидроксид-анионы
33.
Кислоты1.Формулы и названия
веществ
2.Схема диссоциации
3. Какие общие ионы образуют
Как они влияют химические
свойства веществ.
4. Определение с точки зрения
ТЭД
5.Чем объясняется общность
химических свойств веществ.
1.HCl –соляная кислота
2.H2 SO4 –серная
кислота
Основания
1.NaOH – гидроксид
натрия
2. Са(ОН) 2 -гидроксид
1. HCl = H + +Cl-
кальция
1.Са(OH) 2= Са2++2 OH-
2. H2 SO4=2 H + + SO42-
2.NaOH=Na + +OH-
H+
OH-
изменяют цвета
индикаторов
изменяют цвета индикаторов
Электролиты, это
электролиты, при
диссоциации которых в
водных растворах в
качестве катионов
образуются только катионы
водорода.
Наличием одинаковых
ионов
Электролиты, при
диссоциации которых в
водных растворах в качестве
анионов образуются только
гидроксид – анионы.
Наличием одинаковых ионов
Соли
1.NaCl –хлорид натрия
2.Na2 SO4 - сульфат натрия
3.СаSО4 - сульфат кальция
4.СaCl2 –хлорид кальция
34.
NaCl → Na+ + ClNa2SO4 → 2Na+ + SO2- 4CaCl 2→ Ca2+ + 2 Cl-
35.
Лабораторный опыт № 3«Выявление общих свойств у солей»
В пробирки налейте по 1—2 мл растворов сульфата натрия и
хлорида кальция,
В каждую пробирку добавьте несколько капель раствора лакмуса.
Что наблюдаете?
36.
Какие общие химические свойства солипроявляют?
У солей нет общих ионов
Допишите
При диссоциации солей образуются
катионы металла и анионы кислотного
остатка
37.
Солями называютсяэлектролиты, при
диссоциации которых
образуются катионы
металлов и анионы
кислотных остатков
38.
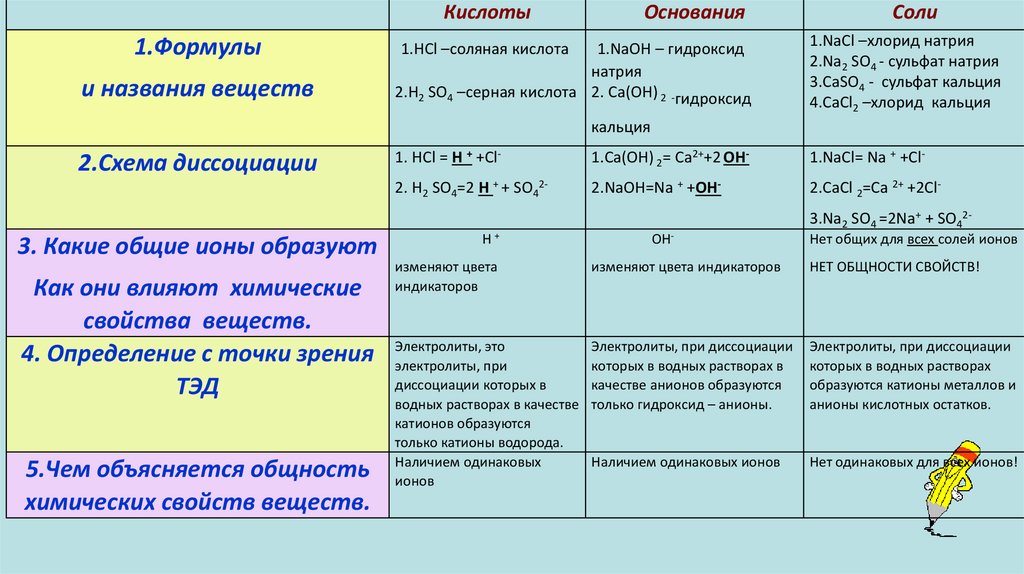
Кислоты1.Формулы и названия
веществ
2.Схема диссоциации
1.HCl –соляная кислота
2.H2 SO4 –серная
кислота
Основания
1.NaOH – гидроксид
натрия
2. Са(ОН) 2 -гидроксид
1. HCl = H + +Cl-
кальция
1.Са(OH) 2= Са2++2 OH-
2. H2 SO4=2 H + + SO42-
2.NaOH=Na + +OH-
Соли
1.NaCl –хлорид натрия
2.Na2 SO4 - сульфат натрия
3.СаSО4 - сульфат кальция
4.СaCl2 –хлорид кальция
1.NaCl= Na + +Cl2.СаCl 2=Са 2+ +2Cl-
3.Na2 SO4 =2Na+ + SO42-
3. Какие общие ионы образуют
Как они влияют химические
свойства веществ.
4. Определение с точки зрения
ТЭД
5.Чем объясняется общность
химических свойств веществ.
H+
OH-
Нет общих для всех солей
ионов
изменяют цвета
индикаторов
изменяют цвета индикаторов
Электролиты, это
электролиты, при
диссоциации которых в
водных растворах в
качестве катионов
образуются только катионы
водорода.
Наличием одинаковых
ионов
Электролиты, при
диссоциации которых в
водных растворах в качестве
анионов образуются только
гидроксид – анионы.
Электролиты, при диссоциации
которых в водных растворах
образуются катионы металлов
и анионы кислотных остатков.
Наличием одинаковых ионов
Нет одинаковых для всех
ионов!
НЕТ ОБЩНОСТИ СВОЙСТВ!
39.
Основное положение ТЭДХимические свойства растворов
электролитов определяются свойствами тех
ионов, которые они образуют при
диссоциации.
40.
Кислоты1.Формулы
и названия веществ
Основания
1.HCl –соляная кислота
1.NaOH – гидроксид
натрия
2.H2 SO4 –серная кислота 2. Са(ОН) 2 -гидроксид
Соли
1.NaCl –хлорид натрия
2.Na2 SO4 - сульфат натрия
3.СаSО4 - сульфат кальция
4.СaCl2 –хлорид кальция
кальция
2.Схема диссоциации
1. HCl = H + +Cl-
1.Са(OH) 2= Са2++2 OH-
1.NaCl= Na + +Cl-
2. H2 SO4=2 H + + SO42-
2.NaOH=Na + +OH-
2.СаCl 2=Са 2+ +2Cl3.Na2 SO4 =2Na+ + SO42-
3. Какие общие ионы образуют
Как они влияют химические
свойства веществ.
4. Определение с точки зрения
ТЭД
5.Чем объясняется общность
химических свойств веществ.
H+
OH-
Нет общих для всех солей ионов
изменяют цвета
индикаторов
изменяют цвета индикаторов
НЕТ ОБЩНОСТИ СВОЙСТВ!
Электролиты, это
электролиты, при
диссоциации которых в
водных растворах в качестве
катионов образуются
только катионы водорода.
Наличием одинаковых
ионов
Электролиты, при диссоциации
которых в водных растворах в
качестве анионов образуются
только гидроксид – анионы.
Электролиты, при диссоциации
которых в водных растворах
образуются катионы металлов и
анионы кислотных остатков.
Наличием одинаковых ионов
Нет одинаковых для всех ионов!
41.
Сообщение доставлено42.
«Уважаемые коллеги!Обращаемся к вам с огромной благодарностью за
оказанную помощь! Ваш вклад в расследовании
данного преступления более чем значителен! И вновь
просим вас о помощи уже в качестве экспертов.
Преступники оставили на столах еще вопрос,
ответьте на него по возможности.
Заранее спасибо!
Ваши коллеги из детективного агентства «Лунный
свет».
43.
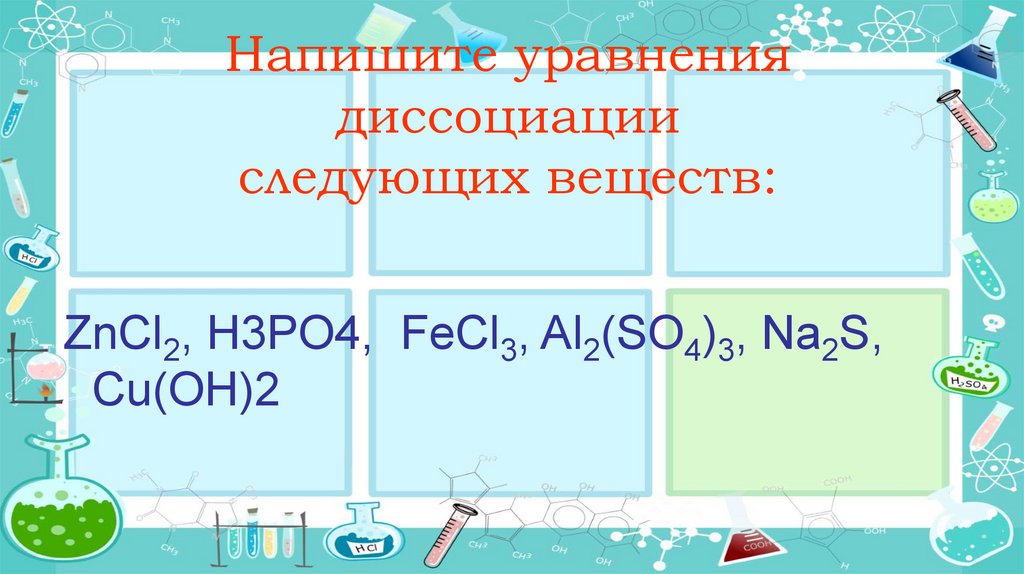
Напишите уравнениядиссоциации
следующих веществ:
ZnCl2, Н3PO4, Al(NO3)3, K2SO4, KOН,
FeCl3, Al2(SO4)3, Na2S, Сu(OН)2
44.
Напишите уравнениядиссоциации
следующих веществ:
ZnCl2, Н3PO4, FeCl3, Al2(SO4)3, Na2S,
Сu(OН)2
45.
Синквейн1 строка – одно существительное, выражающее главную тему
cинквейна.
2 строка – два прилагательных, выражающих главную мысль.
3 строка – три глагола, описывающие действия в рамках темы.
4 строка – фраза, несущая определенный смысл.
5 строка – заключение в форме существительного (ассоциация с
первым словом).
46.
КислотыОпасные, водородсодержащие
Окисляют, разрушают, реагируют
Изменяют цвет индикатора
Вещества
47.
Оценка за урок•12 баллов – 5
•10-11 баллов – 4
•7-9 баллов- 3
48.
Домашнее задание:пар. 36 закончить
таблицу своими
примерами.
Творческое задание
составить синквейн









































 Химия
Химия








