Похожие презентации:
Диссоциация кислот, оснований, солей
1. Диссоциация кислот, оснований, солей
2.
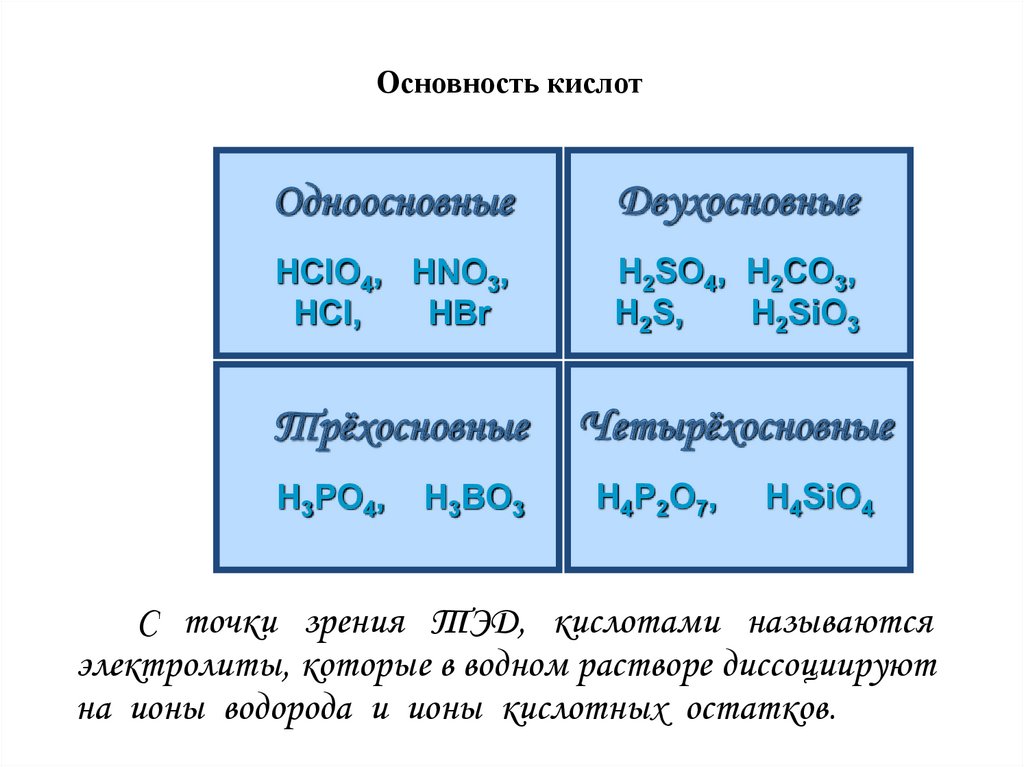
Основность кислотОдноосновные
Двухосновные
HClO4, HNO3,
HCl,
HBr
H2SO4, H2CO3,
H2S,
H2SiO3
Трёхосновные
Четырёхосновные
H3PO4,
H3BO3
H4P2O7,
H4SiO4
С точки зрения ТЭД, кислотами называются
электролиты, которые в водном растворе диссоциируют
на ионы водорода и ионы кислотных остатков.
3.
-+
HCl = H + Cl
+
HNO3 = H +
+
NO3
HClO4 = H +
ClO4
Кислоты – это электролиты, которые
диссоциируют на катионы водорода и
анионы кислотного остатка.
4.
Сильный электролит+
-
H2SO4 H + HSO4
-
+
2-
HSO4 H + SO4
Электролит средней
силы
+
H2SO3 H + HSO3
-
+
HSO3 H + SO3
+
+
H2SO4 2H +
2SO4
-
2-
H2SO3 H + HSO3
Многоосновные кислоты диссоциируют ступенчато. Каждая
последующая степень протекает хуже предыдущей.
5.
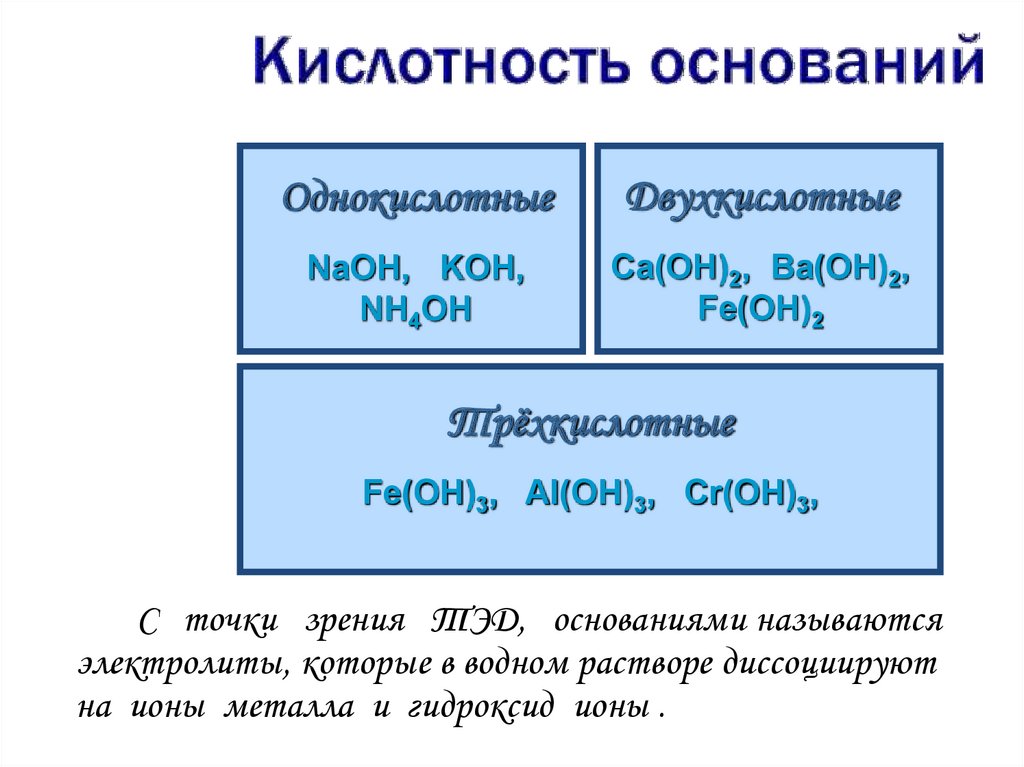
ОднокислотныеДвухкислотные
NaOH, KOH,
NH4OH
Ca(OH)2, Ba(OH)2,
Fe(OH)2
Трёхкислотные
Fe(OH)3, Al(OH)3, Cr(OH)3,
С точки зрения ТЭД, основаниями называются
электролиты, которые в водном растворе диссоциируют
на ионы металла и гидроксид ионы .
6.
NaOH = Na+ + OHBa(OH)2 = BaOH+ + OH- → Ba2+ + 2OHKOH = K+ + OH-Основания – это электролиты,
которые диссоциируют на катионы
металла и анионы гидроксогрупп
7.
NaCl = Na+ + ClKNO3 = K+ + NO3Al2(SO4)3 = 2Al3+ + 3SO42-Соли – это электролиты, которые
диссоциируют на катионы металла или
аммония NH4+ и анионы кислотных
остатков.
8.
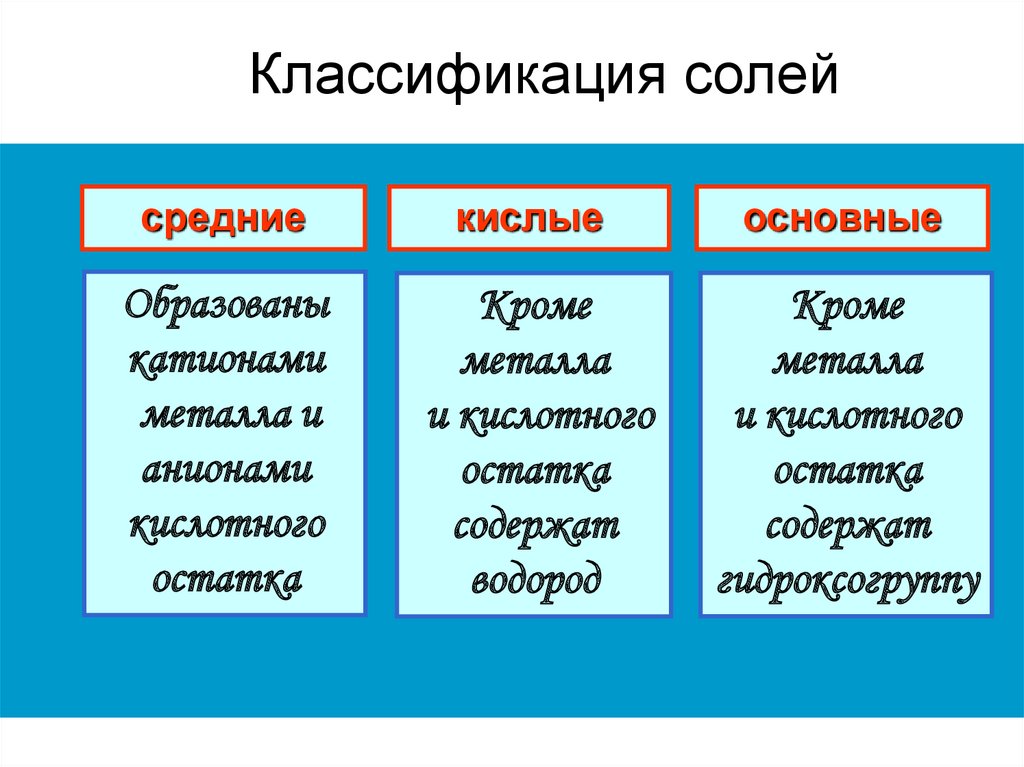
Классификация солейсредние
кислые
основные
Образованы
катионами
металла и
анионами
кислотного
остатка
Кроме
металла
и кислотного
остатка
содержат
водород
Кроме
металла
и кислотного
остатка
содержат
гидроксогруппу
9.
Na2SO4 = 2Na+ + SO42AlCl3 = Al3+ + 3ClFe2(SO4)3 = 2Fe3+ + 3SO42С точки зрения ТЭД, средними соляминазываются электролиты, которые в водном растворе
диссоциируют на ионы металла и ионы кислотного
остатка..
10.
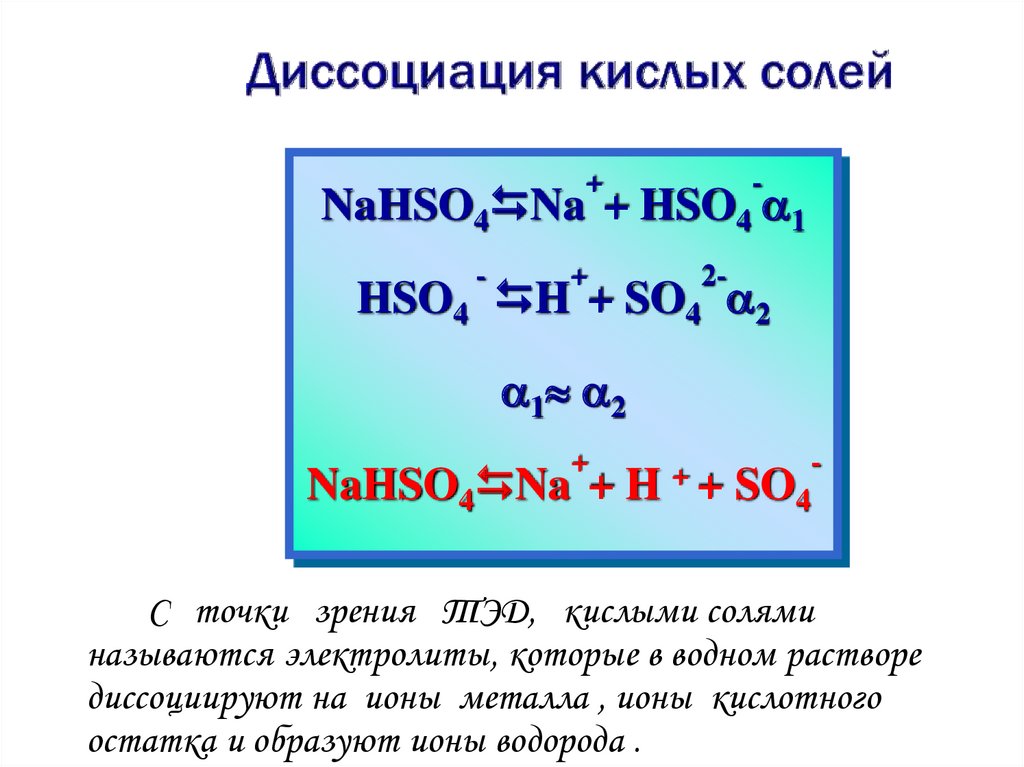
+-
NaHSO4 Na + HSO4 1
-
+
2-
HSO4 H + SO4 2
1 2
+
NaHSO4 Na + H
++
SO4
С точки зрения ТЭД, кислыми солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла , ионы кислотного
остатка и образуют ионы водорода .
11.
Ba(OH)Cl =-
BaOH
BaOH+
Ba2+
+ Cl
-
-
+ OH
С точки зрения ТЭД, основными солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла , ионы кислотного
остатка и образуют гидроксид ионы.
12.
Условия протекания реакцииионного обмена
• Реакции в растворах электролитов
протекают до конца если:
• Образуется или растворяется осадок;
• Выделяется газ;
• Образуется малодиссоциирующее вещество
(например Н2О)
13.
Образованиеосадка
NaCl AgNO 3 AgCl NaNO3
Cl Ag AgCl
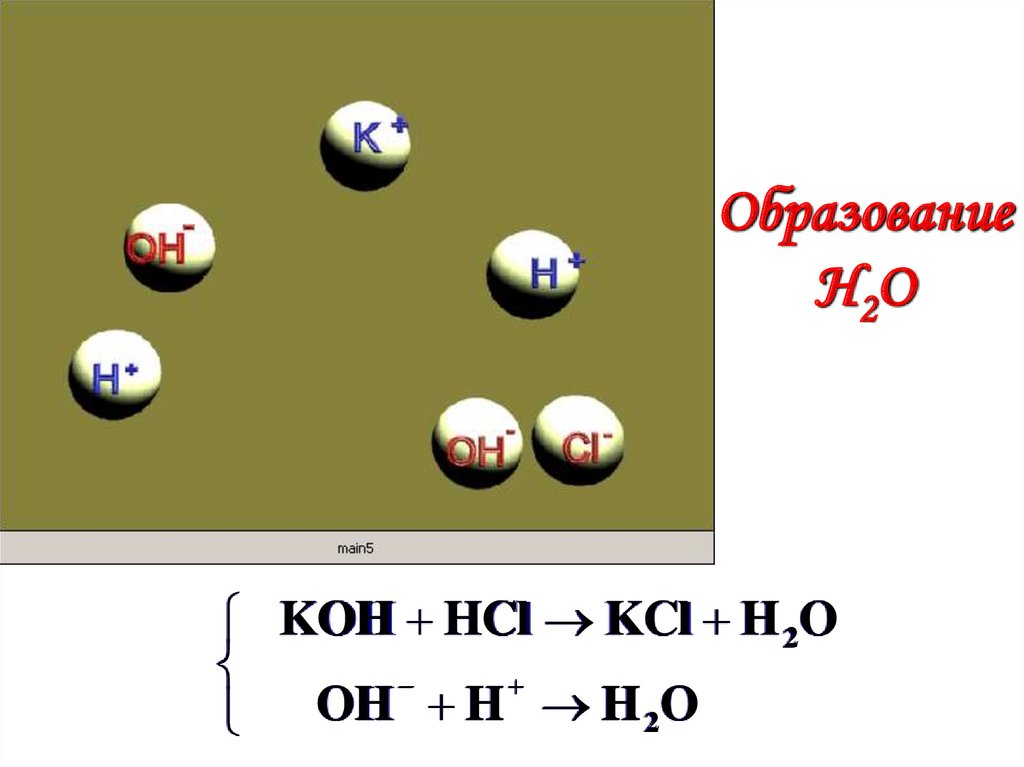
14.
ОбразованиеH 2O
KOH HCl KCl H 2O
OH H H 2O
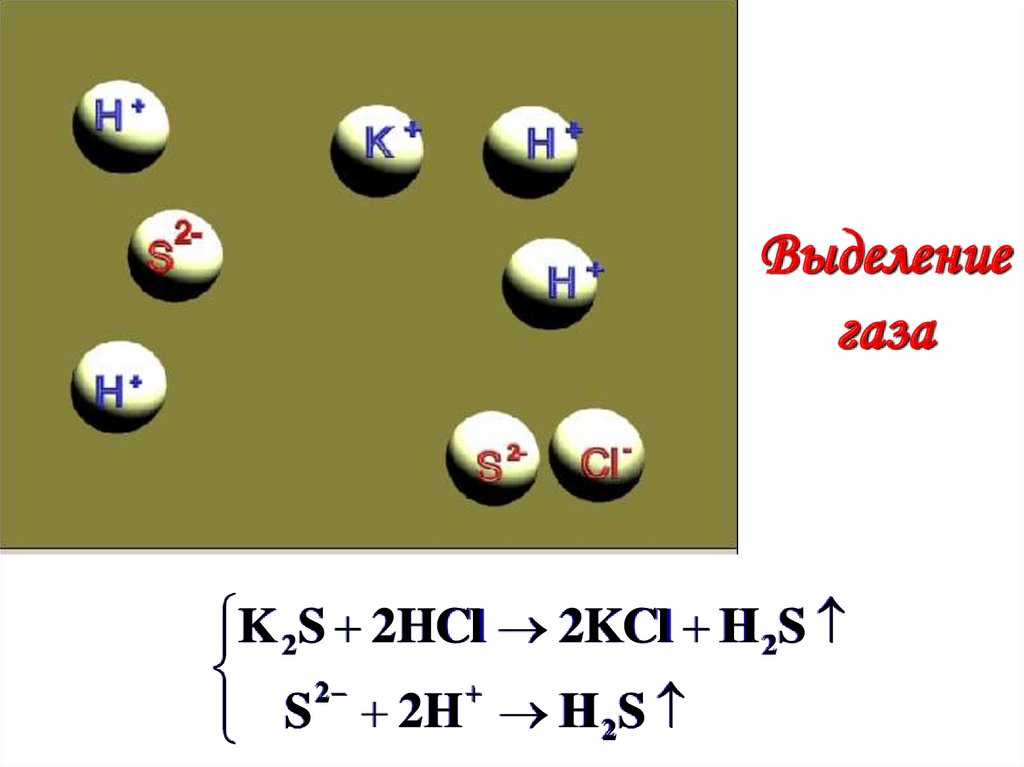
15.
Выделениегаза
K 2S 2HCl 2KCl H 2S
2
S 2H H 2S
16. Задания для закрепления
Страница 16Упр. 4, 5, 6, 7
Выполнить в тетради










 Химия
Химия








