Похожие презентации:
Типы химических реакций
1.
УРОК ХИМИИ В 8 КЛАССЕучитель МОУ «СОШ №84»
Сыщикова Анастасия Александровна
2.
3.
ТИПЫХИМИЧЕСКИХ
РЕАКЦИЙ
4.
Реакциизамещения
Реакции
соединения
Реакции
обмена
Реакции
разложения
Zn+H2SO4=ZnSO4+H2
К
А
Е
З
NaOH+HCl=NaCl+H2O
Б
Г
И
В
SO3+H2O=H2SO4
Ц
С
Д
У
4HNO3=4NO2 +O2 +2H2O
Ж
Щ
Н
Л
BaO+2HCl=BaCl2+H2O
Ф
Х
О
С
2Al+2H3PO4=2AlPO4+3H2
Т
М
Я
Р
H2CO3=CO2 +H2O
Ч
П
Ш
Ы
5.
Реакциизамещения
Реакции
соединения
Реакции
обмена
Реакции
разложения
Zn+H2SO4=ZnSO4+H2
К
А
Е
З
NaOH+HCl=NaCl+H2O
Б
Г
И
В
SO3+H2O=H2SO4
Ц
С
Д
У
4HNO3=4NO2 +O2 +2H2O
Ж
Щ
Н
Л
BaO+2HCl=BaCl2+H2O
Ф
Х
О
С
2Al+2H3PO4=2AlPO4+3H2
Т
М
Я
Р
H2CO3=CO2 +H2O
Ч
П
Ш
Ы
6.
Реакциизамещения
Реакции
соединения
Реакции
обмена
Реакции
разложения
Zn+H2SO4=ZnSO4+H2
К
А
Е
З
NaOH+HCl=NaCl+H2O
Б
Г
И
В
SO3+H2O=H2SO4
Ц
С
Д
У
4HNO3=4NO2 +O2 +2H2O
Ж
Щ
Н
Л
BaO+2HCl=BaCl2+H2O
Ф
Х
О
С
2Al+2H3PO4=2AlPO4+3H2
Т
М
Я
Р
H2CO3=CO2 +H2O
Ч
П
Ш
Ы
7.
Тема урока:«Классификация
кислот. Химические
свойства кислот в
свете теории
электролитической
диссоциации»
8.
Классификациякислот
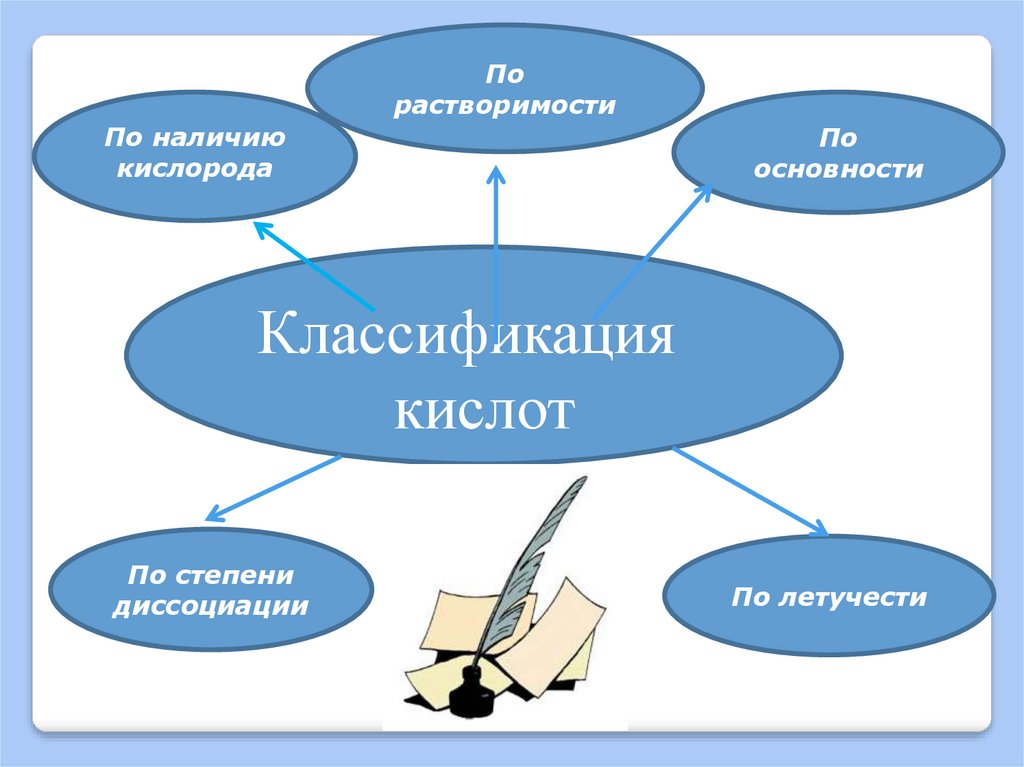
9.
Порастворимости
По наличию
кислорода
По
основности
Классификация
кислот
По степени
диссоциации
По летучести
10.
ИндикаторИндикатор
Кислотная
Кислотная
среда
среда
Нейтральная
Нейтральная
среда
среда
Щелочная
Щелочная
среда
среда
Фенол-фтелеин
Фенол-фтелеин
бесцветный
бесцветный
бесцветный
бесцветный
малиновый
малиновый
Метиловый
Метиловый
оранжевый
оранжевый
краснокраснорозовый
розовый
оранжевый
оранжевый
желтый
желтый
11.
Уравнения диссоциации кислотHCl
H2SO4
HSO4-
H+ + Cl-
H+ +HSO4H+ +SO42-
H2O +CO2
H2CO3
ДИССОЦИАЦИЯ
СИЛЬНЫХ
КИСЛОТ
H+ +HCO3-
ДИССОЦИАЦИЯ СЛАБОЙ КИСЛОТЫ
12.
Техника безопасности на уроках химии1) Все опыты нужно проводить строго на поддоне
2) Запрещается пробовать на вкус любые вещества.
3) В процессе работы необходимо следить, чтобы химические реактивы
не попадали на кожу лица и рук. Если это произошло, необходимо
промыть поверхность большим количеством воды и обработать
раствором соды (в случае попадания кислоты) или раствором борной
кислоты (в случае попадания щелочи).
4) Растворы необходимо наливать из сосудов так, чтобы при наклоне
этикетка оказывалась сверху (этикетку — в ладонь!).
5) Твердые сыпучие реактивы разрешается брать из склянок только с
помощью совочков, ложечек, шпателей, пробирок.
13.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ2) Взаимодействие с активными металлами
Кислота + Металл = Соль + Н2
14.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ2) Взаимодействие с активными металлами
Кислота + Металл = Соль + Н2
1) Zn + 2HCl = ZnCl2 +H2
2) Mg + H2SO4 = MgSO4 + H2
3)Cu + HCl =
15.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ3) Взаимодействие с основными оксидами
Кислота + Основный оксид = Соль + Н2О
16.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ3) Взаимодействие с основными оксидами
Кислота + Основный оксид = Соль + Н2О
1) CuO + 2HCl = CuCl2 + H2O
CuO + 2H+ + 2Cl- =Cu 2+ +2Cl- + H2O
CuO + 2H+ = Cu 2+ + H2O
2) ) CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ + SO4 2- =Cu 2+ +SO4 2- + H2O
CuO + 2H+ = Cu 2+ + H2O
17.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ4) Взаимодействие с основаниями
(реакция НЕЙТРАЛИЗАЦИИ)
Кислота + Основание = Соль + Н2О
18.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ4) Взаимодействие с основаниями
(реакция НЕЙТРАЛИЗАЦИИ)
Кислота + Основание = Соль + Н2О
1) 2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na+ +2OH- + 2H+ + SO4 2- = 2Na+ +SO4 2- + 2H2O
2OH- + 2H+ = 2H2O
2) CuSO4 +2NaOH = Na2SO4 + Cu(OH)2
Cu 2+ +SO4 2- + 2Na+ +2OH- = 2Na+ +SO4 2- + Cu(OH)2
Cu 2+ + 2OH- = Cu(OH)2
3) Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl- =Cu 2+ +2Cl- + 2H2O
Cu(OH)2 + 2H+ =Cu 2+ + 2H2O
19.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ5) Взаимодействие с солями
Кислота + Соль = новая Соль + новая Кислота
20.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ5) Взаимодействие с солями
1) Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O
2Na+ +CO3 2- + 2H+ + SO4 2- = 2Na+ +SO4 2- + CO2 + 2H2O
CO3 2- + 2H+ = CO2 + 2H2O
2) Na2SiO3 + 2HCl = 2NaCl + H2SiO3
2Na+ +SiO3 2- + 2H+ + 2Cl- =2Na+ +2Cl- + H2SiO3
SiO3 2- + 2H+ = H2SiO3
21.
МИНУТКА ОТДЫХА22.
23.
24.
25.
Подведем итоги:- Я узнал на уроке, что…
- Меня удивило…
- Я затруднился…
- У меня не получилось…
26.
Домашнеезадание:
П.38, № 4,5
стр. 214

























 Химия
Химия








