Похожие презентации:
Типы химических реакций
1.
Типы химическихреакций
2.
Цели занятиясистематизировать теоретические знания по теме
«Типы химических реакций»;
усовершенствовать практические навыки работы с
лабораторной посудой и реактивами;
развивать умения наблюдать, анализировать,
делать выводы по результатам выполненных
опытов;
развивать творческие способности, направленные
на активное применение приобретенных знаний;
развивать интерес к исследованию практического
применения химических знаний.
3.
Химическая разминка1. Что такое химические явления? Чем они
отличаются от физических?
2. Укажите известные вам признаки химических
реакций.
3. При каких условиях идут химические реакции?
4. Какие реакции относятся к реакциям
соединения, разложения, замещения,
обмена?
5. Быстрее идут гомогенные реакции или
гетерогенные? Почему?
4.
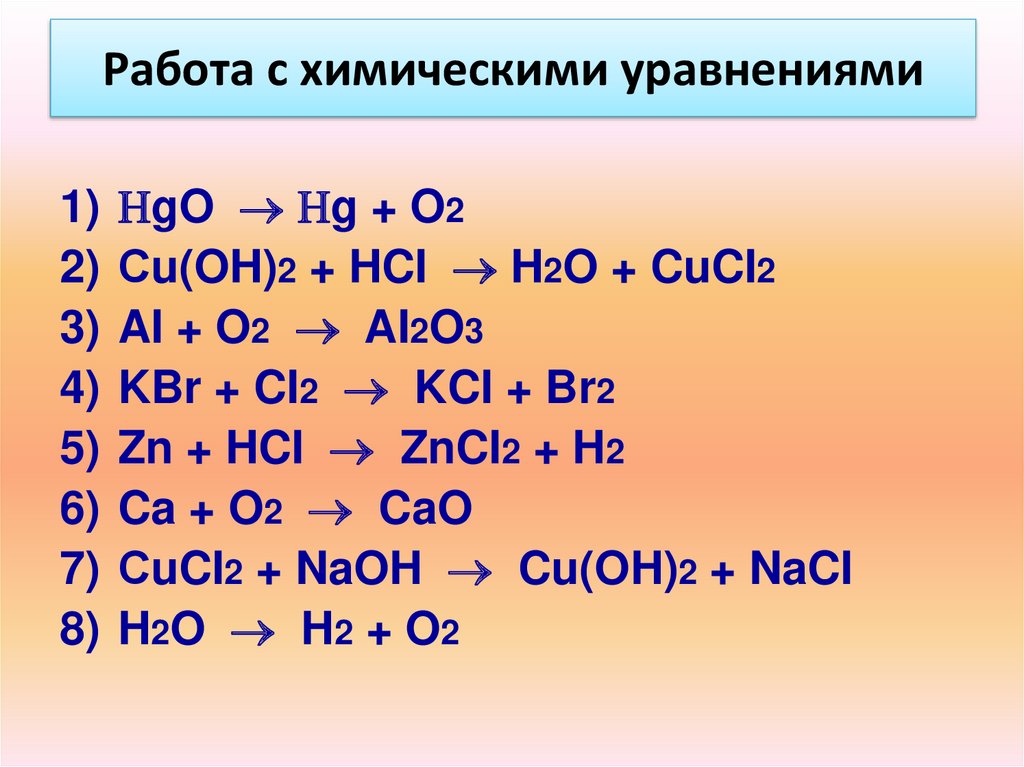
Работа с химическими уравнениями1)
2)
3)
4)
5)
6)
7)
8)
gO g + O2
Сu(OH)2 + HCI H2O + CuCI2
AI + O2 AI2O3
KBr + CI2 KCI + Br2
Zn + HCI ZnCI2 + H2
Ca + O2 CaO
СuCI2 + NaOH Cu(OH)2 + NaCI
H2O H2 + O2
5.
Реакции соединения• это такие реакции, при которых из двух и
более веществ образуется одно сложное
вещество.
4AI + 3O2 2AI2 O3
2Ca + O2 2CaO
6.
Реакции замещения• это такие реакции, в результате которых атомы
простого вещества замещают атомы одного из
элементов в сложном веществе.
2KBr + CI2 2KCI + Br2
Zn + 2HCI ZnCI2 + H2
7.
Реакции обмена• это такие реакции, при которых два
сложных вещества обмениваются
своими составными частями.
Сu(OH)2 + 2HCI 2H2O + CuCI2
СuCI2 + 2NaOH Cu(OH)2 + 2NaCI
8.
Реакции разложения• это такие реакции, при которых из одного
сложного вещества образуется несколько
новых веществ.
2 gO 2 g + O2
Появление ртутного «зеркала»
2H2O 2H2 + O2
9.
Экзотермические реакции• Реакции, протекающие с выделением теплоты
4Al+3O2=2Al2O3+Q
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г) + Q.
3Fe + 2O2 = Fe3O4
10.
Эндотермические реакции• химическая реакция, при которой происходит
поглощение теплоты.
CaCO3(кр) = CaO(кр) +CO2(г) – Q
2HgO(кр) = 2Hg(ж) + O2(г) – Q
2AgBr(кр) = 2Ag(кр) + Br2(г) – Q
11.
Гомогенные реакции• реакции, протекающие в системе, состоящей из одной
фазы (в однородной среде)
2NO(газ) + O2(газ) = 2NO2
2H2(газ) + O2(газ) = 2H2O
H2(газ) + Cl2(газ) = 2HCl
2KOH(раствор) + H2SO4(раствор) = K2SO4 + 2H2O
AgNO3(раствор) + HCl(раствор) = AgCl + HNO3
12.
Гетерогенные реакции• реакции, протекающие на границе раздела фаз.
Zn(тв.) + H2SO4(раствор) = ZnSO4 + H2
CaCO3(тв.) + 2HCl(раствор) = CaCl2 + H2O + CO2
2NaOH(раствор) + СO2(газ) = Na2CO3 + H2O
13.
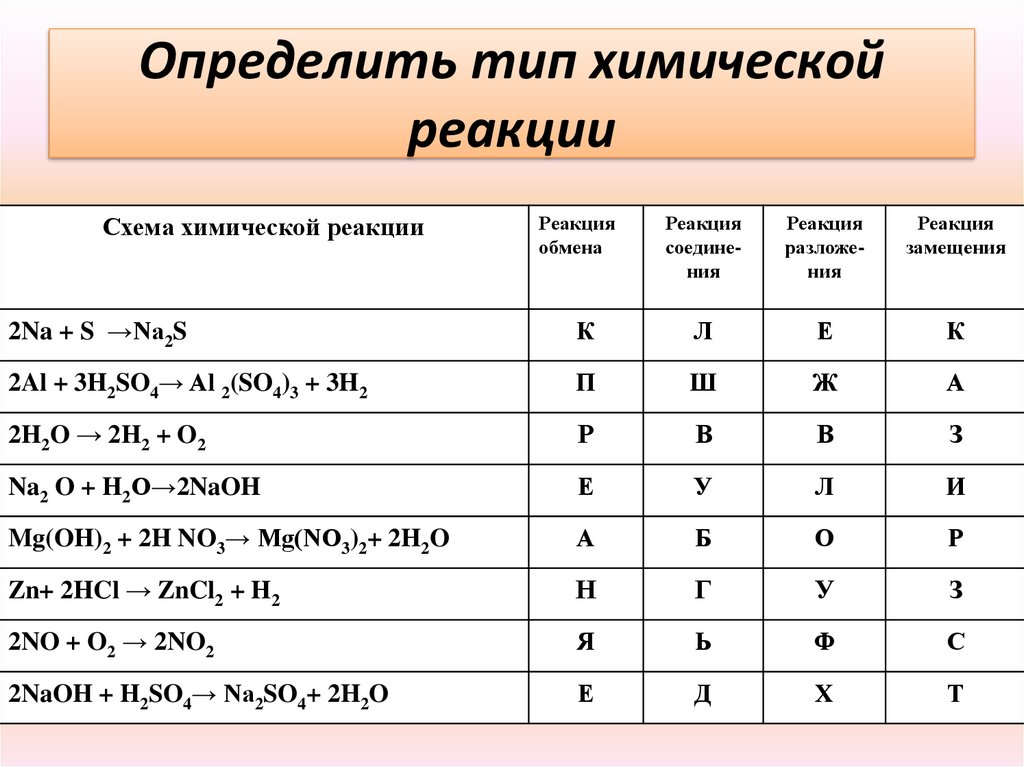
Определить тип химическойреакции
Схема химической реакции
Реакция
обмена
Реакция
соединения
Реакция
разложения
Реакция
замещения
2Na + S →Na2S
К
Л
Е
К
2Al + 3H2SO4→ Al 2(SO4)3 + 3H2
П
Ш
Ж
А
2H2O → 2H2 + O2
Р
В
В
З
Na2 O + H2O→2NaOH
Е
У
Л
И
Mg(OH)2 + 2H NO3→ Mg(NO3)2+ 2H2O
А
Б
О
Р
Zn+ 2HCl → ZnCl2 + H2
Н
Г
У
З
2NO + O2 → 2NO2
Я
Ь
Ф
С
2NaOH + H2SO4→ Na2SO4+ 2H2O
Е
Д
Х
Т
14.
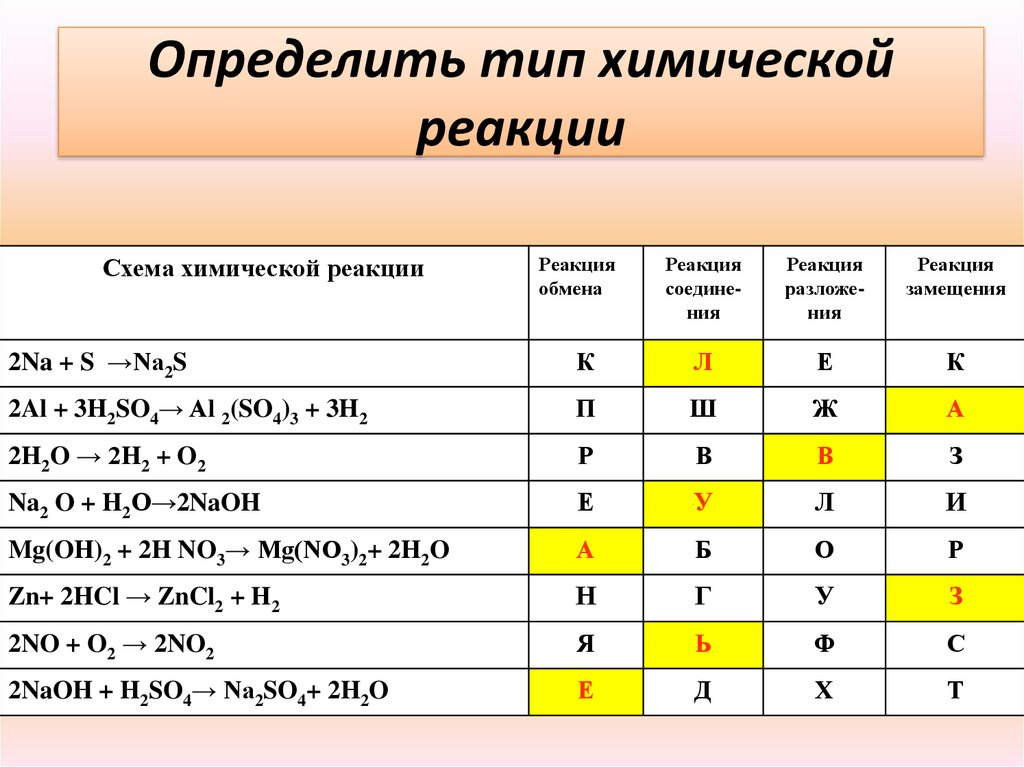
Определить тип химическойреакции
Схема химической реакции
Реакция
обмена
Реакция
соединения
Реакция
разложения
Реакция
замещения
2Na + S →Na2S
К
Л
Е
К
2Al + 3H2SO4→ Al 2(SO4)3 + 3H2
П
Ш
Ж
А
2H2O → 2H2 + O2
Р
В
В
З
Na2 O + H2O→2NaOH
Е
У
Л
И
Mg(OH)2 + 2H NO3→ Mg(NO3)2+ 2H2O
А
Б
О
Р
Zn+ 2HCl → ZnCl2 + H2
Н
Г
У
З
2NO + O2 → 2NO2
Я
Ь
Ф
С
2NaOH + H2SO4→ Na2SO4+ 2H2O
Е
Д
Х
Т
15.
Михаил Васильевич ЛомоносовАнтуан Лоран Лавуазьє
16.
Тест по теме: «Типы химических реакций»1-й уровень
1. Уравнение реакции замещения:
а) Zn + 2HCl ––> ZnCl2 + H2 ,
б) ZnO + H2SO4 ––> ZnSO4 + H2O,
в) Сu(OH)2 ––> CuО + H2O,
г) Fe + S ––> FeS.
2. В уравнении реакции, схема которой
Fe2O3 + H2 ––> Fe + H2O
Коэффициент перед формулой железа равен:
а) 3,
б) 6,
в) 2,
г) 1.
3. Правильные коэффициенты в уравнении реакции:
а) 2MgCO3 ––> 2MgO + CO2,
б) 2Al + 6HCI ––> 2AlCl3 +H2,
в) 2NH4Cl ––> 2NH3 + HCl,
г) 2NaOH + SO3 ––> Na2SO4 + H2O.
4. Реакции, в результате которых из одного сложного вещества образуется
несколько более простого состава относятся к:
а) реакциям обмена,
б) реакциям замещения,
в) реакциям соединения,
г) реакциям разложения.
17.
Тест по теме: «Типы химических реакций»2-й уровень
1. Взаимодействие соляной кислоты с оксидом железа (II)
относится к реакции:
а) разложения,
б) замещения,
в) соединения,
г) обмена.
2. Сумма коэффициентов в уравнении реакции, схема которой
Al + HCl ––> AlCl3 + H2 равна:
а) 6,
б) 8,
в) 10,
г) 13.
3. Элементом, «Э» в схеме уравнения реакции
Mg + HCl ––> MgCl2 + Э
а) H2, б) Cl2, в) Mg, г) O.
4. В уравнении реакции: Ca(OH)2 + 2HNO3 ––> Ca(NO3)2 + … :
а) H2,
б) 2H2,
в) H2O, г) 2H2O.
18.
Дифференцированная самостоятельнаяработа по тестам
1-й уровень:
1-а; 2-в; 3-б; 4-г;
2-й уровень:
1-г; 2-г; 3-а; 4-г.
19.
Молодцы ребята!Вы сегодня хорошо поработали!
















 Химия
Химия








