Похожие презентации:
Периодическая система химических элементов Д.И.Менделеева I
1.
Периодическая система химических элементов Д.И.МенделееваI
1
2
3
III
1
Н
2
Li
3
Na 11 Mg12 Al
4
4
5
6
5
7
8
6
7
II
Группы элементов
V
VI
VII
IV
VIII
Не 2
1
1,00794
4,0026
водород
3
6,941
литий
22,9898
натрий
К
19
39,098
калий
гелий
Ве
4
9,0121
медь
5
10,811
бериллий бор
24,312
магний
65,39
6
12,011
углерод
26,9815
28,086
N
7
14,0067
азот
Р
15
30,9738
алюминий кремний фосфор
40,078 44,955
кальций
С
13 Si 14
Са20 21 Sc
29 Сu 30 Zn
63,546
В
скандий
Ti 23 V
22
47,88
титан
50,941
ванадий
О
F
8
16,999
9
кислород
фтор
S
Cl
16
32,064
сера
24
51,996
18,998
17
35,453
хлор
69,723
72,61
74,921
германий мышьяк
20,179
неон
Ar 18
39,948
аргон
Cr 25Mn 26 Fe 27 Co 28 Ni
хром
54,938
марганец
Ga 31 Ge32 As 33 Se 34 Br
цинк галлий
Ne 10
78,96
35
79,904
селен
бром
55,847
железо
Kr
58,933
кобальт
107,868
серебро
Cs
87,62
112,411
кадмий
88,905
91,224
114,82
индий
92,906
118,710
олово
95,94
121,75
сурьма
55 Ba 56 57 71 72 Hf 73
Ta
97,907
127,60
теллур
74
W
иод
83,80
криптон
75
101,07
126,904
102,905
9
196,966
10
Fr
золото
137,327
200,59
ртуть
87 Ra 88
223,019
франций
204,383
180,947
207,2
183,85
208,98
186,207
208,98
190,2
Db Jl
Rf
Ac-Lr
радий
дубний жолиотий
261
**
262
263
Bh
резерфордий
262
борий
192?22
иридий
222,017
таллий
свинец
висмут
полоний астат
радон
89
103
104
105
106
107
108
226,025
106,42
палладий
131,29
Re 76 Os 77 Ir
209,99
46 Pd
ксенон
La-Lu гафний тантал вольфрам рений осмий
цезий
барий
*
79 Au 80 Hg Tl 81 Pb 82 Bi 83 Po 84 At 85 Rn 86
132,905
178,49
никель
36
Rb 37 Sr 38 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh
рубидий стронций
иттрий цирконий
ниобий молибден технеций
рутений
родий
47 Ag 48 Cd In 49 Sn 50 Sb 51 Te 52 I
53 Xe 54
85,467
58,69
Hn
265
ганий
Mt109
266
мейтнерий
78
Pt
195,08
платина
2.
Тема: " Сравнительнаяхарактеристика
неметаллов 4 – А группы.
Углерод"
3.
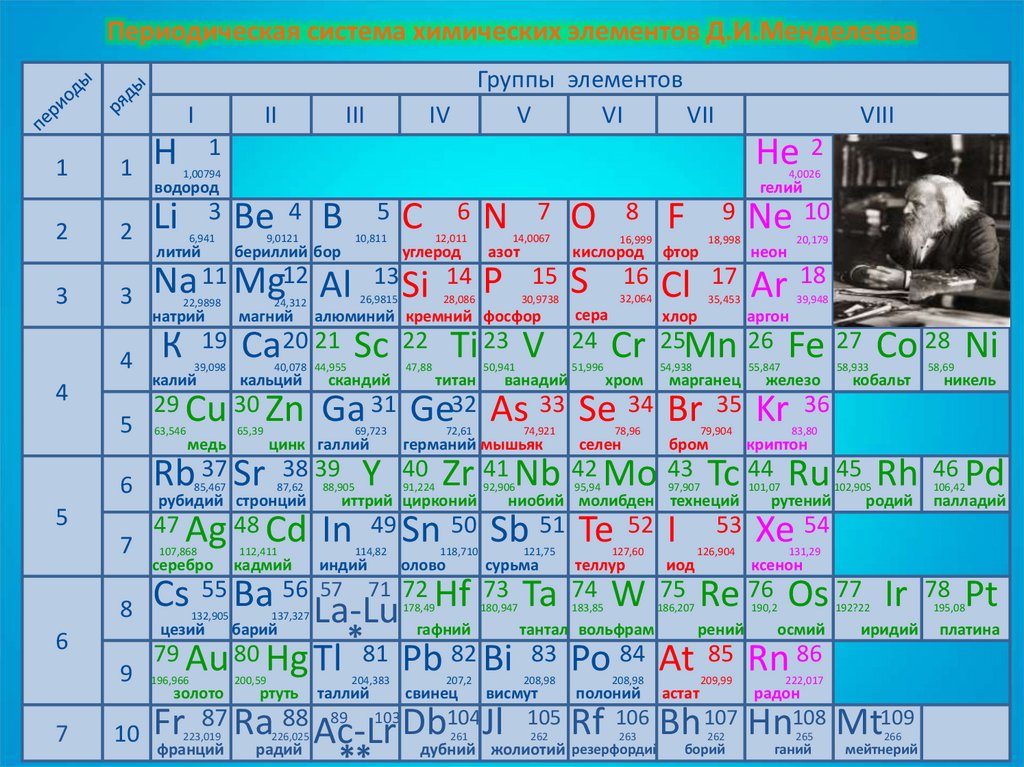
Периодическая система химических элементов Д.И.МенделееваГруппы элементов
I
1
1
2
2
3
3
II
12
5
7
8
6
9
7
10
V
1
4
5
IV
VI
VII
VIII
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА
4
6
III
+6
0
-
-
2 е, 4 е
2 Углерод – основа всего
живого на Земле.
3 Степень окисления
+4, +2, 0,- 4.
4 В природе встречается как
в свободном виде (алмаз,
графит), так и в связанном
состоянии
( углекислый газ,
карбонаты, уголь, нефть и
т.д.)
4.
1. Электронное строение2. Аллотропия
3. Химические свойства
4. Применение
5. Проверка знаний
4
5. Углерод
1. Электронное строение12
0
2p2
+6
2 s2
2
4
1 s2
6.
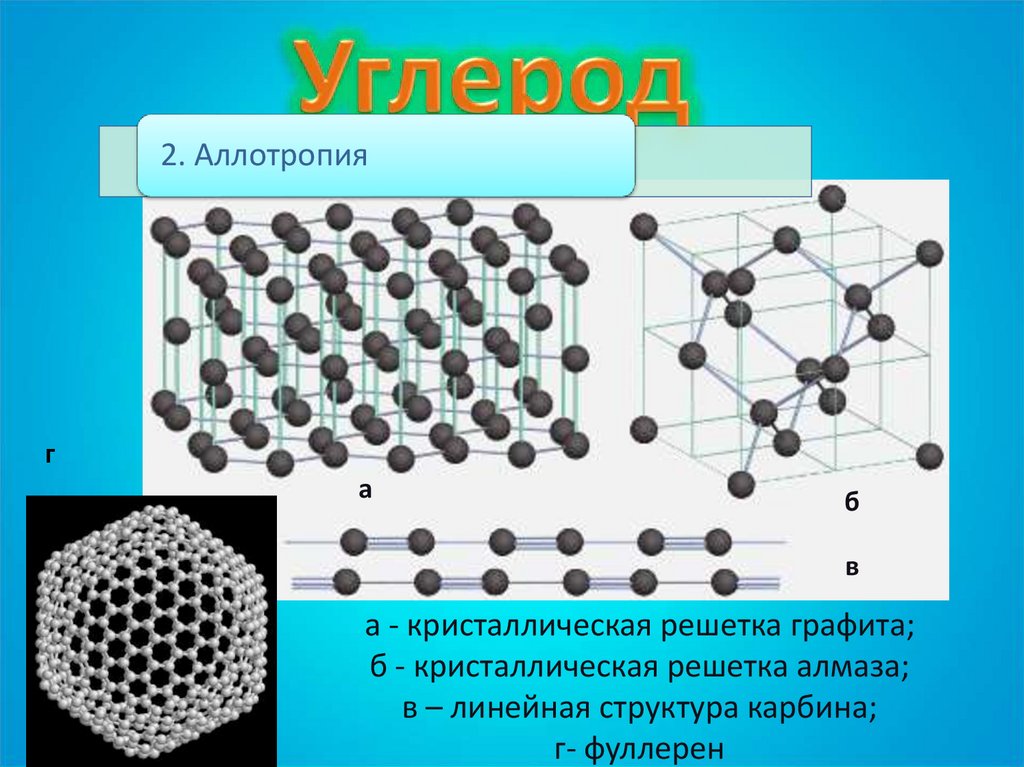
2. Аллотропияг
а
б
в
а - кристаллическая решетка графита;
б - кристаллическая решетка алмаза;
в – линейная структура карбина;
г- фуллерен
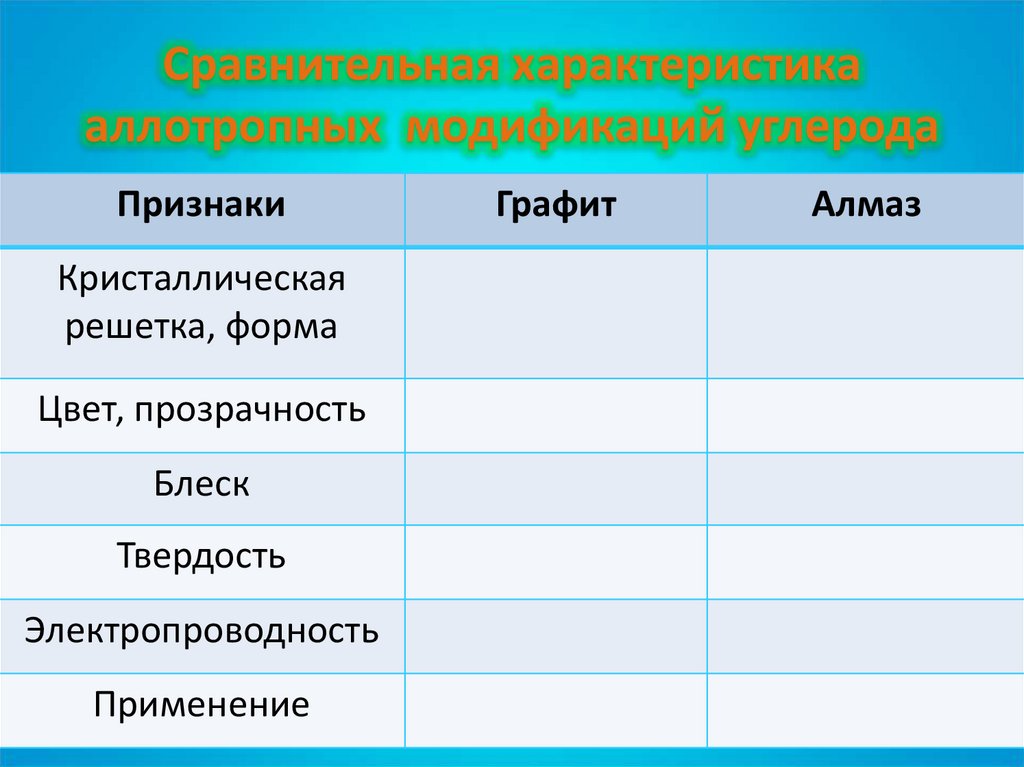
7. Сравнительная характеристика аллотропных модификаций углерода
ПризнакиКристаллическая
решетка, форма
Цвет, прозрачность
Блеск
Твердость
Электропроводность
Применение
Графит
Алмаз
8.
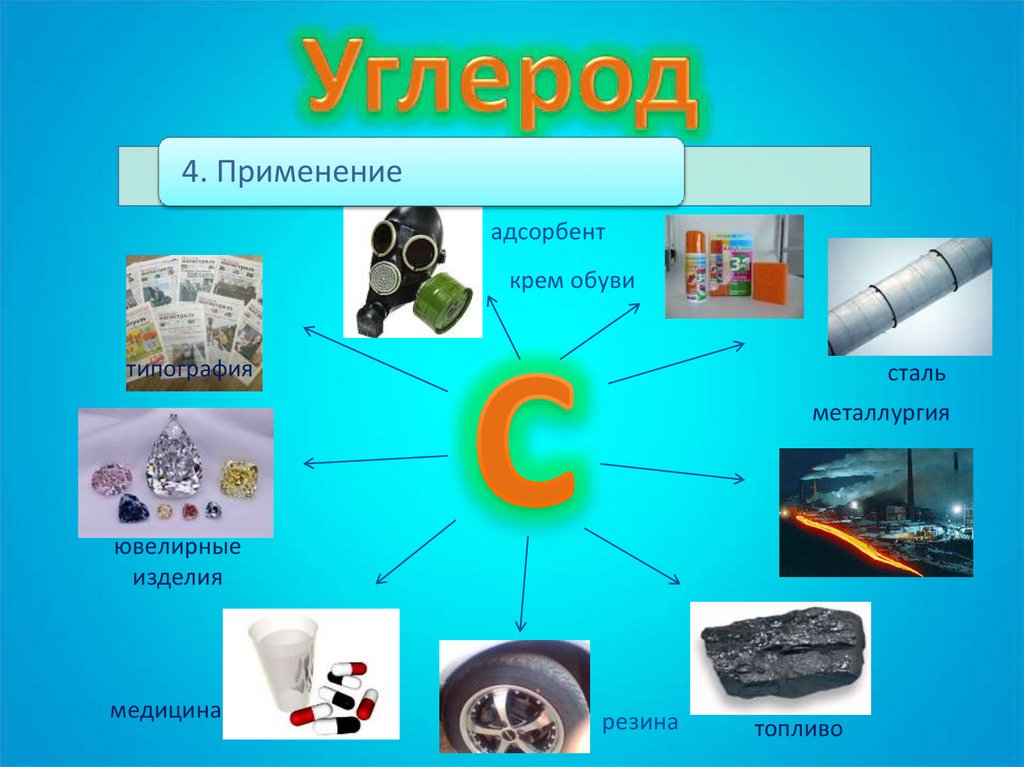
4. Применениеадсорбент
крем обуви
типография
сталь
металлургия
ювелирные
изделия
медицина
резина
топливо




 Химия
Химия








