Похожие презентации:
Периодический закон и периодическая система химических элементов Д.И.Менделеева
1. Проверка знаний
1 вариантВычислите массовые
доли химических
элементов в веществе
На «3» – «4»
2 вариант
Вычислите массовые
доли химических
элементов в веществе
На «3» – «4»
CuSO4
KNO3
На «5»
На «5»
Al(ClO4)3
Al(NO3)3
2.
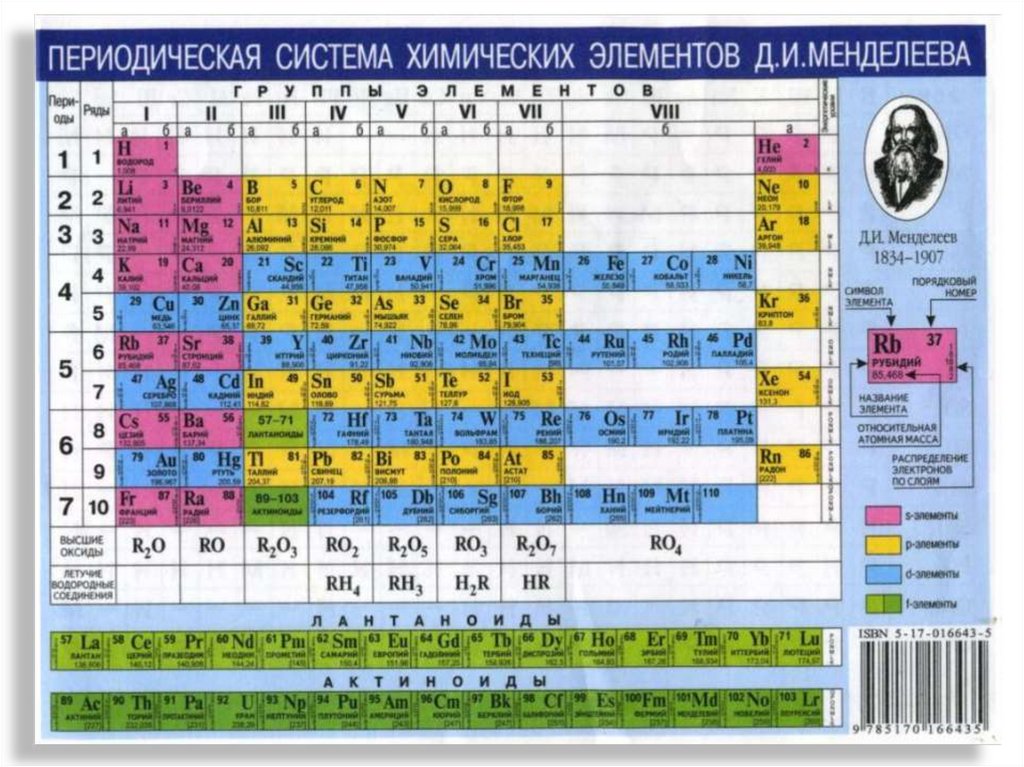
3. В 1869 году Д.И.Менделеев создал Периодическую систему
4. Периодический закон и периодическая система химических элементов Д.И.Менделеева
5.
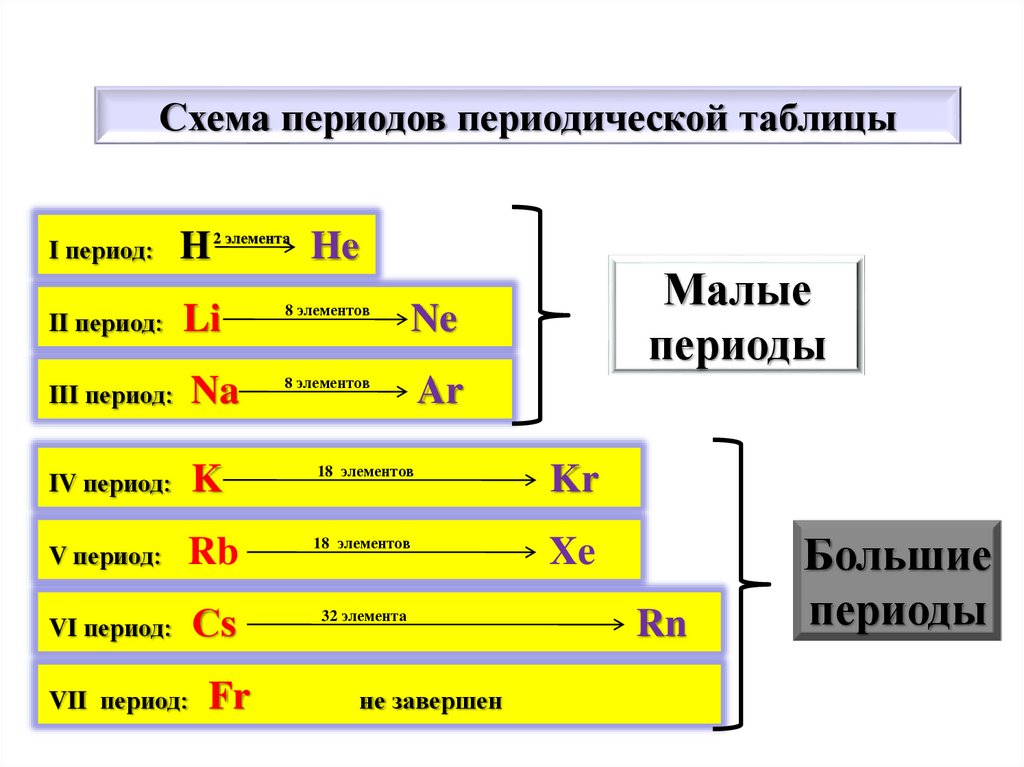
Схема периодов периодической таблицыI период:
H
2 элемента
He
8 элементов
Малые
периоды
II период:
Li
III период:
Na
IV период:
K
18 элементов
Kr
V период:
Rb
18 элементов
Xe
VI период:
Сs
32 элемента
VII период:
Fr
Ne
8 элементов
Ar
не завершен
Rn
Большие
периоды
6.
Лантаноиды58
60
59
Сe
Pr
Церий
61
Nd
Празеодим
62
Pm
Неодим
63
Sm
Прометий
Самарий
64
66
65
Eu
Gd
Европий
Гадолиний
Tb
67
Dy
Тербий
Ho
Диспрозий
Гольмий
68
Er
Эрбий
69
Tm
Тулий
70
Yb
Иттербий
71
Lu
Лютеций
Актиноиды
90
Th
Торий
91
92
Pa
U
Протактиний
Уран
93
94
Np
Pu
Нептуний
Плутоний
95
96
Am Cm
Америций
Кюрий
97
98
Bk
Берклий
Cf
99
Es
Калифорний Эйнштейний
Термины «лантаноиды» и
«актиноиды»
были предложены в 1948 году
профессором ЛГУ
С.А.Щукаревым
100
Fm
Фермий
101
Md
Менделевий
102
No
Нобелий
103
Lr
Лоуренсий
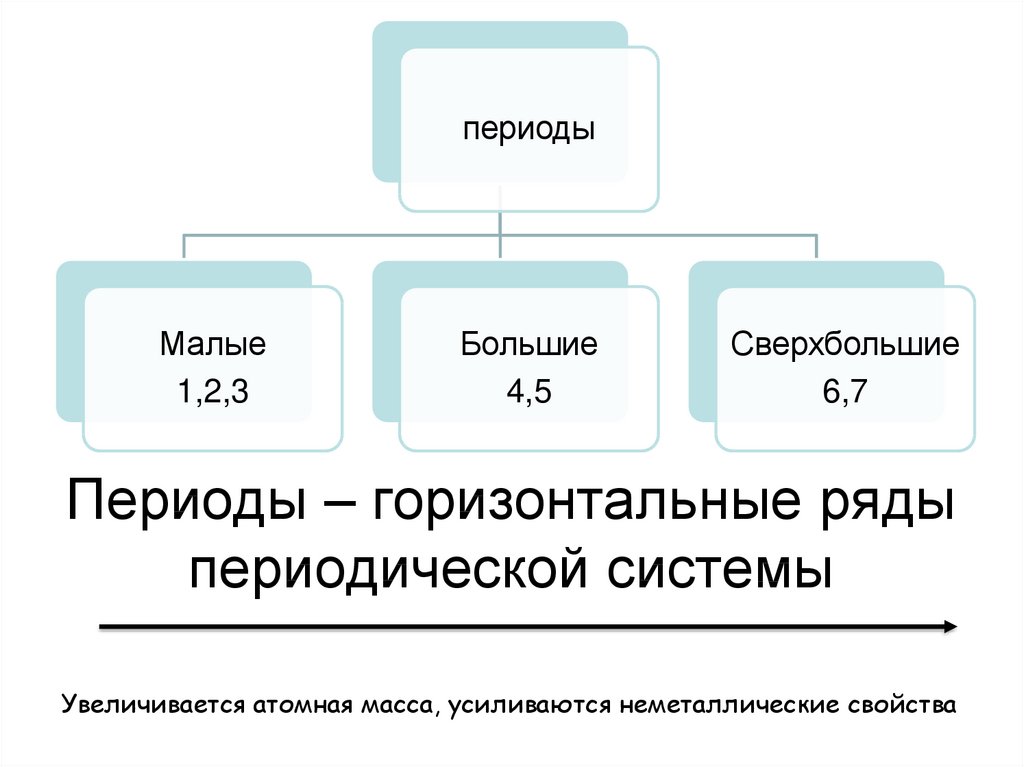
7. Периоды – горизонтальные ряды периодической системы
периодыМалые
1,2,3
Большие
4,5
Сверхбольшие
6,7
Периоды – горизонтальные ряды
периодической системы
Увеличивается атомная масса, усиливаются неметаллические свойства
8.
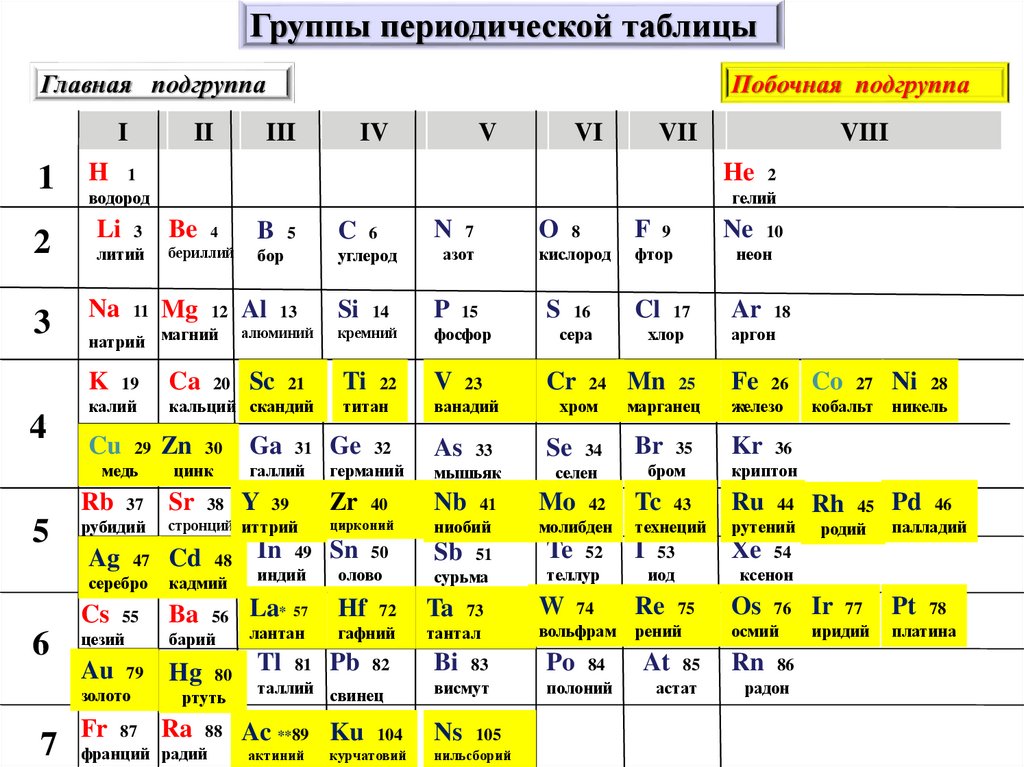
Группы периодической таблицыГлавная подгруппа
I
1
II
3
Na
3
литий
19
калий
Cu
29
медь
Rb
37
рубидий
Ag
47
серебро
VI
VII
Be
4
бериллий
B
5
бор
Mg
Ca
20 Sc 21
кальций скандий
Zn
30
цинк
Sr
Ba
Au
Hg
38
Ga
31
галлий
Y
39
стронций иттрий
Cd 48 In 49
индий
кадмий
55
цезий
Fr
VIII
2
гелий
Cs
79
золото
7
V
He
12 Al 13
алюминий
натрий магний
11
K
6
IV
1
водород
Li
5
III
H
2
4
Побочная подгруппа
56
барий
80
ртуть
87 Ra 88
франций радий
La* 57
лантан
6
углерод
N
O
Si
P
15
фосфор
S
V
23
ванадий
32
германий
Zr
C
14
кремний
Ti
22
титан
Ge
40
8
кислород
81 Pb 82
таллий свинец
Ac **89 Ku
104
курчатовий
10
неон
Mn
Fe
As
Se
Br
Kr
Nb
Mo
42
молибден
Te 52
теллур
Tc
43
технеций
I 53
иод
W
33
мышьяк
Sb
72
гафний
Ne
Cr
Sn
Hf
9
фтор
Ar
цирконий
50
олово
F
Cl
41
ниобий
Tl
актиний
7
азот
51
сурьма
Ta
73
тантал
Bi
83
висмут
Ns
105
нильсборий
16
сера
24
хром
34
селен
74
вольфрам
Po
84
полоний
17
хлор
18
аргон
Co
27
кобальт
Ni
Ru
44
рутений
Xe 54
ксенон
Rh
Pd
Re
Os
Ir
Pt
At
Rn
25
марганец
35
бром
75
рений
85
астат
26
железо
28
никель
36
криптон
76
осмий
86
радон
45
родий
77
иридий
46
палладий
78
платина
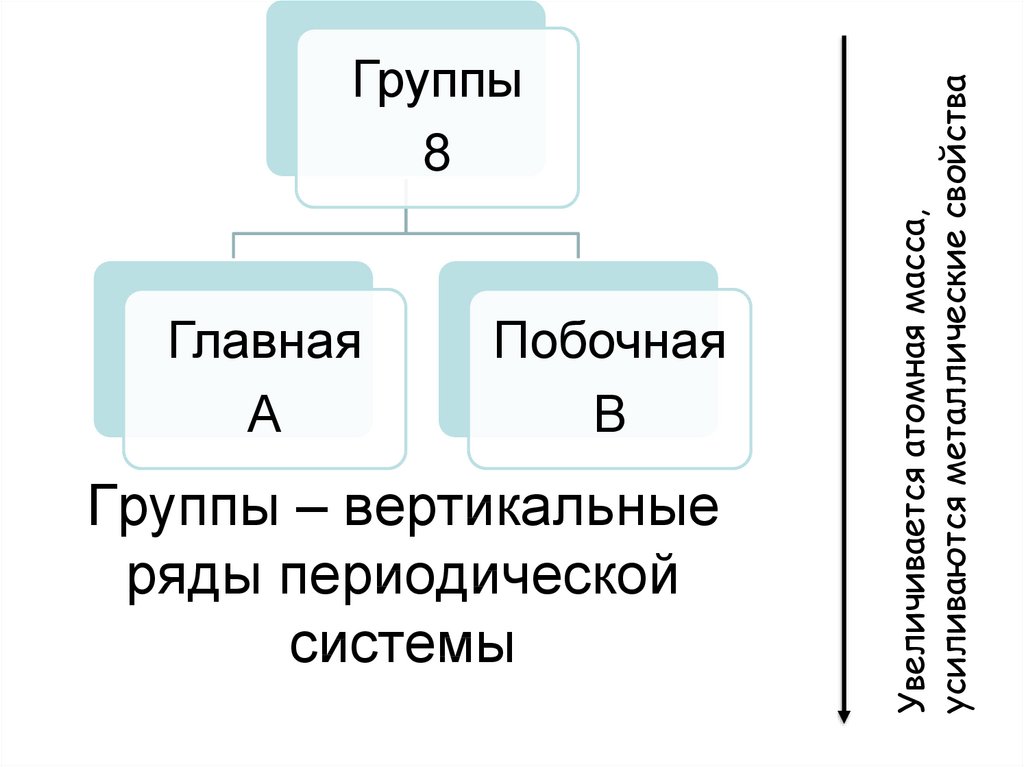
9. Группы – вертикальные ряды периодической системы
ГлавнаяА
Побочная
В
Группы – вертикальные
ряды периодической
системы
Увеличивается атомная масса,
усиливаются металлические свойства
Группы
8
10. Периодический закон
Свойствахимических
элементов, а также
образуемых ими
простых и сложных
веществ находится в
периодической
зависимости от
относительных
атомных масс
элементов.
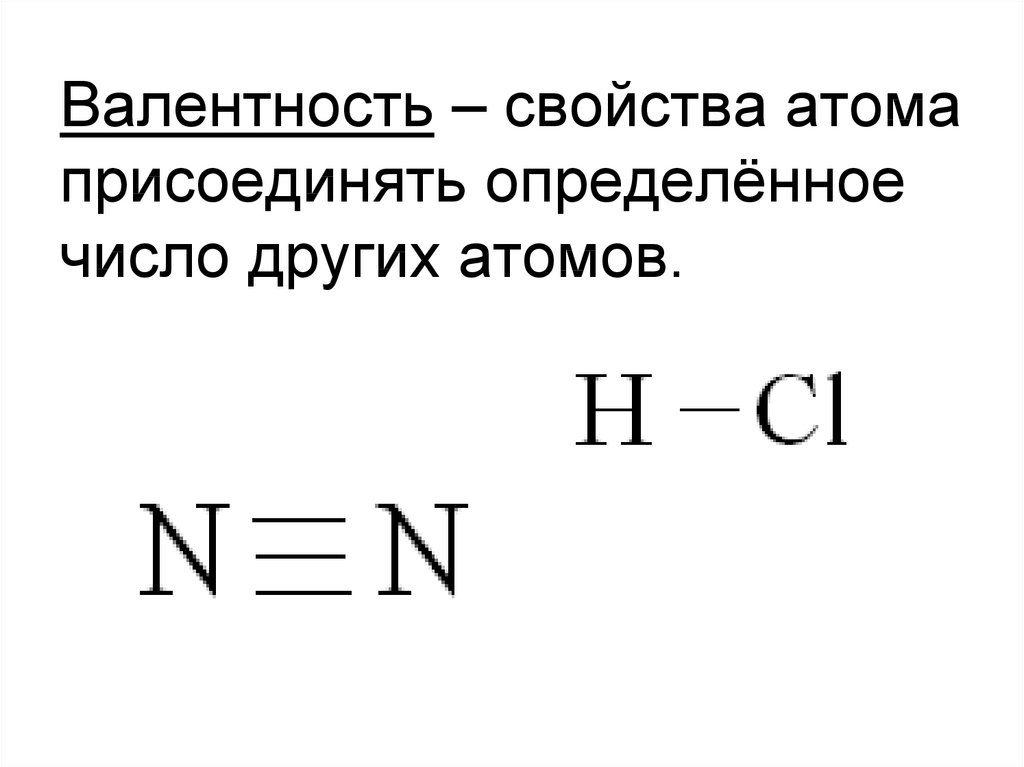
11.
Валентность – свойства атомаприсоединять определённое
число других атомов.
12.
Правила определения валентности (В)1. В Водорода – I
2. В Кислорода – II
3. В Металлов главных подгрупп =
номеру группы
4. В Металлов побочных подгрупп –
переменная. Высшая =номеру группы
5. В Неметаллов высшая = номеру
группы, низшая = 8 - номер группы
13.
Определите высшую валентностьAl
Zn
Mg
Si
P
Li
N
Cl
Определите низшую валентность
Cl
N
C
S
P
O
F
14.
Определение валентности поформуле
BaO; Ag2O; SnO2; SO3; MnO; PbO2;
N2O; CrO3; Cr2O3; Mn2O7; Cu2O;
P2O5; Al2O3; CO2; Сl2O5; Cl2O.
15. Домашнее задание
Параграф 12 повторитьПараграф 13 упр. 3,4 стр. 60
Выучить правила определения
валентности









 Химия
Химия








