Похожие презентации:
Кислород как вещество
1.
ЗадачаВ четырёх одинаковых закрытых пробками колбах
находятся:
воздух, азот, кислород, углекислый газ.
Как их можно распознать?
?
Воздух
?
Угл. газ
?
Кислород
?
Азот
2.
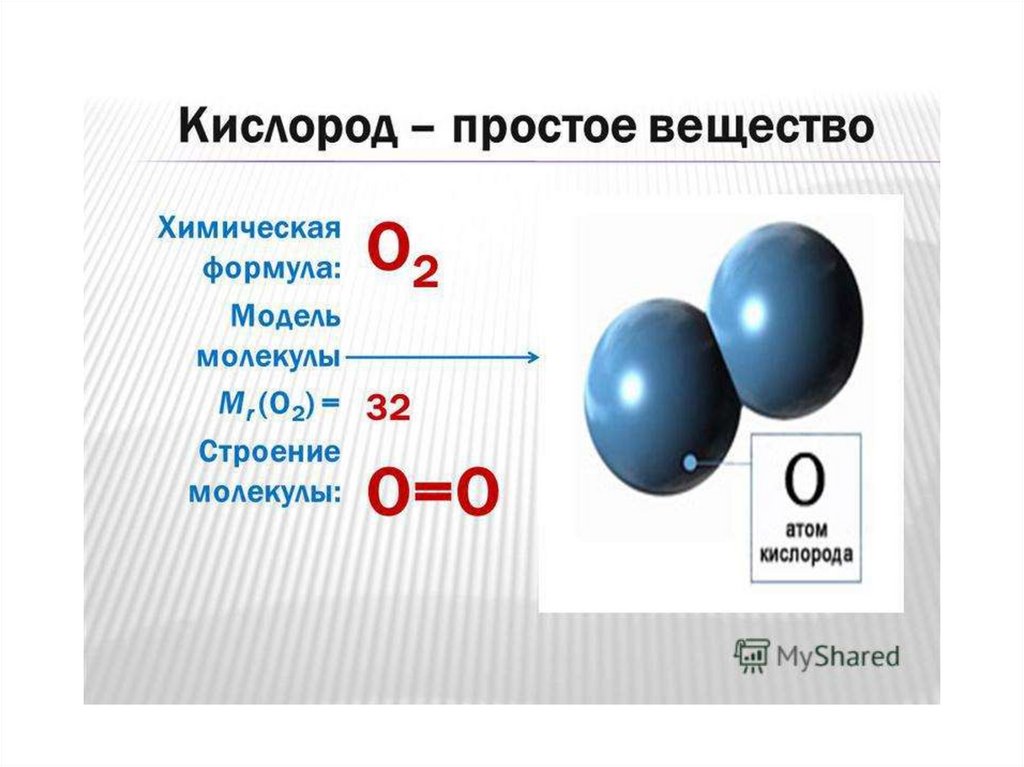
Кислород как вещество3.
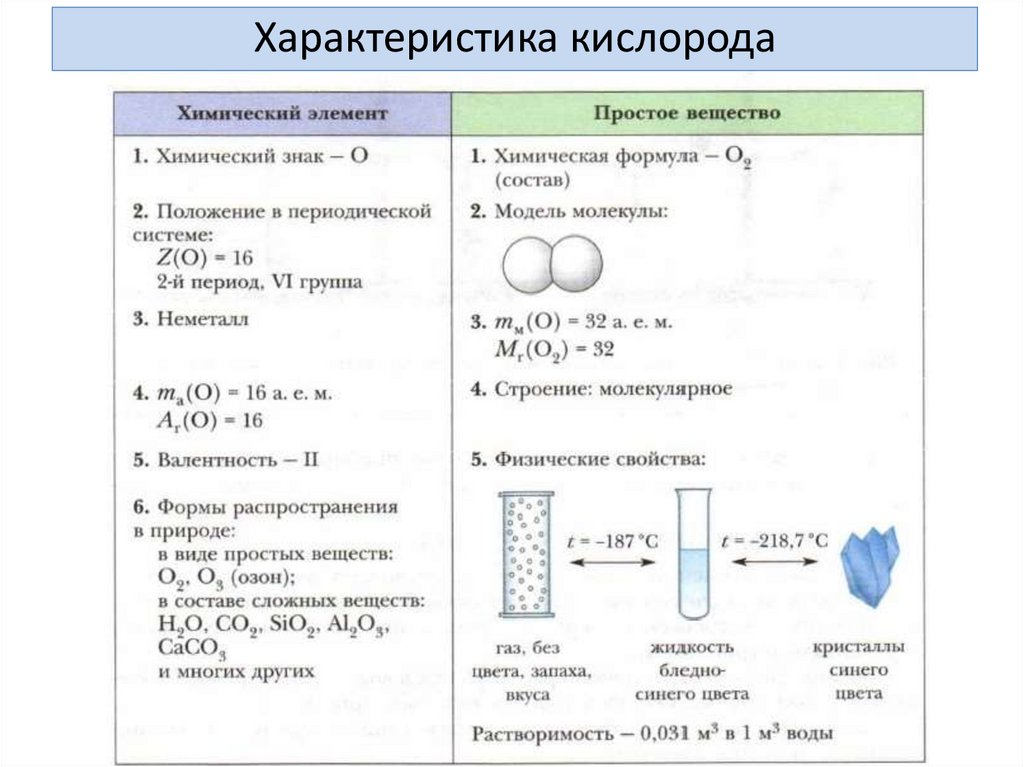
Характеристика кислорода как вещества1. Строение молекулы кислорода
2. Распространение вещества в природе.
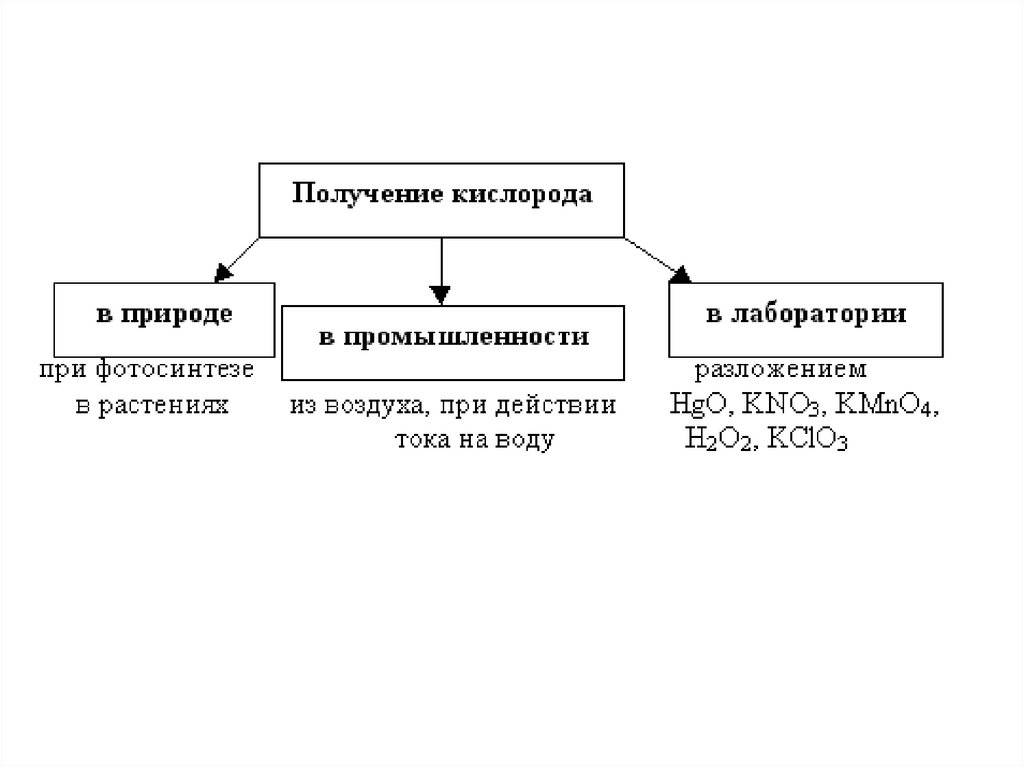
3. Способы получения кислорода в лаборатории и
промышленности (уравнения реакций)
4. Физические свойства кислорода
5. Химические свойства кислорода:
-взаимодействие с простыми веществами (уравнения
реакций);
-взаимодействие со сложными веществами (уравнения
реакций);
6. Значение кислорода.
7. Применение кислорода.
4.
5.
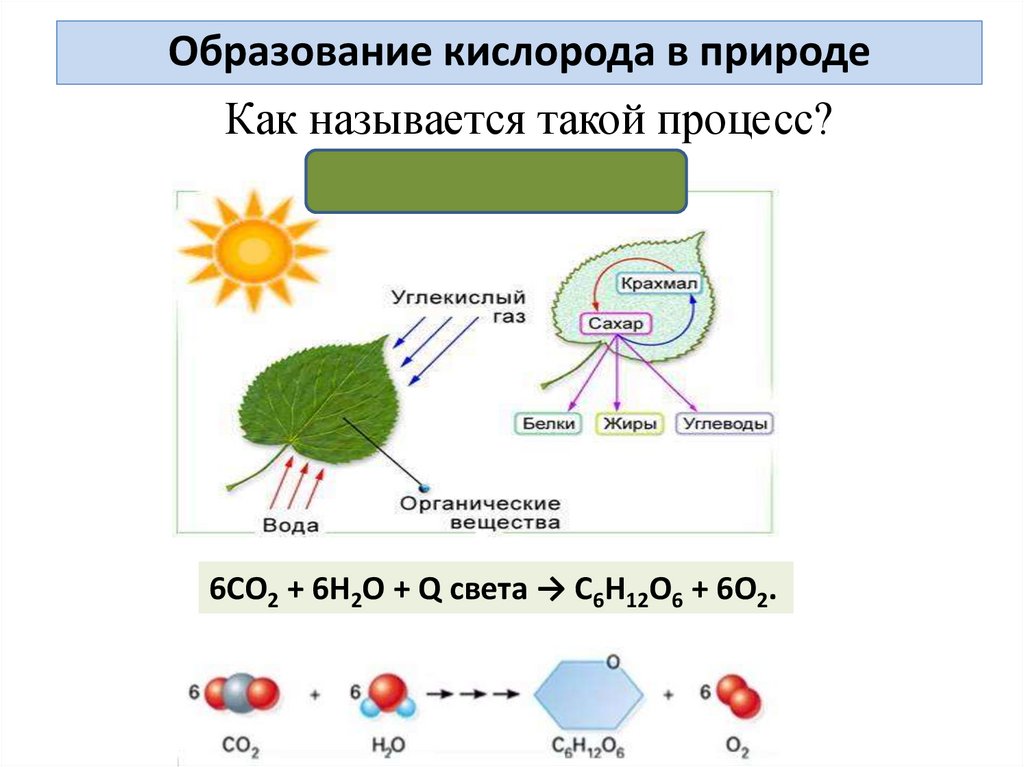
Образование кислорода в природеКак называется такой процесс?
6СО2 + 6Н2О + Q света → С6Н12О6 + 6О2.
6.
7.
Получение кислорода в промышленности1)
В промышленности – из жидкого воздуха.
жидкий кислород
8.
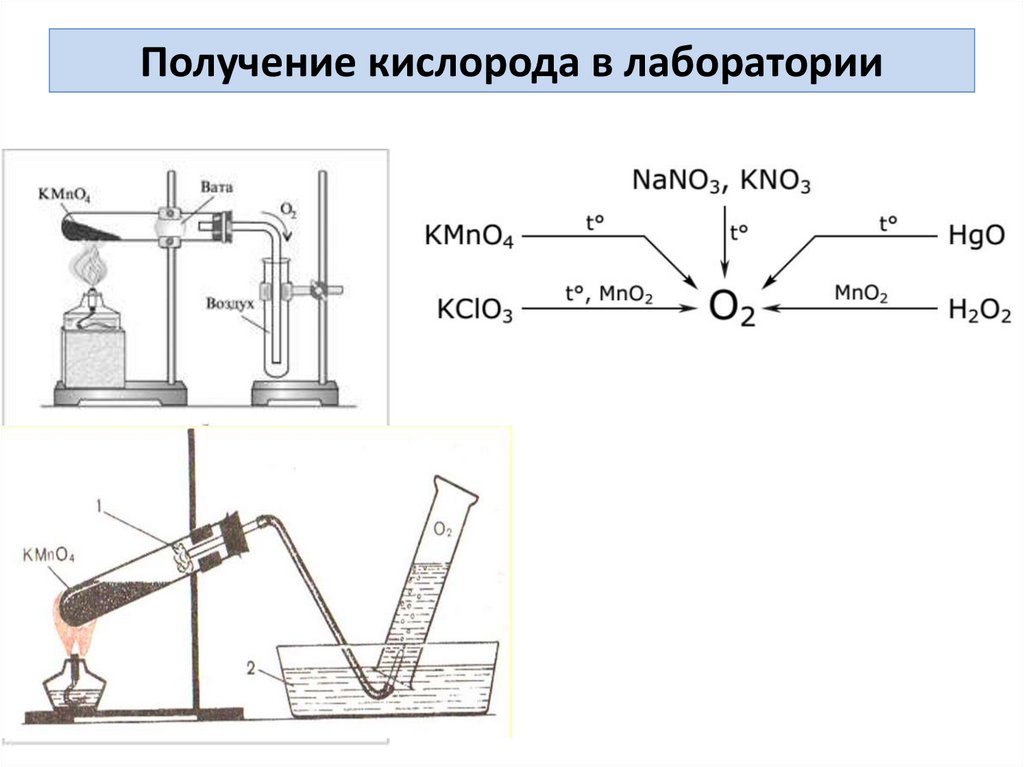
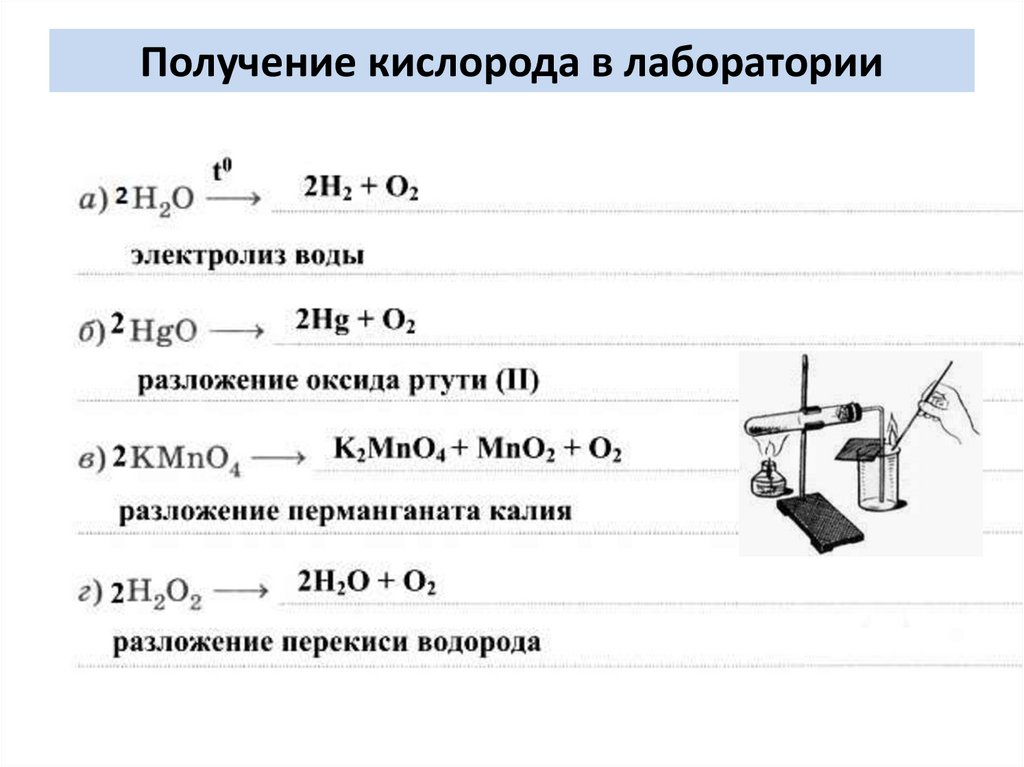
Получение кислорода в лаборатории9.
Способы получения кислородаРазложение перманганата калия при нагревании:
2KMnO4 –t 200 K2MnO4 + MnO2 + O2
Нагрев KMnO4
Проверка собравшегося
кислорода
10.
Получение кислорода в лаборатории11.
ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДАКислород – газ, без цвета и запаха,
мало растворим в воде –
в 100 объемах воды при 20 °C
растворяется 3,1 объема кислорода.
Кислород немного тяжелее воздуха.
Температура кипения – -183 °C,
температура плавления – -219 °C.
16
12.
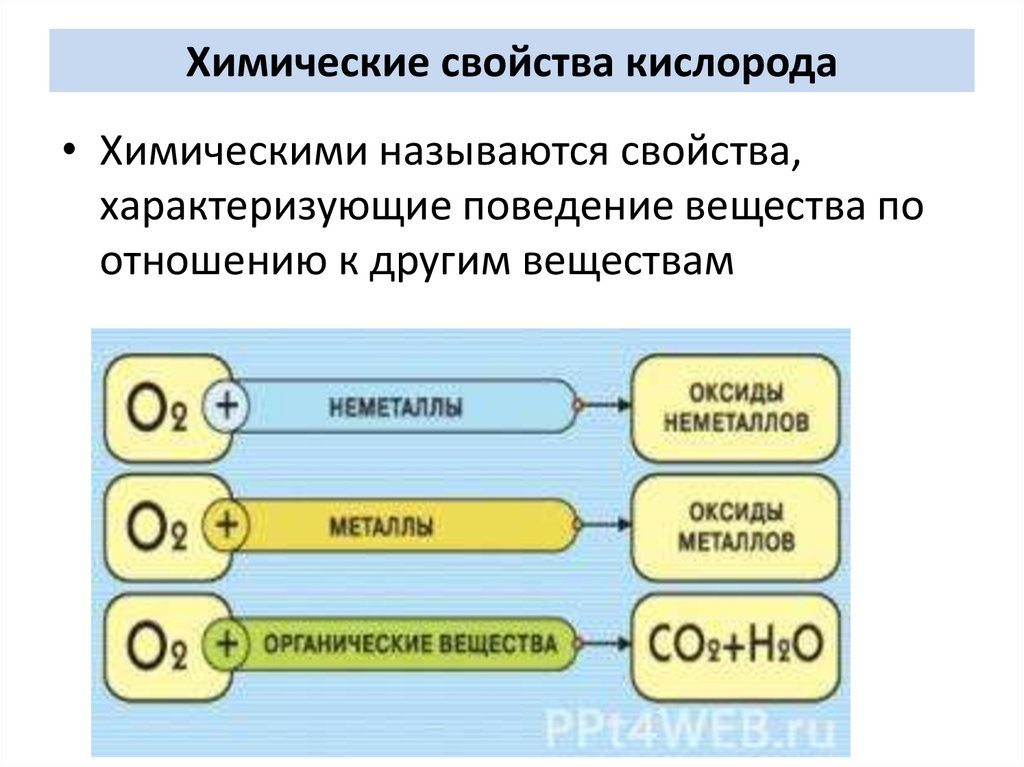
Химические свойства кислорода• Химическими называются свойства,
характеризующие поведение вещества по
отношению к другим веществам
13.
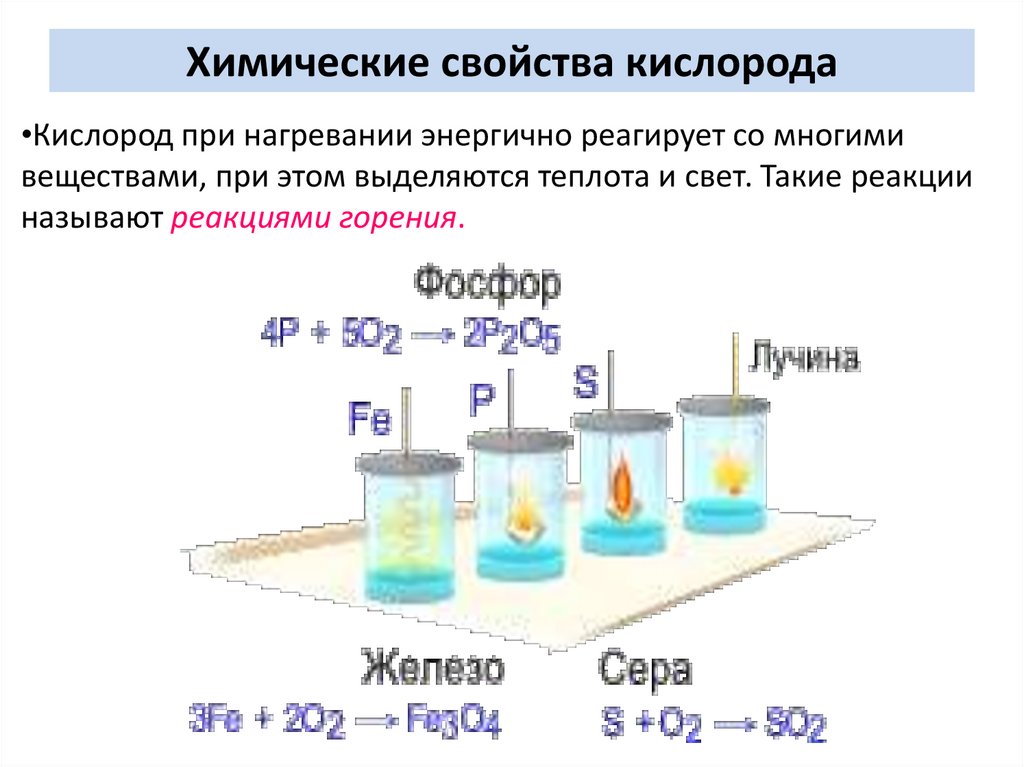
Химические свойства кислорода•Кислород при нагревании энергично реагирует со многими
веществами, при этом выделяются теплота и свет. Такие реакции
называют реакциями горения.
14.
Составьте уравненияреакций горения в
кислороде этих
веществ.
15.
16.
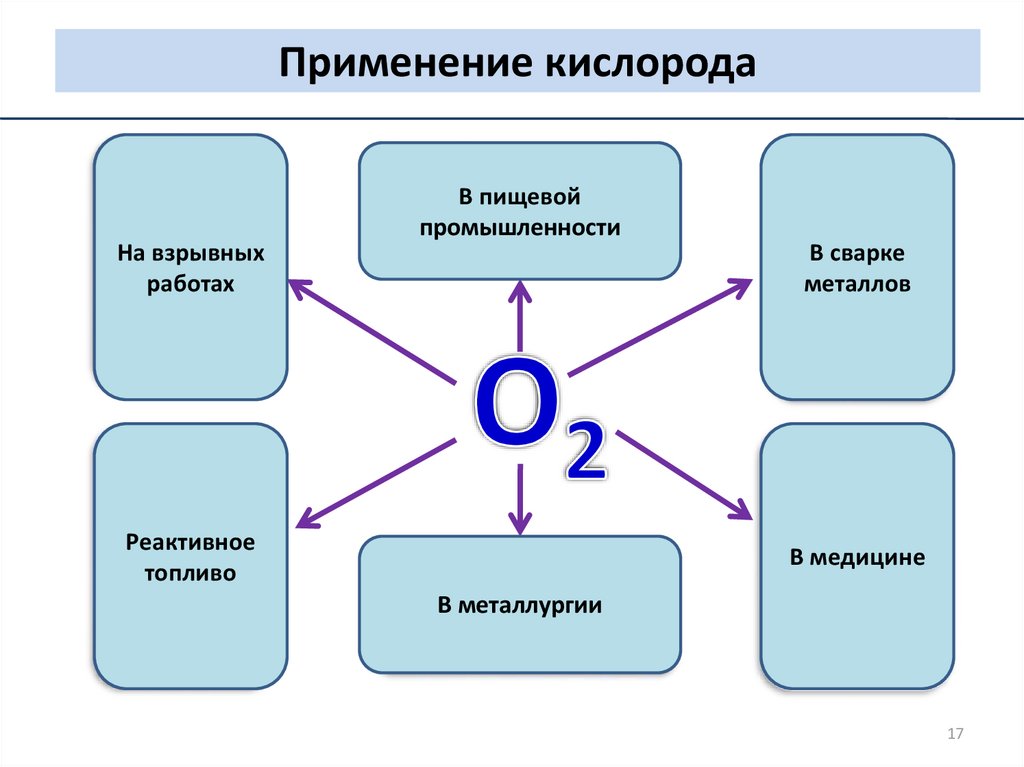
Применение кислородаНа взрывных
работах
В пищевой
промышленности
Реактивное
топливо
В сварке
металлов
В медицине
В металлургии
17
17.
Кислород в жизни человека• Окисление пищи – источник
энергии.
• Кислород доставляется
гемоглобином, который
образует соединение –
оксигемоглобин. Оно
окисляет белки, жиры и
углеводы, образуя углекислый
газ и воду, и выделяя
энергию, необходимую для
жизнедеятельности.
Гемоглобин
18.
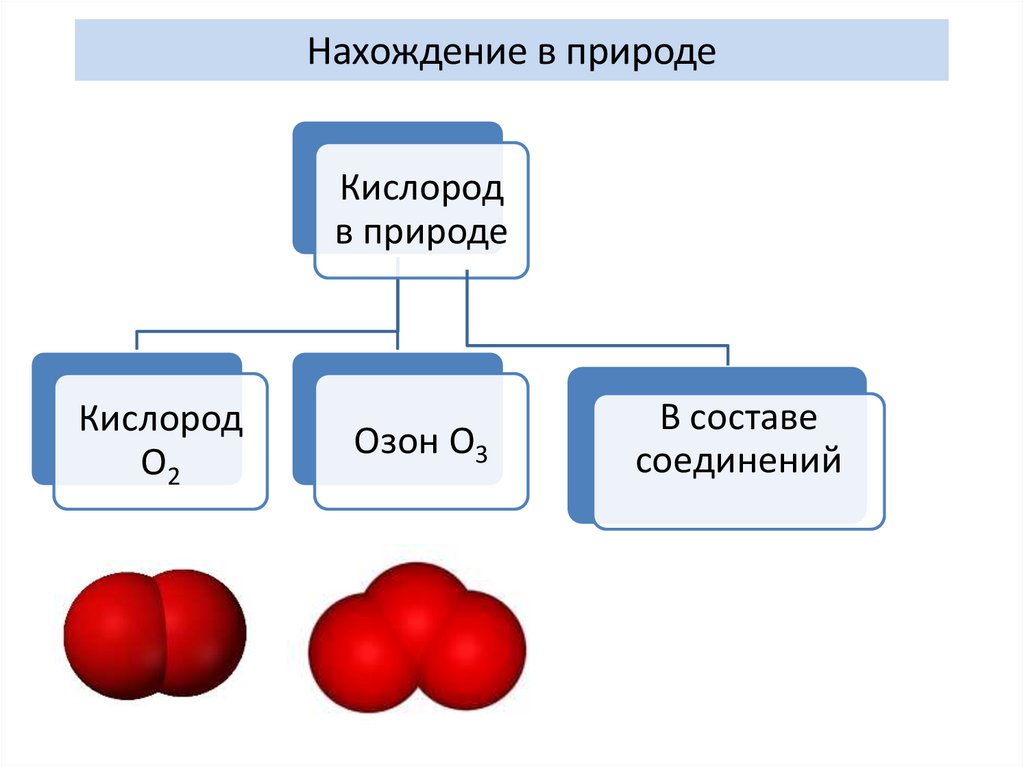
Нахождение в природеКислород
в природе
Кислород
О2
Озон О3
В составе
соединений
19.
20.
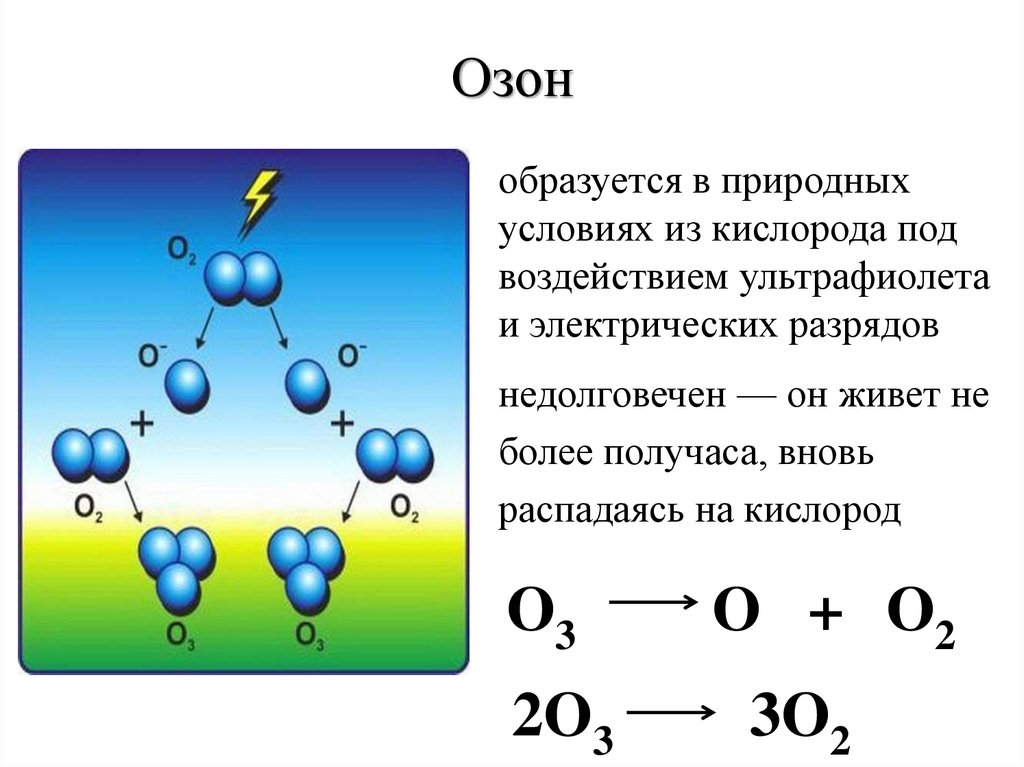
Озонобразуется в природных
условиях из кислорода под
воздействием ультрафиолета
и электрических разрядов
недолговечен — он живет не
более получаса, вновь
распадаясь на кислород
O3
2O3
O + O2
3O2
21.
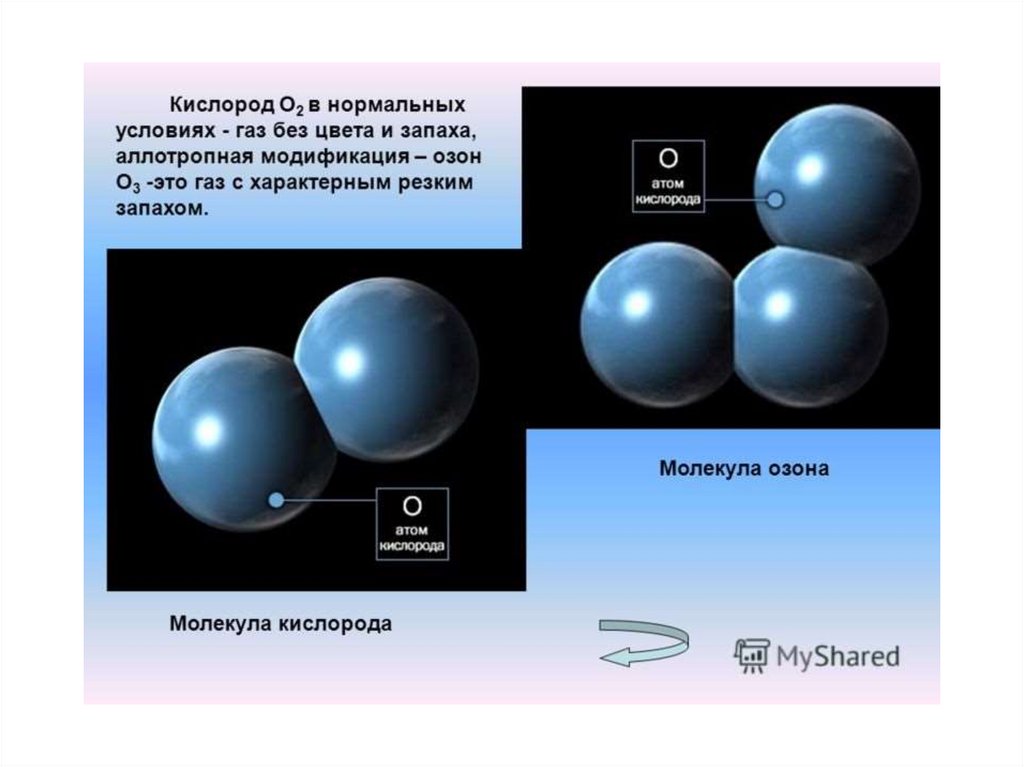
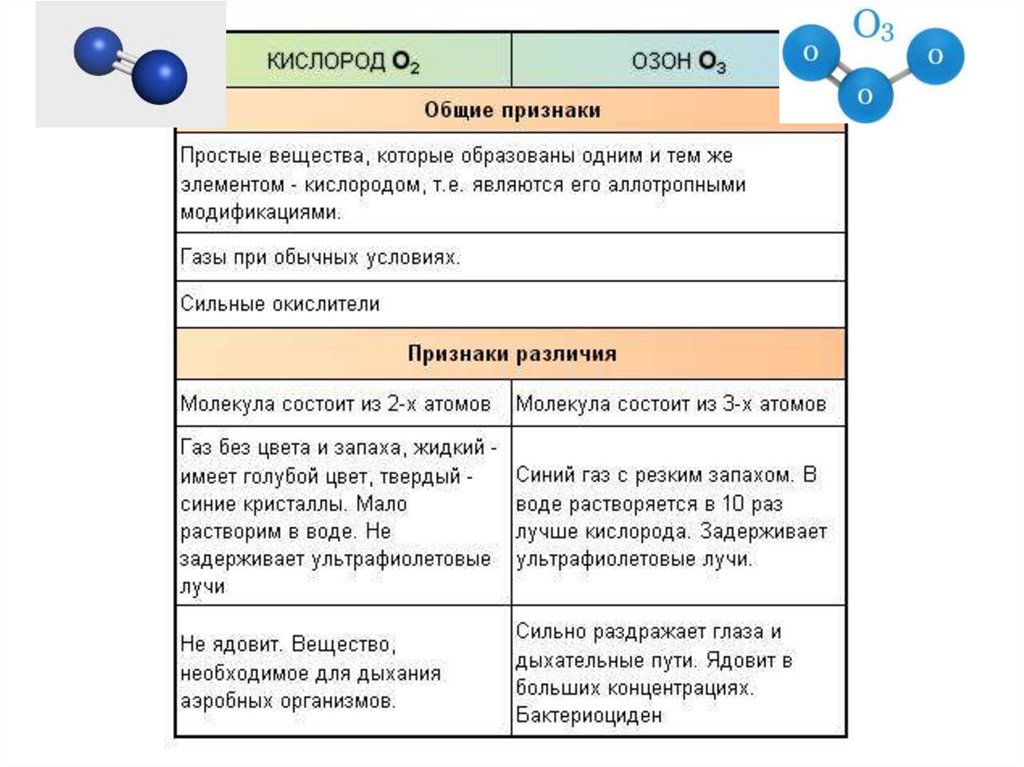
Озон- аллотропная модификациякислорода
22.
23.
Характеристика кислорода24.
• Как погасить горящуюдревесину?
• Загоревшуюся на
человеке одежду?
• Горящую на поверхности
воды нефть?
32










 Химия
Химия








