Похожие презентации:
Кислоты
1.
КИСЛОТЫ2.
Ребенок – не кувшин,который надо наполнить,
а лампада, которую
надо зажечь
Средневековые гуманисты
3. Классификация неорганических веществ
Неорганическиевещества
Простые
вещества
Металлы
Неметаллы
Сложные
вещества
Оксиды
Кислоты
Основания
Соли
4.
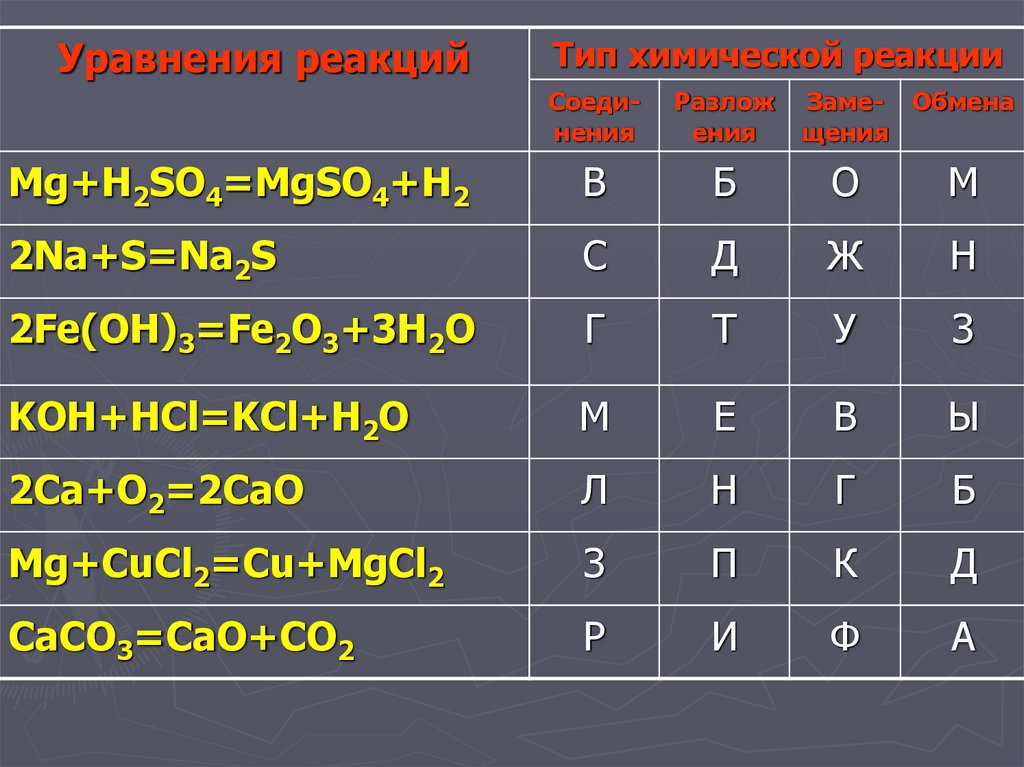
Уравнения реакцийТип химической реакции
Соединения
Разлож
ения
Заме- Обмена
щения
Mg+H2SO4=MgSO4+H2
В
Б
О
М
2Na+S=Na2S
С
Д
Ж
Н
2Fe(OH)3=Fe2O3+3H2O
Г
Т
У
З
KOH+HCl=KCl+H2O
М
Е
В
Ы
2Сa+O2=2CaO
Л
Н
Г
Б
Mg+CuCl2=Cu+MgCl2
З
П
К
Д
CaCO3=CaO+CO2
Р
И
Ф
А
5.
Уравнения реакцийТип химической реакции
Соединения
Разлож
ения
Заме- Обмена
щения
Mg+H2SO4=MgSO4+H2
В
Б
О
М
2Na+S=Na2S
С
Д
Ж
Н
2Fe(OH)3=Fe2O3+3H2O
Г
Т
У
З
KOH+HCl=KCl+H2O
М
Е
В
Ы
2Сa+O2=2CaO
Л
Н
Г
Б
Mg+CuCl2=Cu+MgCl2
З
П
К
Д
CaCO3=CaO+CO2
Р
И
Ф
А
6.
Уравнения реакцийТип химической реакции
Соединения
Разлож
ения
Заме- Обмена
щения
Mg+H2SO4=MgSO4+H2
В
Б
О
М
2Na+S=Na2S
С
Д
Ж
Н
2Fe(OH)3=Fe2O3+3H2O
Г
Т
У
З
KOH+HCl=KCl+H2O
М
Е
В
Ы
2Сa+O2=2CaO
Л
Н
Г
Б
Mg+CuCl2=Cu+MgCl2
З
П
К
Д
CaCO3=CaO+CO2
Р
И
Ф
А
7.
Уравнения реакцийТип химической реакции
Соединения
Разлож
ения
Заме- Обмена
щения
Mg+H2SO4=MgSO4+H2
В
Б
О
М
2Na+S=Na2S
С
Д
Ж
Н
2Fe(OH)3=Fe2O3+3H2O
Г
Т
У
З
KOH+HCl=KCl+H2O
М
Е
В
Ы
2Сa+O2=2CaO
Л
Н
Г
Б
Mg+CuCl2=Cu+MgCl2
З
П
К
Д
CaCO3=CaO+CO2
Р
И
Ф
А
8.
Уравнения реакцийТип химической реакции
Соединения
Разлож
ения
Заме- Обмена
щения
Mg+H2SO4=MgSO4+H2
В
Б
О
М
2Na+S=Na2S
С
Д
Ж
Н
2Fe(OH)3=Fe2O3+3H2O
Г
Т
У
З
KOH+HCl=KCl+H2O
М
Е
В
Ы
2Сa+O2=2CaO
Л
Н
Г
Б
Mg+CuCl2=Cu+MgCl2
З
П
К
Д
CaCO3=CaO+CO2
Р
И
Ф
А
9.
Уравнения реакцийТип химической реакции
Соединения
Разлож
ения
Заме- Обмена
щения
Mg+H2SO4=MgSO4+H2
В
Б
О
М
2Na+S=Na2S
С
Д
Ж
Н
2Fe(OH)3=Fe2O3+3H2O
Г
Т
У
З
KOH+HCl=KCl+H2O
М
Е
В
Ы
2Сa+O2=2CaO
Л
Н
Г
Б
Mg+CuCl2=Cu+MgCl2
З
П
К
Д
CaCO3=CaO+CO2
Р
И
Ф
А
10.
Уравнения реакцийТип химической реакции
Соединения
Разлож
ения
Заме- Обмена
щения
Mg+H2SO4=MgSO4+H2
В
Б
О
М
2Na+S=Na2S
С
Д
Ж
Н
2Fe(OH)3=Fe2O3+3H2O
Г
Т
У
З
KOH+HCl=KCl+H2O
М
Е
В
Ы
2Сa+O2=2CaO
Л
Н
Г
Б
Mg+CuCl2=Cu+MgCl2
З
П
К
Д
CaCO3=CaO+CO2
Р
И
Ф
А
11.
Уравнения реакцийТип химической реакции
Соединения
Разлож
ения
Заме- Обмена
щения
Mg+H2SO4=MgSO4+H2
В
Б
О
М
2Na+S=Na2S
С
Д
Ж
Н
2Fe(OH)3=Fe2O3+3H2O
Г
Т
У
З
KOH+HCl=KCl+H2O
М
Е
В
Ы
2Сa+O2=2CaO
Л
Н
Г
Б
Mg+CuCl2=Cu+MgCl2
З
П
К
Д
CaCO3=CaO+CO2
Р
И
Ф
А
12. О С Т Ы Л К И
13. Тема урока:
КИСЛОТЫ14. Задачи урока:
► Знатьопределение, состав,
классификацию, номенклатуру
кислот
► Уметь определять кислоты среди других
веществ, классифицировать
кислоты, определять валентности
кислотных остатков
► Развивать внимание, мышление и память
15. КИСЛОТЫ В КУЛИНАРИИ
Уксусная и лимоннаякислоты.
16. КИСЛОТЫ В МЕДИЦИНЕ
Аскорбиновая,ацетилсалициловая
и другие
17. КИСЛОТЫ СОДЕРЖАТСЯ В ОРГАНИЗМАХ ЖИВОТНЫХ
Молочная кислотаобразуется в мышцах при
физической нагрузке.
Соляная кислота,
находящаяся в желудке,
помогает переваривать
пищу.
18. Получение водорода
Zn + 2HCl → ZnCl2 + H2↑соляная
кислота
Zn + H2SO4 → ZnSO4 + H2↑
Серная
кислота
19.
Оксиды20.
ОксидыКислотные
оксиды
21.
ОксидыКислотные
оксиды
Основные
оксиды
22.
ОксидыКислотные
оксиды
неМеО
Основные
оксиды
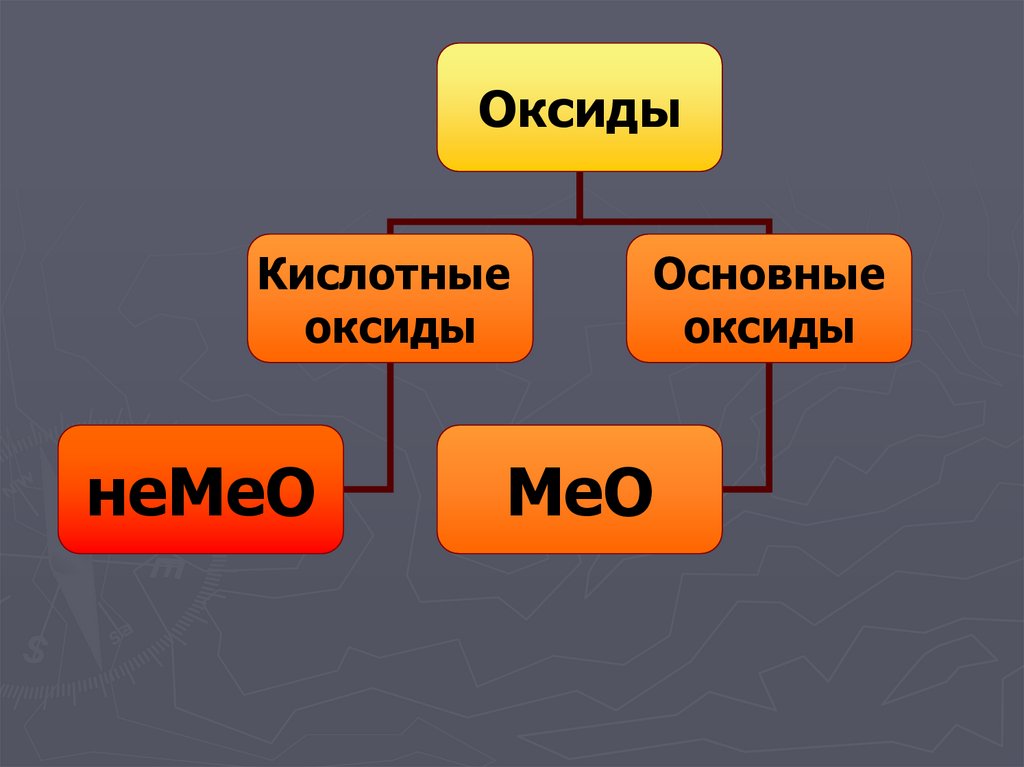
23.
ОксидыКислотные
оксиды
неМеО
Основные
оксиды
МеО
24.
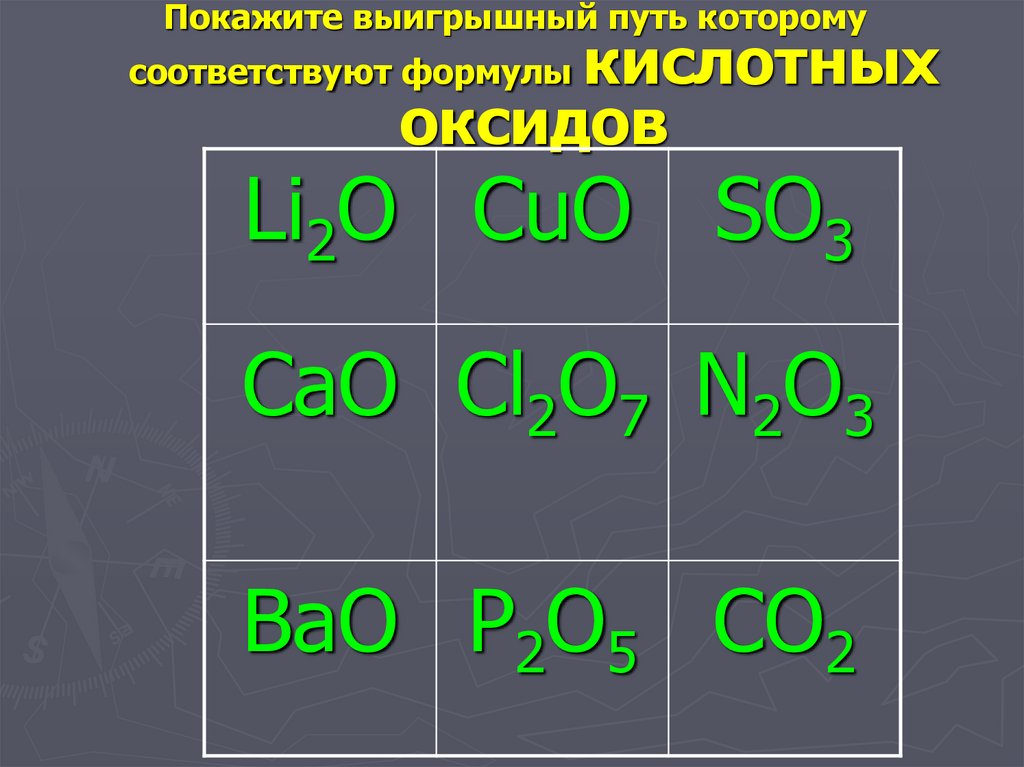
Покажите выигрышный путь которомукислотных
оксидов
соответствуют формулы
Li2O CuO SO3
CaO Cl2O7 N2O3
BaO P2O5 CO2
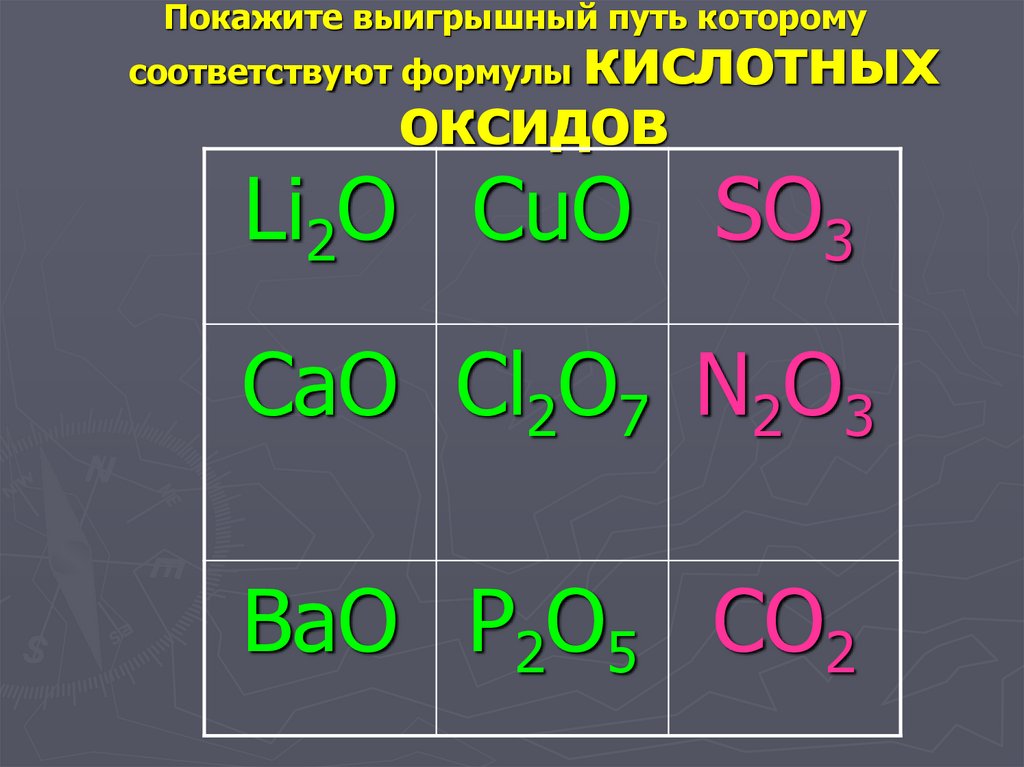
25.
Покажите выигрышный путь которомукислотных
оксидов
соответствуют формулы
Li2O CuO SO3
CaO Cl2O7 N2O3
BaO P2O5 CO2
26. N2O3
SO3CO2
N2O3
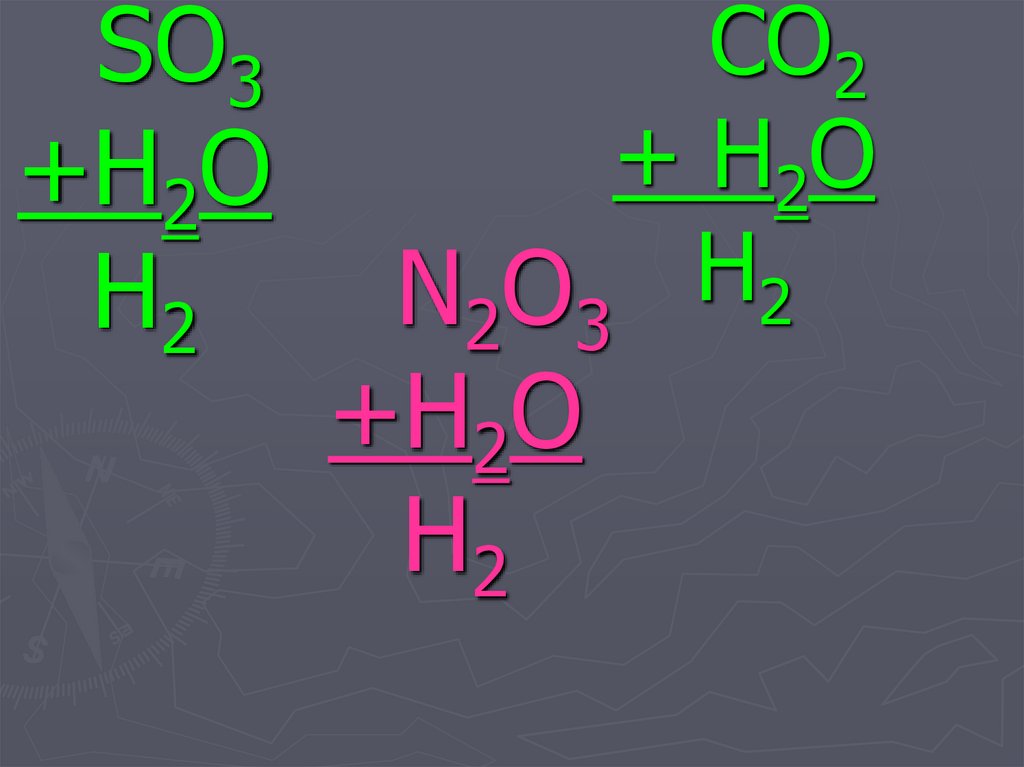
27. N2O3 +H2O
SO3+H2O
N2O3
+H2O
CO2
+ H2O
28. N2O3 +H2O H2
SO3+H2O
H2
CO2
+ H2O
H
N2O3 2
+H2O
H2
29. N2O3 +H2O H2N2
SO3+H2O
H2S
CO2
+ H2O
H
C
N2O3 2
+H2O
H2N2
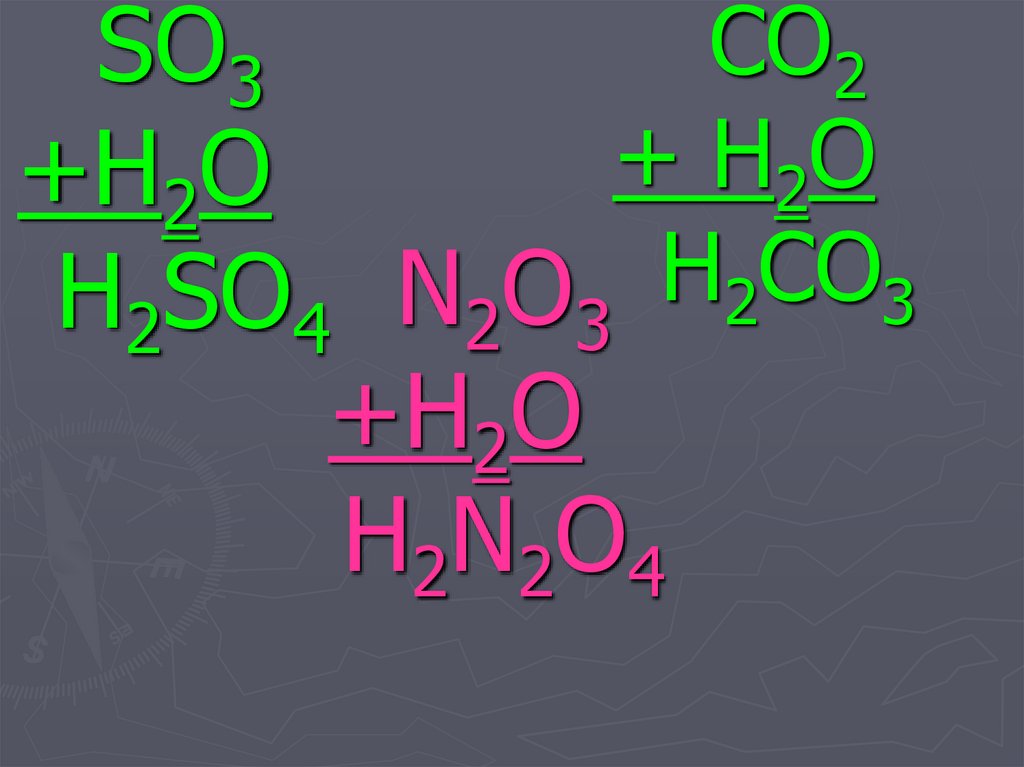
30. N2O3 +H2O H2N2O4
CO2SO3
+ H2O
+H2O
H
CO
H2SO4 N2O3 2 3
+H2O
H2N2O4
31. N2O3 +H2O H2N2O4 HNO2
CO2SO3
+ H2O
+H2O
H
CO
H2SO4 N2O3 2 3
+H2O
H2N2O4
HNO2
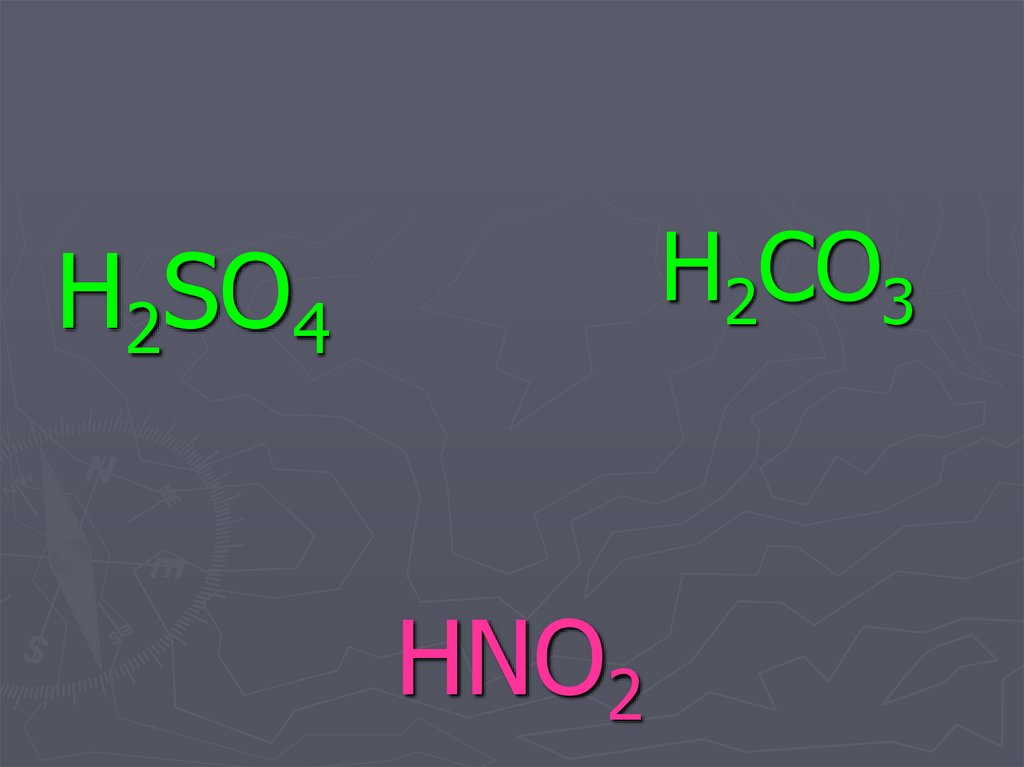
32. HNO2
H2CO3H2SO4
HNO2
33. HNO2
H2CO3H2SO4
HNO2
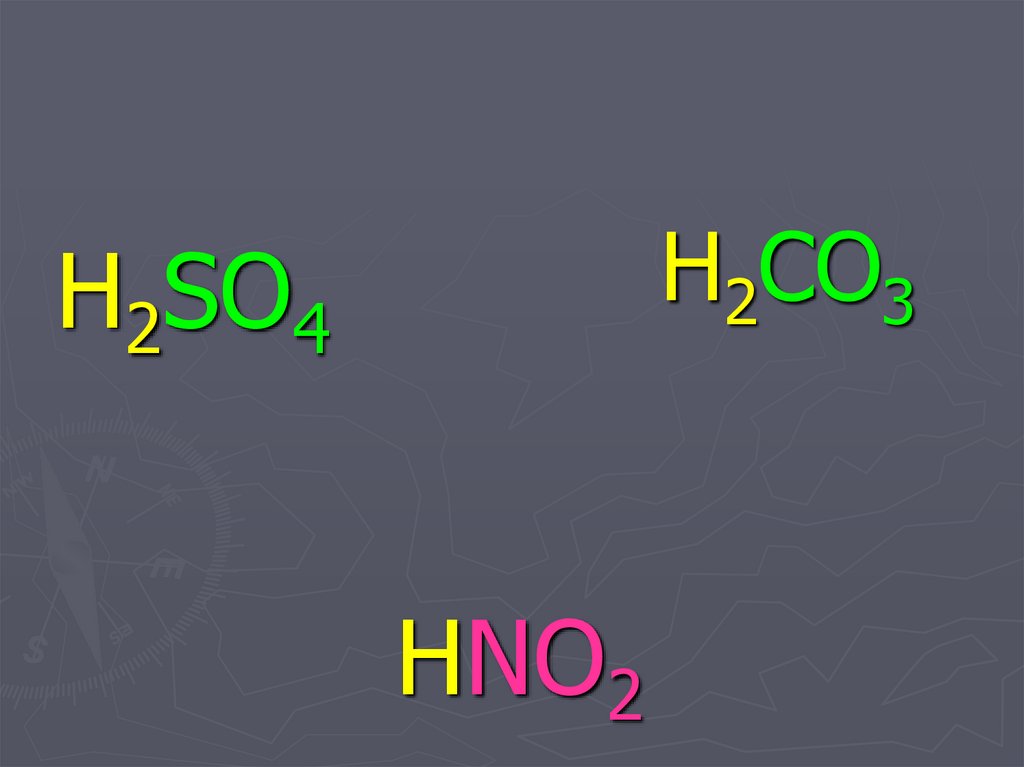
34. HNO2 кислотные остатки
H2SO4HNO2
H2CO3
кислотные остатки
35. Кислоты
- это сложные вещества, состоящие изодного или нескольких атомов водорода и
кислотного остатка
H xR
36. X
IX
H xR
37. Подчеркните кислотный остаток в молекулах кислот
IX
H xR
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
_______
________
_________
__________
_____
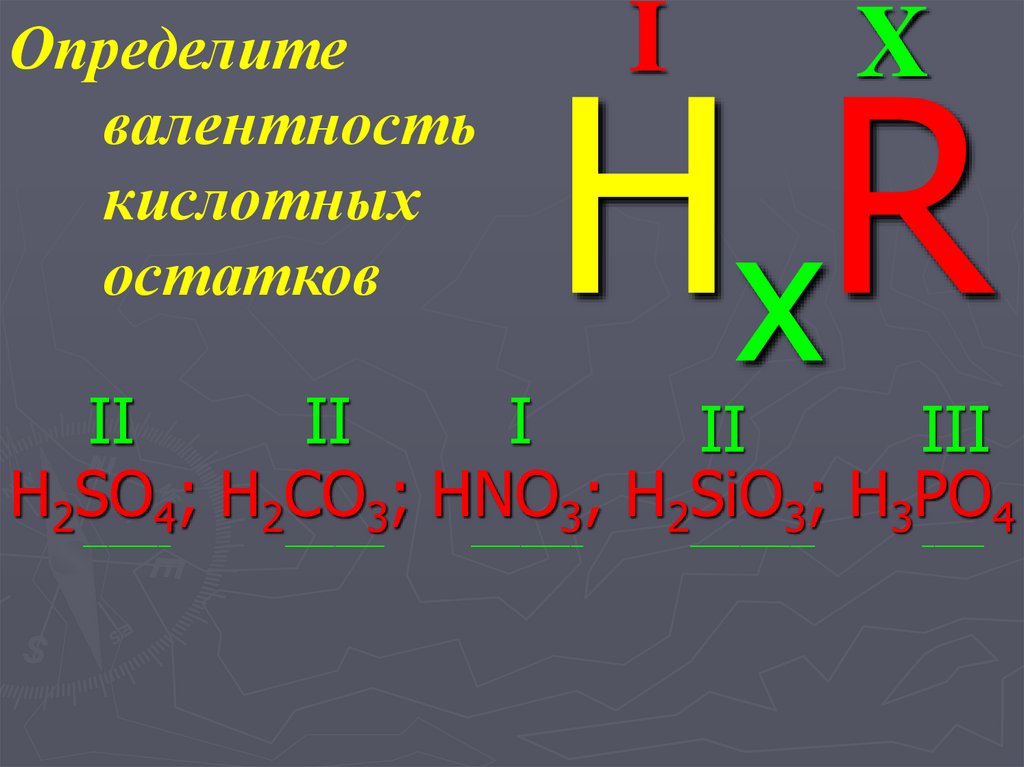
38. Определите валентность кислотных остатков
IX
H xR
II
II
I
II
III
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
_______
________
_________
__________
_____
39. Составьте формулы кислот по известным кислотным остаткам
IX
H xR
Cl(I) → HCl
S(II)→ H2S
PO4(III)→ H3PO4
SiO3(II)→ H2SiO3
ClO4(I) → HClO4
MnO4(II) → H2MnO4
NO2(I)→ HNO2
40. Классификация кислот
XH xR
Классификация
кислот
I. По числу атомов
водорода:
I
x = 1 – одноосновная HNO3
x = 2 – двухосновная H2CO3
x = 3 – трехосновная H3PO4
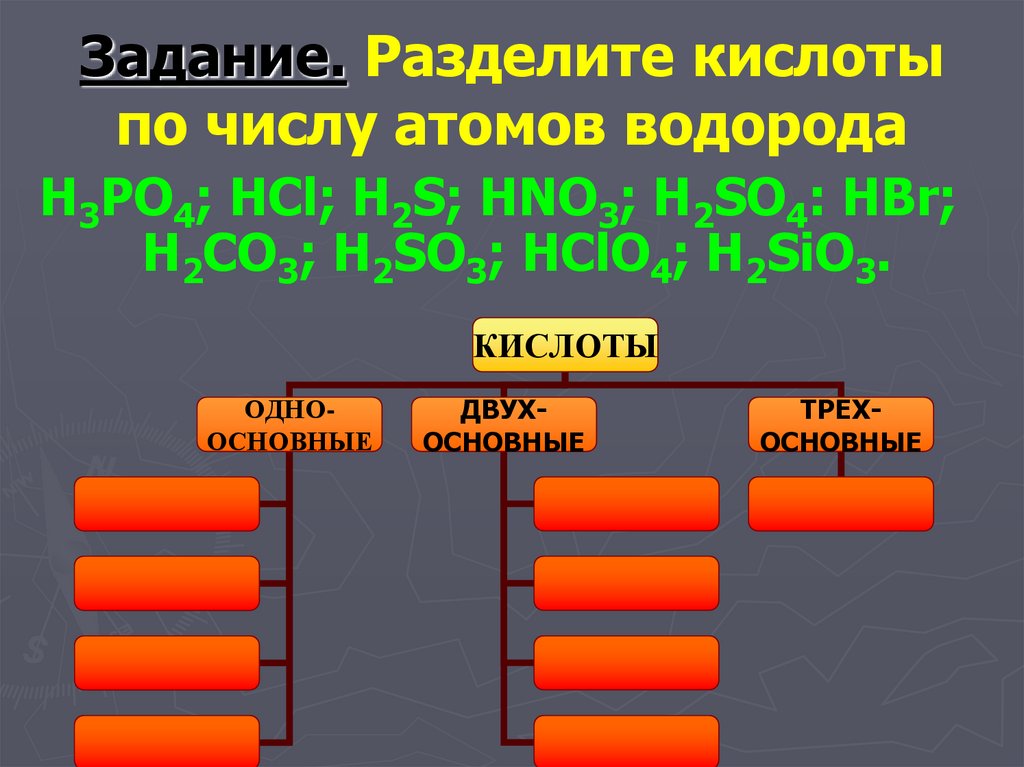
41. Задание. Разделите кислоты по числу атомов водорода
H3PO4; HCl; H2S; HNO3; H2SO4: HBr;H2CO3; H2SO3; HClO4; H2SiO3.
КИСЛОТЫ
ОДНООСНОВНЫЕ
ДВУХОСНОВНЫЕ
ТРЕХОСНОВНЫЕ
42. Классификация кислот
IX
H xR
Классификация
кислот
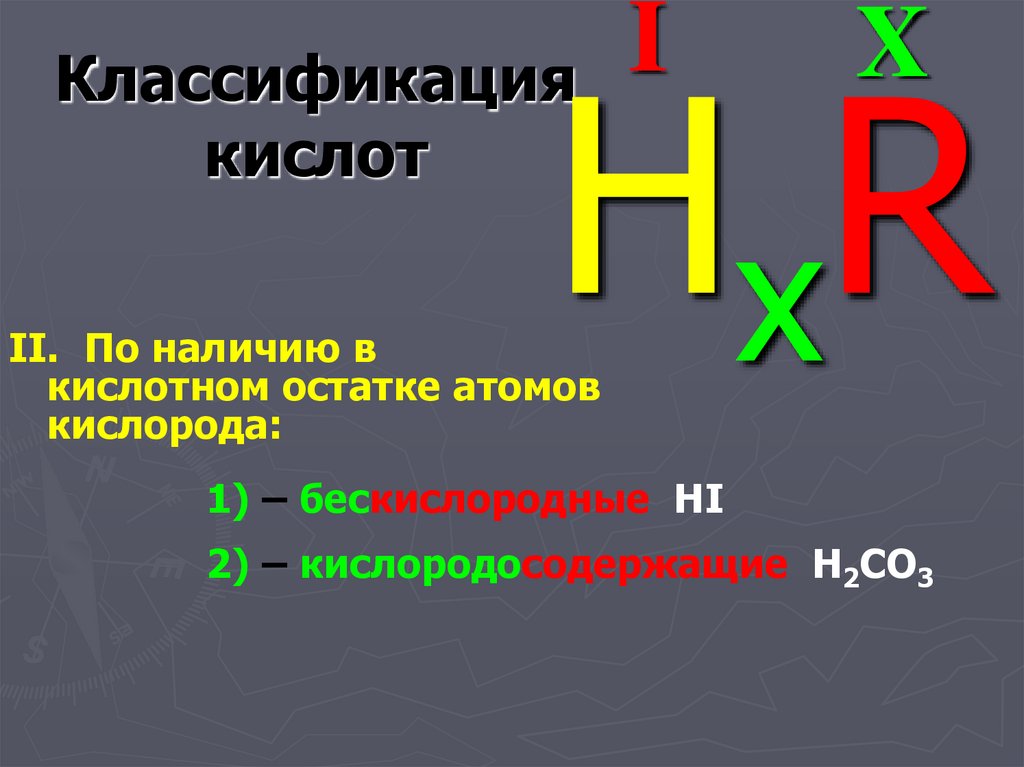
II. По наличию в
кислотном остатке атомов
кислорода:
1) – бескислородные HI
2) – кислородосодержащие H2CO3
43. Задание. Разделите кислоты по наличию атомов кислорода
H3PO4; HCl; HNO3; H2S; H2SO4; HBr.КИСЛОТЫ
Бескислородные
Кислородосодержащие
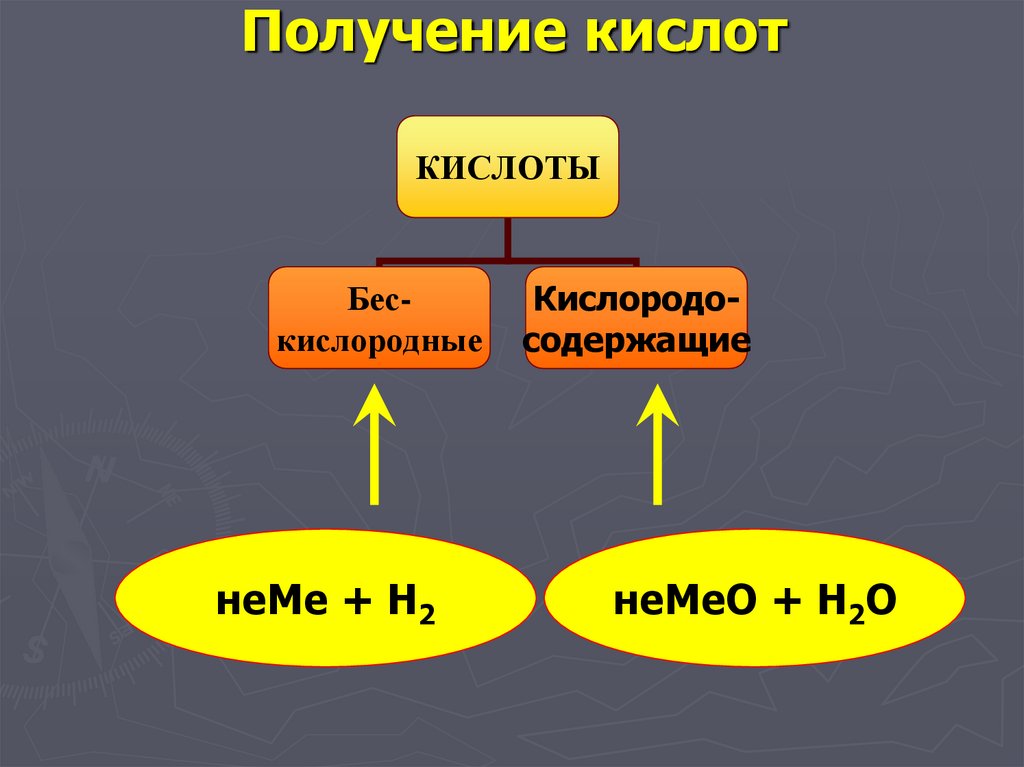
44. Получение кислот
КИСЛОТЫБескислородные
неМе + Н2
Кислородосодержащие
неМеО + Н2О
45. Получение кислот
►Взаимодействиеоксидов с водой
кислотных
Cl2O7 + H2O → 2 HClO4
Взаимодействие водорода с
неметаллами
H2 + Cl2 →2 HCl
46.
Физические свойства кислотHCl -соляная кислота
H2SO4 -серная кислота жидкости
HNO3 -азотная кислота
H2SiO3 - кремниевая кислота твердое
вещество
H2 CO3 = CO2↑ +H2O – угольная кислота
H2SO3 = SO2↑ + H2O – сернистая кислота
В свободном виде не существуют,
распадаются на газ и воду.
47. Индикаторы
вещества, дающие цветныехимические реакции в
зависимости от среды
раствора
Лакмус
Метилоранж
Фенолфталеин
48. Распознавание кислот индикаторами
лакмусHCl
метилоранж
HCl
фенолфталеин
HCl
49.
Названия кислот.ФОРМУЛА
КИСЛОТЫ
НАЗВАНИЕ КИСЛОТЫ
HF
фтороводородная
(плавиковая)
хлороводородная
(соляная)
бромоводородная
HCl
HBr
HI
H2S
йодоводородная
сероводородная
50.
HNO3H2SO3
H2SO4
H2CO3
H2SiO3
H3PO4
азотная
сернистая
серная
угольная
кремниевая
фосфорная
51. Что запомнили?
52. Что поняли?
53. Чему научились?
54.
Закрепление1. Найди группу формул кислот:
а) NH3
б) H2S
в) HCl
HCl
HNO3
KCl
H2 SO4
HBr
H3PO4
2. Выберите формулу «третьего
лишнего» вещества в каждом ряду:
а) HCl
б) HNO3
в) H2S
H2SO4
H2O
H2SO4
K2O
H2CO3
NaOH
55. 3. Даны вещества: CuO, NaOH, H3PO4, CO2, CaCO3, HCl, Cu(OH)2, HNO3, BaO, H2S, K2SO3, H2SO4, Al(OH)3, AgNO3, H2CO3, NaSiO3, SO3,
Al2(SO4)31.
2.
3.
Из предложенного списка
выберите кислоты;
Проклассифицируйте их
Определите валентность кислотных
остатков
56. Домашнее задание
§ 34, 36готовиться к химическому
диктанту по названиям
кислот
с листа-упражнения
выполнить задания №1,
№2











































 Химия
Химия








