Похожие презентации:
Галогены
1.
Лекция 4. Галогены.2.
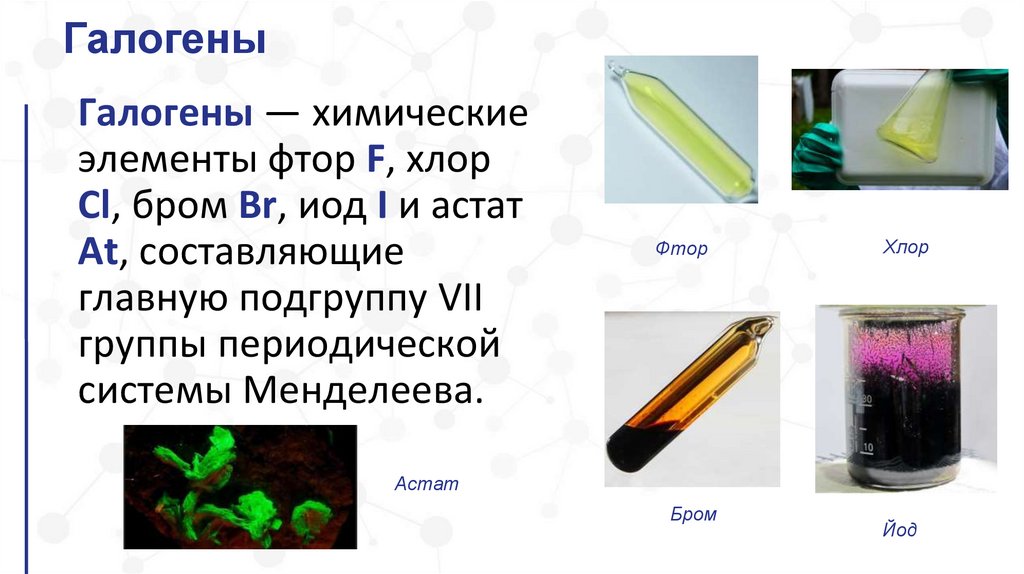
ГалогеныГалогены — химические
элементы фтор F, хлор
Cl, бром Br, иод I и астат
At, составляющие
главную подгруппу VII
группы периодической
системы Менделеева.
Фтор
Хлор
Астат
Бром
Йод
3.
Общая характеристика галогеновВеществ
о
Агрегатное
состояние при
н.у.
Цвет
Запах
Светложёлтый
Фтор F2
Газ, не
сжижается
при обычной
температуре
Хлор
Cl2
Газ
сжижающийся
при обычной
Жёлтотемпературе
зелёный
под
давлением
Температура
плавления, ⁰С
Температура
кипения, ⁰С
Резкий,
раздража
ющий
-220
-188
Резкий,
удушли
вый
-101
-34
4.
Общая характеристика галогеновВещест
во
Бром
Br2
Йод I2
Агрегатное
состояние при
н.у.
Цвет
Запах
Жидкость
Буроватокоричне
вый
Резкий,
зловон
ный
Твёрдое
вещество
Чёрнофиолето
вый с
Резкий
металличе
ским
блеском
Температур
а
плавления,
⁰С
Температур
а кипения,
⁰С
-7
+58
+114
+186
5.
История открытия галогеновТермин «галогены» в
отношении всей группы
элементов (на тот момент
были известны фтор, хлор,
бром и иод) был предложен в
1841 году шведским химиком
Й. Берцелиусом.
Он буквально означает
«солерождающие».
6.
История открытия фтора“Фторос” – разрушение, гибель (греч.). В 1771 г. Карл Шееле получил HF.
Сам фтор был открыт в 1886 г. французским химиком
А. Муассаном электролизом безводного фтороводорода:
2HF → H2 + F2 (-23 °C, эл. ток.)
Однако в присутствии комиссии фтор
получить не удалось из-за слишком
тщательной очистки фтороводорода.
Дело в том, что сам фтороводород не
электропроводен (связь ковалентнополярная), электропроводность
обеспечивается присутствием KF,
который образует с HF комплекс KF + HF
→ KHF2. Ион HF2– достаточно устойчив,
поэтому расплав HF, содержащий KF,
содержит ионы K+ и HF2–, которые и
обеспечивают электропроводность.
Через 20 лет за открытие фтора А. Муассан
получил Нобелевскую премию.
7.
История открытия хлораВпервые хлор был получен и описан
К. Шееле в 1774 г. Получен он был
действием концентрированной соляной
кислоты на пиролюзит (MnO2·H2O):
MnO2 + 4HCl(конц.) = MnCl2 + 2H2O + Cl2↑
8.
История открытия хлораОднако ни сам Шееле, ни его современники не считали этот газ
самостоятельным химическим элементом. После победы
кислородной теории А. Лавуазье над теорией флогистона хлор
стали считать оксидом еще неоткрытого элемента мурия (А.
Лавуазье, К. Бертолле, Г. Дэви).
После 3-х лет попыток получить мурий Г. Дэви пришел к
выводу, что это – простое вещество (1810 г.), которое назвал
хлорином (“хлорос” – желто-зеленый, греч.). В 1811 г. Ж. Л.
Гей-Люссак назвал его хлором.
Считается, что первооткрывателем хлора был К. Шееле
9.
История открытия бромаВпервые был получен Ю. Либихом,
но он “проглядел” открытие, приняв
бром за смесь хлора и йода. Поэтому
открытие принадлежит французу
А. Балару (30 ноября 1825 г.).
А. Балар назвал новое вещество
муридом (от латинского слова muria
– рассол).
Комиссией было предложено для
этого вещества другое название –
бром (от греческого слова “бромос” –
зловонный, дурно пахнущий).
10.
История открытия йодаОткрыт в 1811 г. французским химикомселитроваром Б. Куртуа.
Согласно легенде, на заводе, где
вырабатывалась селитра, рабочие как-то
погнались за кошкой. Убегая от
преследователей, кошка случайно
опрокинула сосуд с серной кислотой на
остатки солей от выработки селитры, и
тогда вдруг из образовавшейся смеси
выделились густые фиолетовые пары.
Н2SО4 + 2НI = 2Н2О + SО2 + I2↑
11.
История открытия йодаНовое вещество привлекло внимание двух
знаменитых ученых – французского Ж. Л.
Гей-Люссака и английского Г. Дэви,
которые независимо друг от друга
принялись изучать его свойства.
Ученые пришли к выводу, что открытое
Куртуа вещество новый элемент. ГейЛюссак назвал его йодом, а Дэви –
йодином (“йоэйдэс” – “фиолетовый”,
древнегреч.).
Во всем мире прижилось первое название
и лишь в Англии йод называют йодином.
12.
Положение в периодической системеГлавная подгруппа
VII группы.
Теннессин (117)
формально относится к
галогенам, однако его
химические свойства
ещё не изучены и могут
отличаться от
свойств, характерных
для этой группы
элементов.
13.
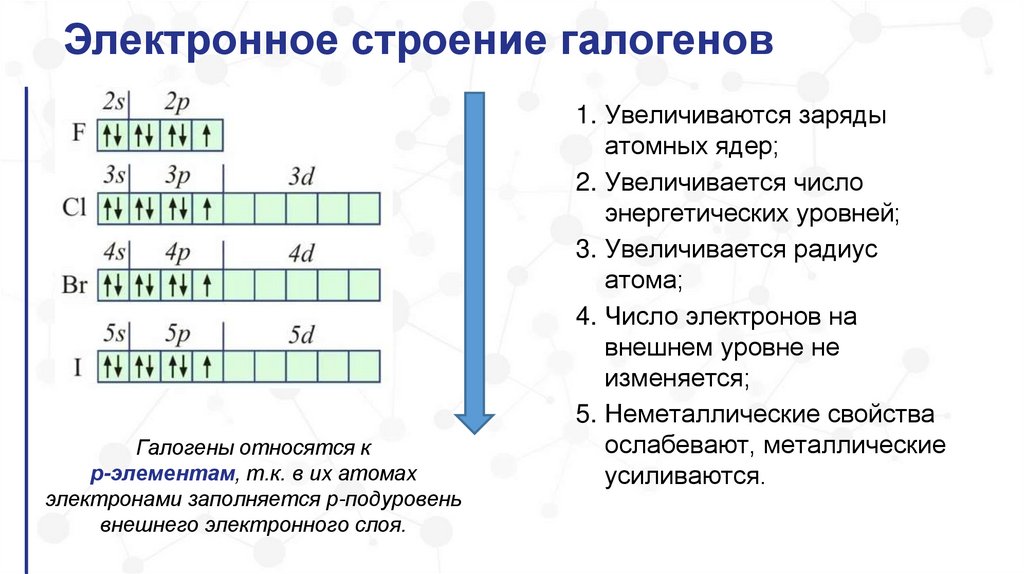
Электронное строение галогеновГалогены относятся к
р-элементам, т.к. в их атомах
электронами заполняется р-подуровень
внешнего электронного слоя.
1. Увеличиваются заряды
атомных ядер;
2. Увеличивается число
энергетических уровней;
3. Увеличивается радиус
атома;
4. Число электронов на
внешнем уровне не
изменяется;
5. Неметаллические свойства
ослабевают, металлические
усиливаются.
14.
Возбуждённое состояние на примере хлораВ=1
В=3
В=5
В=7
15.
Валентность хлора в соединениях16.
Задание №1Нарисуйте
электронную оболочку
фтора. Сделайте
вывод о валентных
возможностях данного
элемента.
Ответ:
Фтор не может переходить в
возбуждённое состояние, т.к. это
энергетически не выгодно. Во всех
соединениях фтор будет проявлять
постоянную валентность, равную 1.
17.
Задание №2Определите, в каких соединениях хлор
обладает валентностью, равной 3.
Нарисуйте строение молекул этих
веществ.
1. NaCl
2. HClO4
3. KClO3
4. Cl2O3
Ответ:
3. KClO3
4. Cl2O3
18.
Важнейшие степени окисления,проявляемые фтором
Примеры
соединений:
Фтор в соединениях
проявляет только одну
степень окисления: -1.
OF2, KF, HF,
Это элемент с самой
высокой
электроотрицательностью.
СF4, PF3
19.
Важнейшие степени окисления,проявляемые хлором
Для хлора характерен целый спектр степеней
окисления, среди которых есть как
положительные, так и отрицательные.
20.
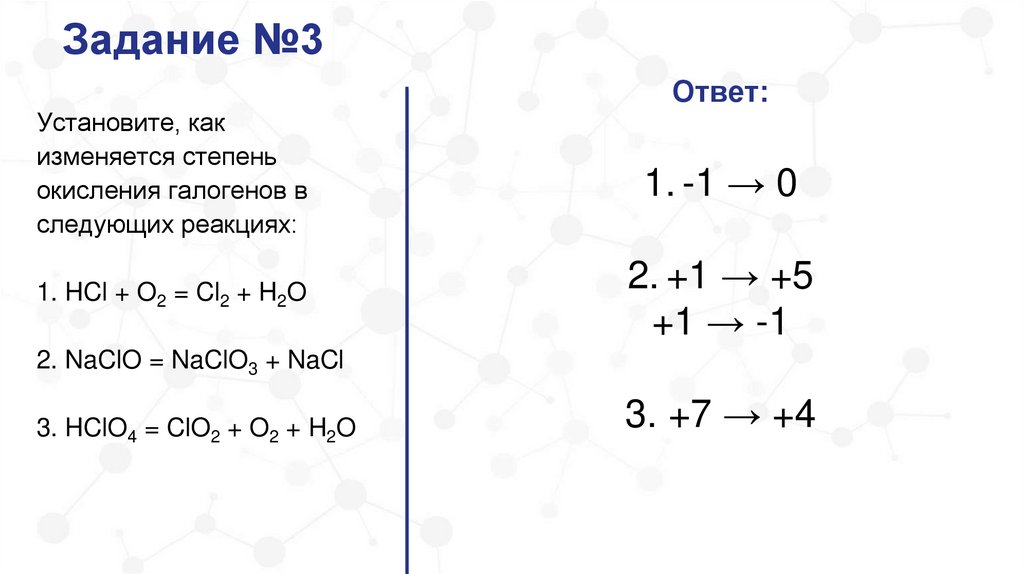
Задание №3Ответ:
Установите, как
изменяется степень
окисления галогенов в
следующих реакциях:
1. -1 → 0
1. HCl + O2 = Cl2 + H2O
2. +1 → +5
+1 → -1
2. NaClO = NaClO3 + NaCl
3. HClO4 = ClO2 + O2 + H2O
3. +7 → +4
21.
Важнейшие соединения хлораВажными неорганическими соединениями
хлора являются хлористый водород (HCl) и
хлориды (NaCl, KCl и др.).
Раствор хлороводорода в воде
называется соляной, или
хлороводородной, кислотой. Это
бесцветная жидкость с запахом.
Максимальное содержание в ней
хлороводорода составляет 37 %.
Соляная кислота относится к сильным
одноосновным кислотам с характерными
для этих веществ свойствами.
22.
Галогены в природеВ природе галогены встречаются только в
виде соединений.
Фтор встречается в виде флюорита
CaF2, криолита Na3AlF6 и некоторых
других минералов.
Наиболее распространённые
соединения хлора – каменная соль
(галит) NaCl и сильвинит KCl⋅NaCl.
Бром и йод собственных минералов
не образуют. Их соединения
содержатся в морской воде и
накапливаются водорослями.
Флюорит
Галит
Сильвинит
23.
Элементы-галогены в организмеF
Br
Cl
I
24.
Применение соединений галогеновХлор используется для обеззараживания
воды, производство соляной кислоты, а
также пластмасс, каучуков, растворителей,
красителей.
Поваренная соль NaCl добавляется в пищу,
а калийную соль KCl вносят в почву в
качестве калийного удобрения.
Соединения брома и йода используются в
медицине для лечения и профилактики
некоторых заболеваний. Спиртовой
раствор иода применяется при обработке
ран и царапин.
25.
Выводы• Галогены главную подгруппу VII группы.
• Галогены имеют схожее электронное строение
(7 электронов на внешнем подуровне).
• Все галогены, кроме фтора, могут переходить в
возбуждённое состояние, что влияет на значения
их валентностей и степеней окисления.




















 Химия
Химия