Похожие презентации:
Щелочные металлы
1.
2.
3.
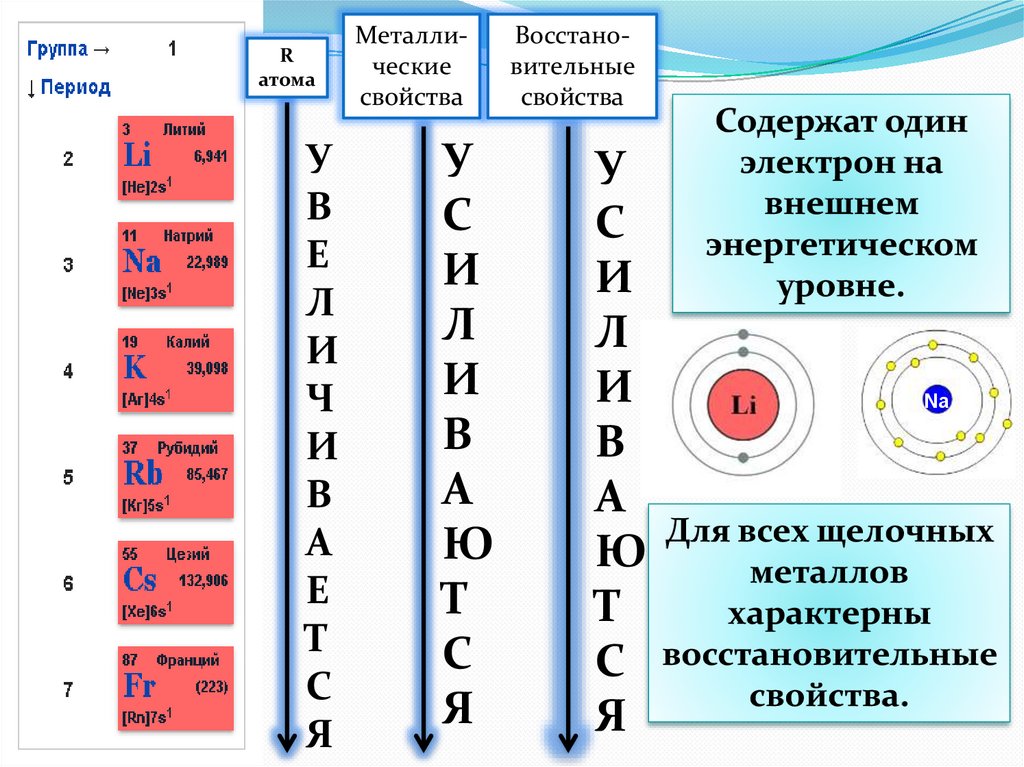
Rатома
У
В
Е
Л
И
Ч
И
В
А
Е
Т
С
Я
Металлические
свойства
У
С
И
Л
И
В
А
Ю
Т
С
Я
Восстановительные
свойства
У
С
И
Л
И
В
А
Ю
Т
С
Я
Содержат один
электрон на
внешнем
энергетическом
уровне.
Na
Для всех щелочных
металлов
характерны
восстановительные
свойства.
4.
5.
6.
7.
8.
Карбона́т на́трияNa2CO3
9.
:1) Число электронов на внешнем
2)
3)
4)
5)
6)
7)
8)
энергетическом уровне равно 1.
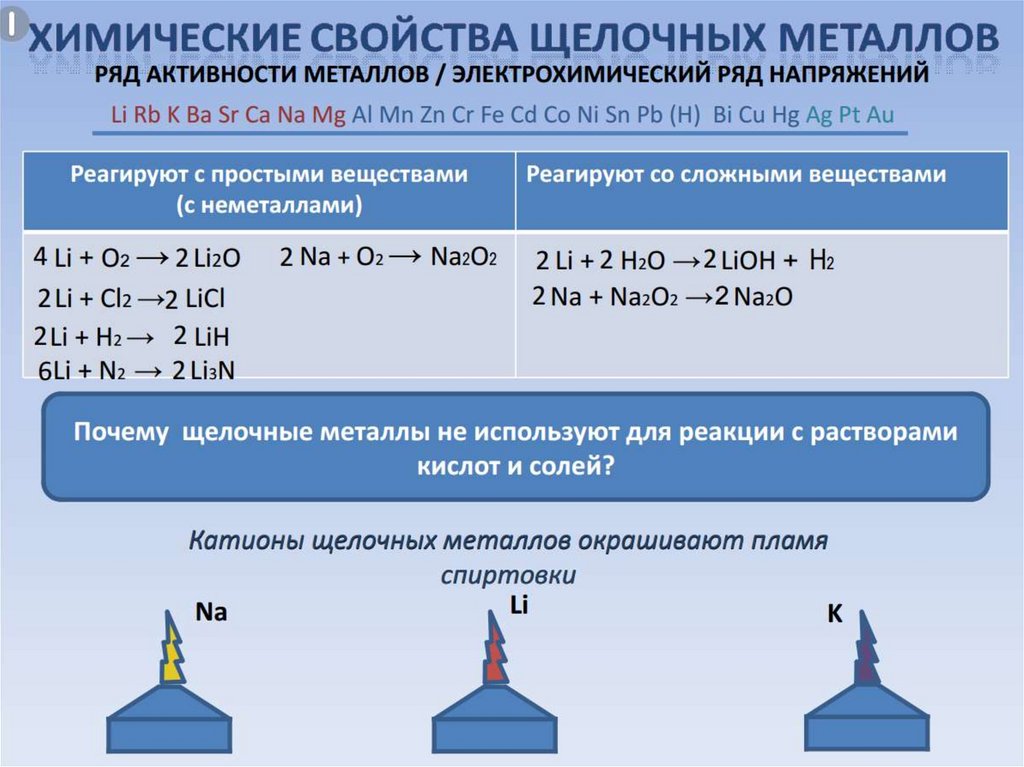
В реакциях щелочные металлы являются
окислителями и восстановителями.
При взаимодействии натрия с кислородом
образуется пероксид натрия.
Щелочные металлы не взаимодействуют с
водой.
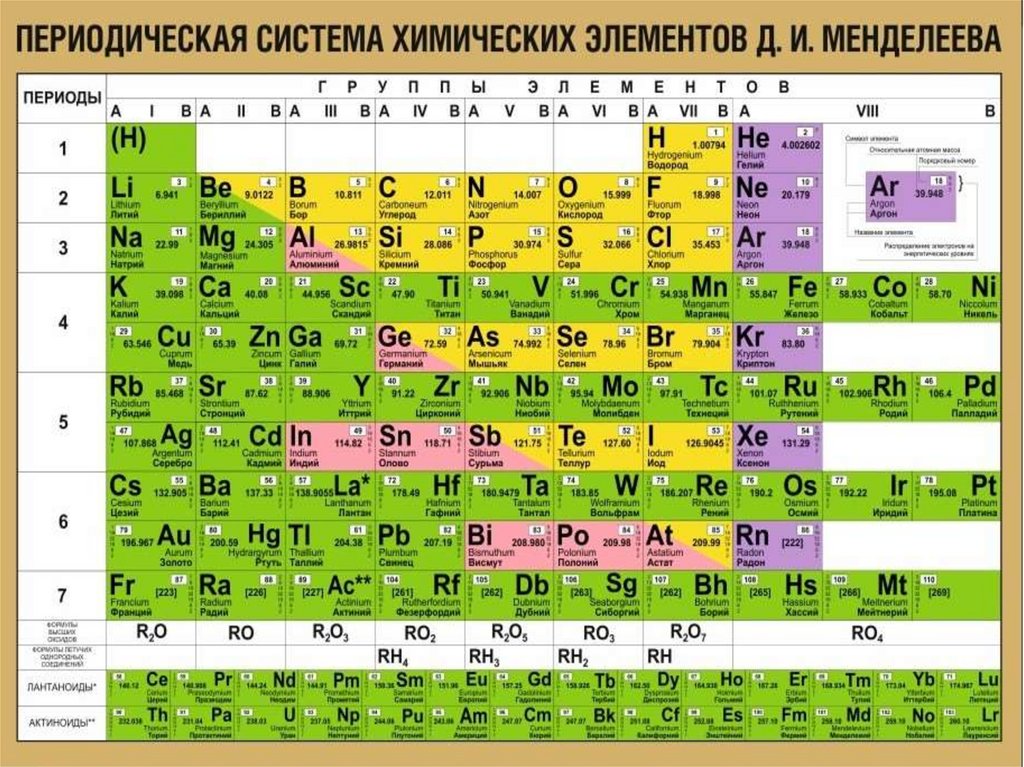
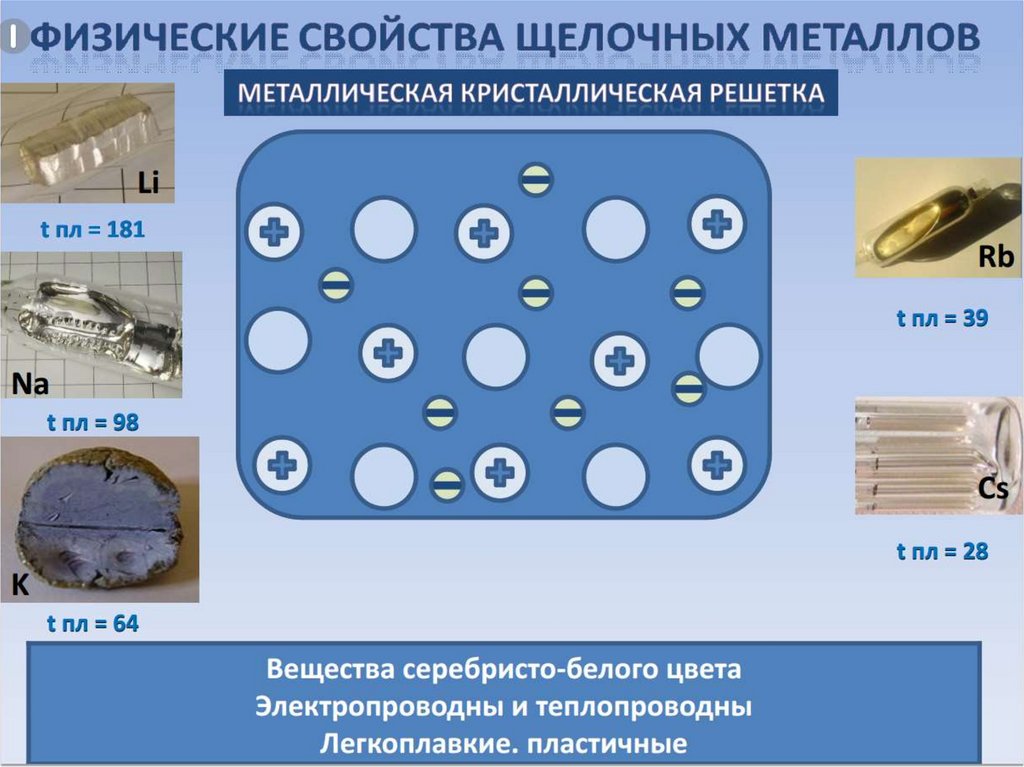
Щелочные металлы – это металлы IА группы
Периодической системы Д.И.Менделеева.
Щелочные металлы получают электролизом
расплавов их солей.
При переходе от лития к калию уменьшается
радиус атома.
Качественной реакцией на ионы щелочных
металлов является их взаимодействие с
кислородом.
10.
:1) Число электронов на внешнем
2)
3)
4)
5)
6)
7)
8)
энергетическом уровне равно 1.
В реакциях щелочные металлы являются
окислителями и восстановителями.
При взаимодействии натрия с кислородом
образуется пероксид натрия.
Щелочные металлы не взаимодействуют с
водой.
Щелочные металлы – это металлы IА группы
Периодической системы Д.И.Менделеева.
Щелочные металлы получают электролизом
расплавов их солей.
При переходе от лития к калию уменьшается
радиус атома.
Качественной реакцией на ионы щелочных
металлов является их взаимодействие с
кислородом.
11.
ДОМАШНЕЕ ЗАДАНИЕ:1. § 11
2. Выполнить цепочку химических превращений:
Na → Na2O2 → Na2O → Na2CO3
↓
NaOH → NaCl








 Химия
Химия








