Похожие презентации:
Химическое равновесие
1. Химическое равновесие.
Автор: Фельдман Людмила Валентиновна,учитель химии МБОУ СОШ им. А.М.Горького
г.Карачева Брянской области
2. Химическое равновесие
Реакции, которые одновременнопротекают в прямом и обратном
направлении, называются
обратимыми
Состояние химического обратимого
процесса, при котором скорость
прямой реакции равна скорости
обратной реакции, называется
химическим равновесием
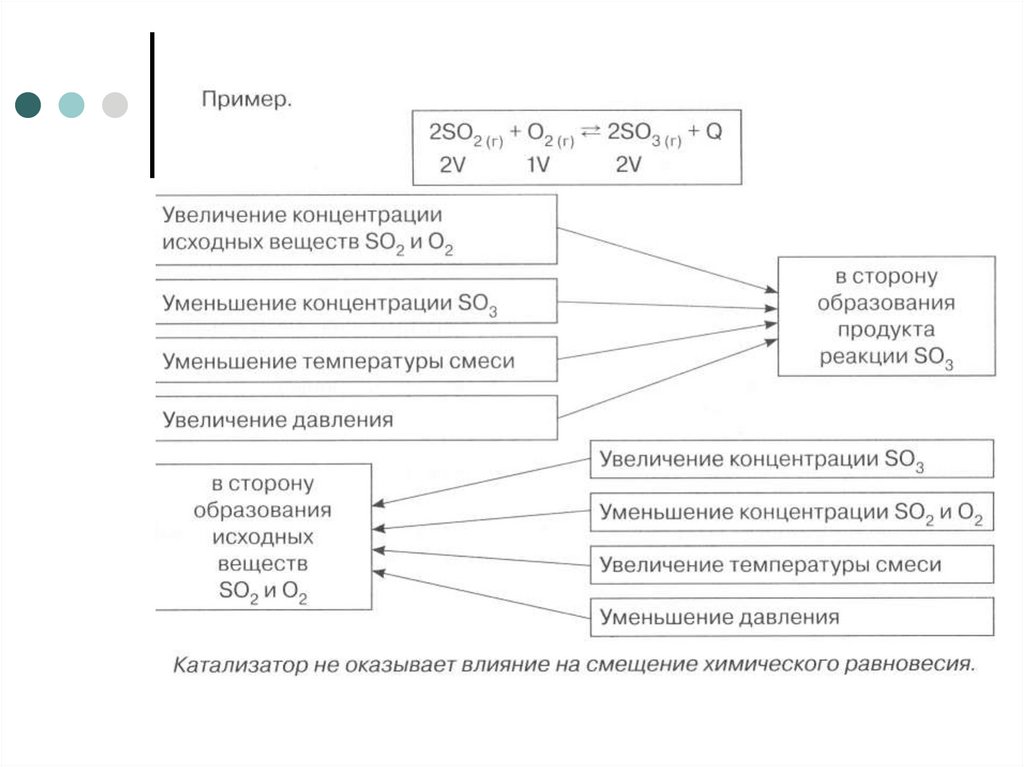
3. Смещение химического равновесия осуществляется в соответствии с принципом Ле Шателье
Если на систему, находящуюся всостоянии химического равновесия,
оказать внешнее воздействие
(изменить концентрацию,
температуру, давление), то
равновесие смещается в сторону
той реакции, которая ослабляет это
воздействие
4.
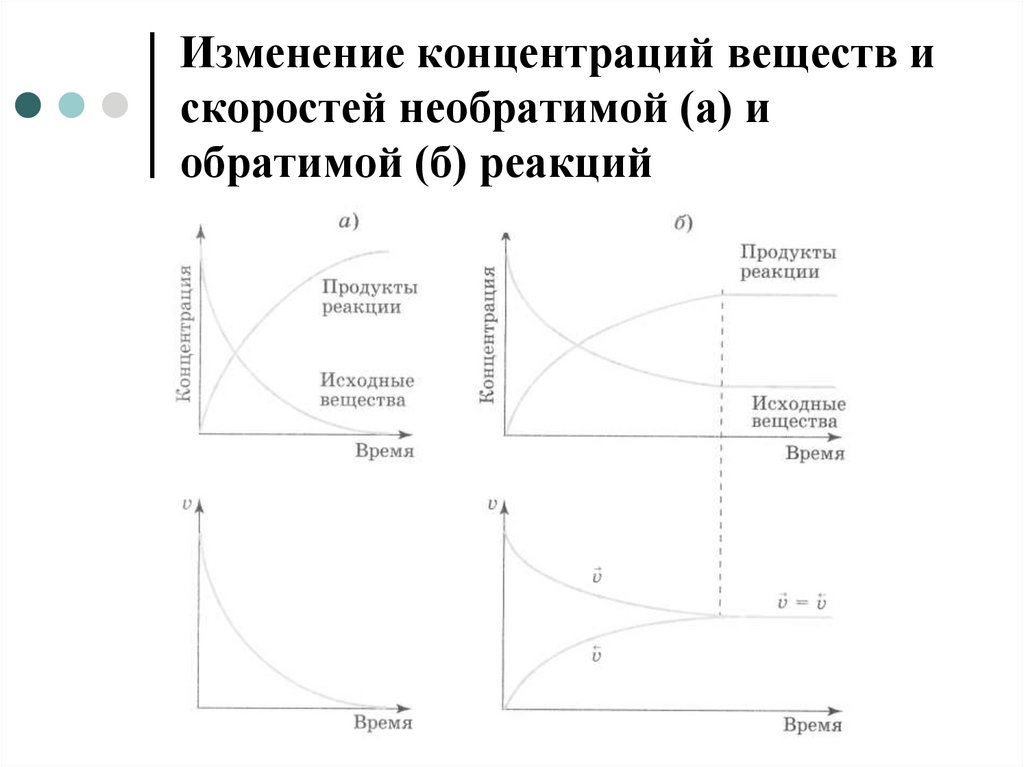
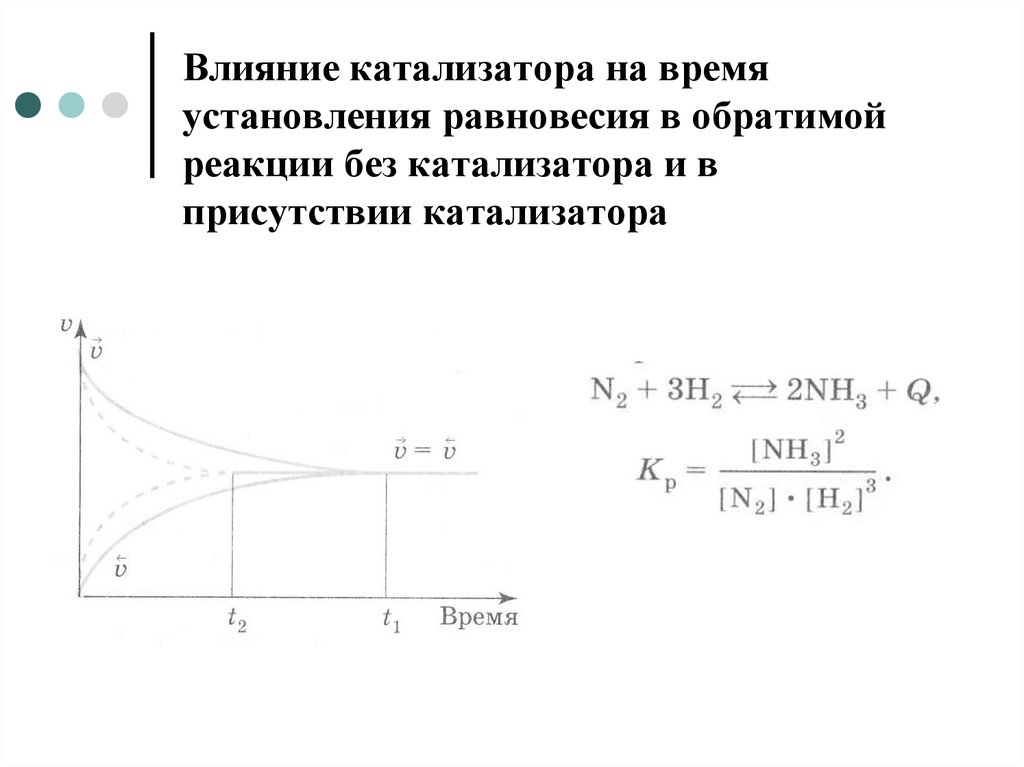
5. Процессы, протекающие при обратимых реакциях
6. Процессы, протекающие при обратимых реакциях
прямая реакцияαА + βВ
υ
γС + δD
обратная реакция
α
═ k1 · [A] · [B]
β






 Химия
Химия








