Похожие презентации:
Обратимость химических реакций. Химическое равновесие
1. Обратимость химических реакций
Химическое равновесие2. Обратимые и необратимые реакции
Необратимыми называют химическиереакции, протекающие только в одном
направлении.
AlCl3 3NaOH Al (OH )3 3NaCl
Обратимыми называют реакции,
протекающие при одних и тех условиях и
в прямом, и в обратном направлениях.
N 2 3H 2 2 NH 3
3. Обратимые и необратимые реакции
При каких условиях данная реакция будетобратимой? Необратимой?
СаСO3 CaO CO2
СаСO3 CaO CO2
СаСO3 CaO CO2
4. Химическое равновесие
Состояние системы, при которомскорость прямой реакции равна скорости
обратной реакции, называется
химическим равновесием.
v1 v2
5. Смещение химического равновесия
Принцип Ле Шателье(1884г.):
если на систему,
находящуюся в равновесии,
оказывается внешнее
воздействие, то равновесие
смещается в ту сторону,
которая ослабляет данное
воздействие.
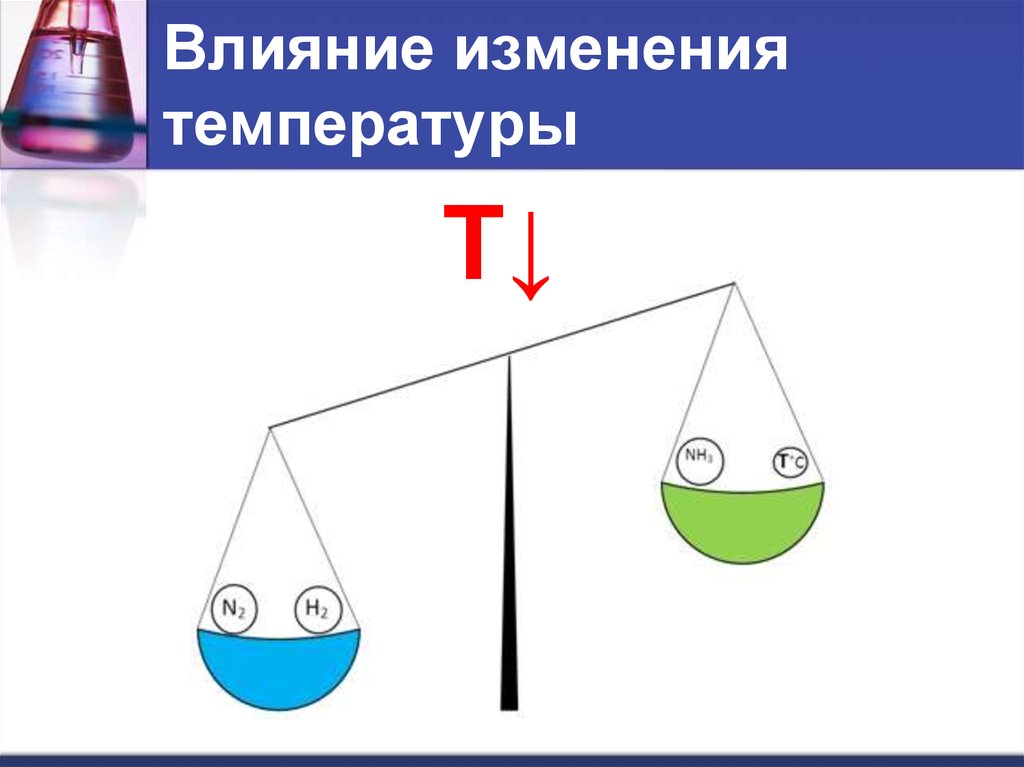
6. Влияние изменения температуры
7. Влияние изменения температуры
N2 (г) + 3H2 (г) → 2NH3 (г) + Q8. Влияние изменения температуры
T↓9. Влияние изменения температуры
При повышении температуры равновесиесмещается в сторону эндотермической
реакции.
N 2 3H 2 2 NH 3 Q
При понижении температуры – в сторону
экзотермической реакции.
N 2 3H 2 2 NH 3 Q
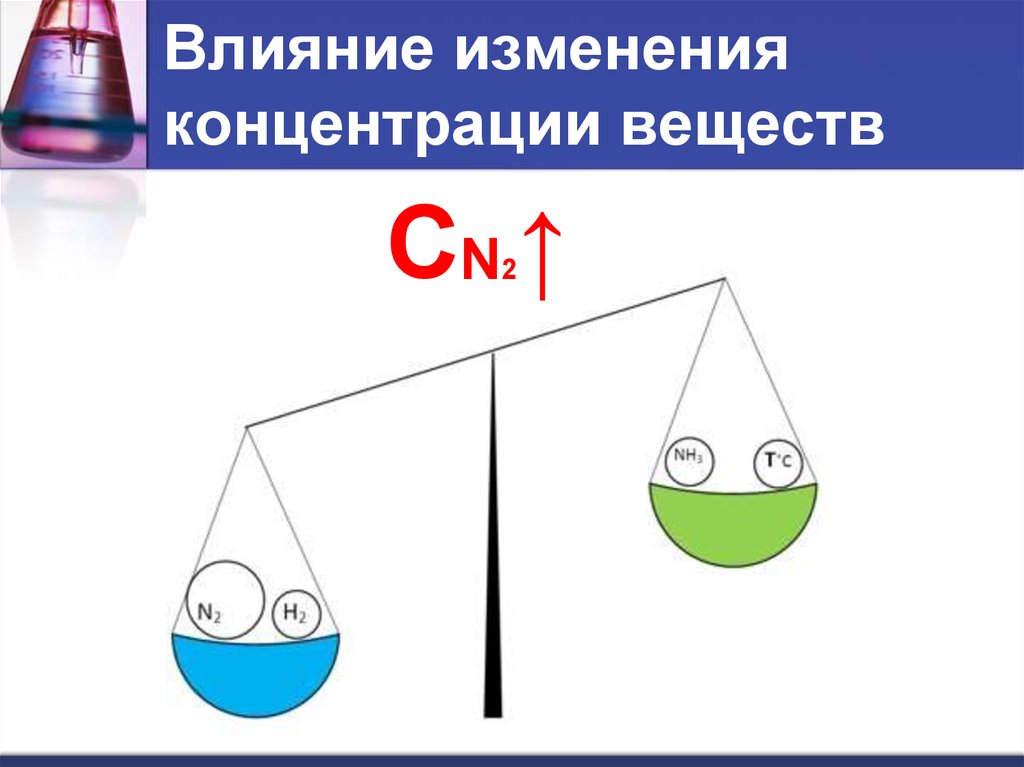
10. Влияние изменения концентрации веществ
СN ↑2
11. Влияние изменения концентрации веществ
При увеличении концентрации одного извеществ равновесие смещается в сторону
его расходования.
При уменьшении концентрации – в
сторону его образования.
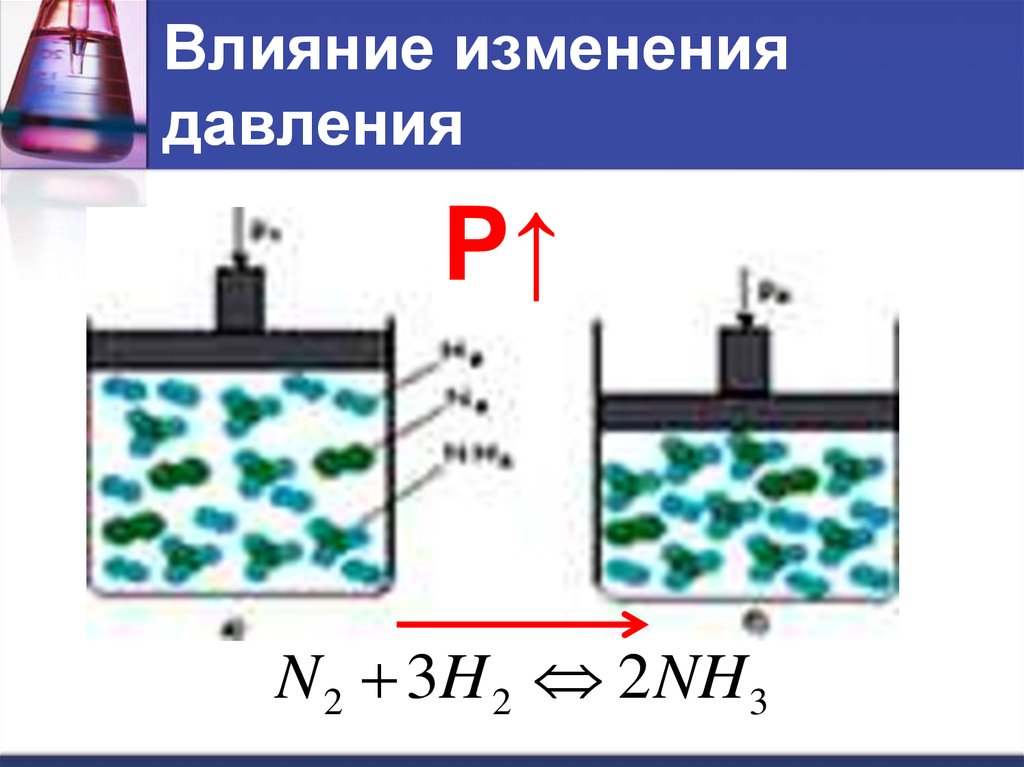
12. Влияние изменения давления
Р↑N 2 3H 2 2 NH 3
13. Влияние изменения давления
Приувеличении давления
равновесие смещается в сторону той
реакции, при которой объем
образующихся газов меньше.
14. Катализатор:
невлияет на смещение
химического равновесия
(он лишь ускоряет процесс его
достижения)
15. Принцип Ле Шателье:
применим к любым равновеснымсистемам: термодинамическим
биологическим
психическим
педагогическим
социальным
экономическим












 Химия
Химия








