Похожие презентации:
Фосфор и его соединения
1.
Фосфор и его соединения2.
P + 15 2, 8, 5Возможные степени
окисления:
-3 PH3, Na3P
+5
P2O5, H3PO4
3.
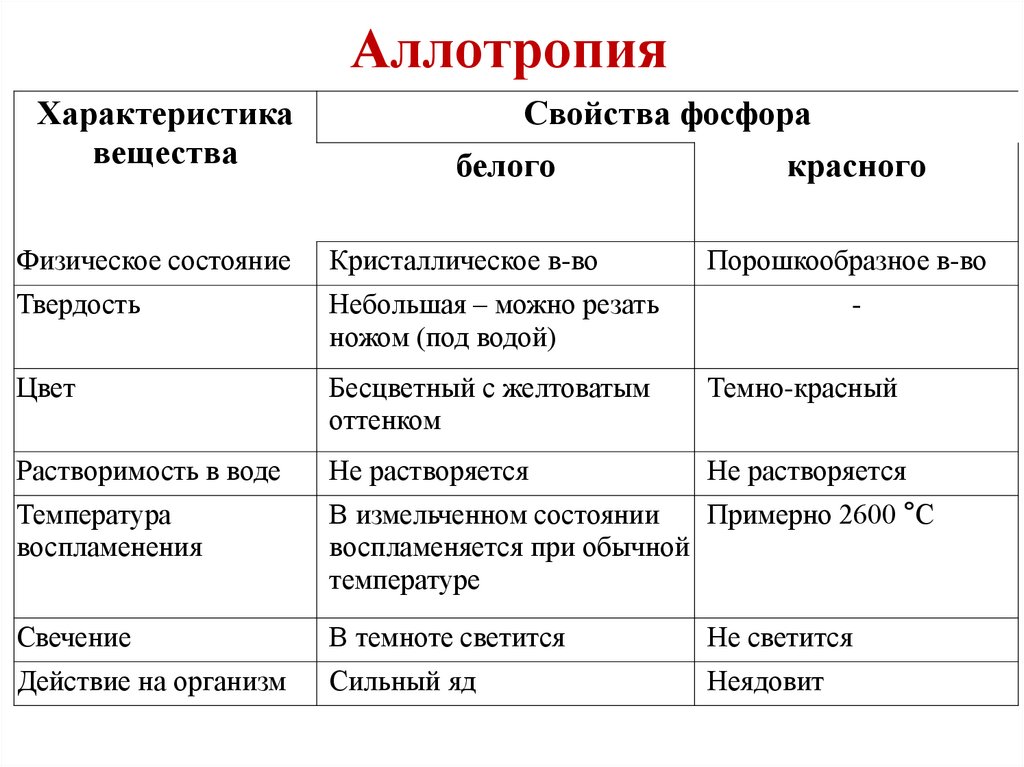
АллотропияХарактеристика
вещества
Свойства фосфора
белого
красного
Физическое состояние
Кристаллическое в-во
Порошкообразное в-во
Твердость
Небольшая – можно резать
ножом (под водой)
Цвет
Бесцветный с желтоватым
оттенком
Темно-красный
Растворимость в воде
Не растворяется
Не растворяется
Температура
воспламенения
Примерно 2600 °С
В измельченном состоянии
воспламеняется при обычной
температуре
Свечение
В темноте светится
Не светится
Действие на организм
Сильный яд
Неядовит
-
4.
Химические свойства1. С металлами
3Сa + 2P = Ca3P2 фосфид кальция
Сa3P2 + 6HCl = CaCl2 + PH3
фосфин
1. Горение
4P + 5O2 = 2P2O5
оксид фосфора (V)
5.
Соединения фосфораP2O5 оксид фосфора (V)
кислотный оксид
P2O5 +3H2O = 2H3PO4
ортофосфорная кислота
P2O5 + H2O = 2HPO3
метафосфорная кислота
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
6.
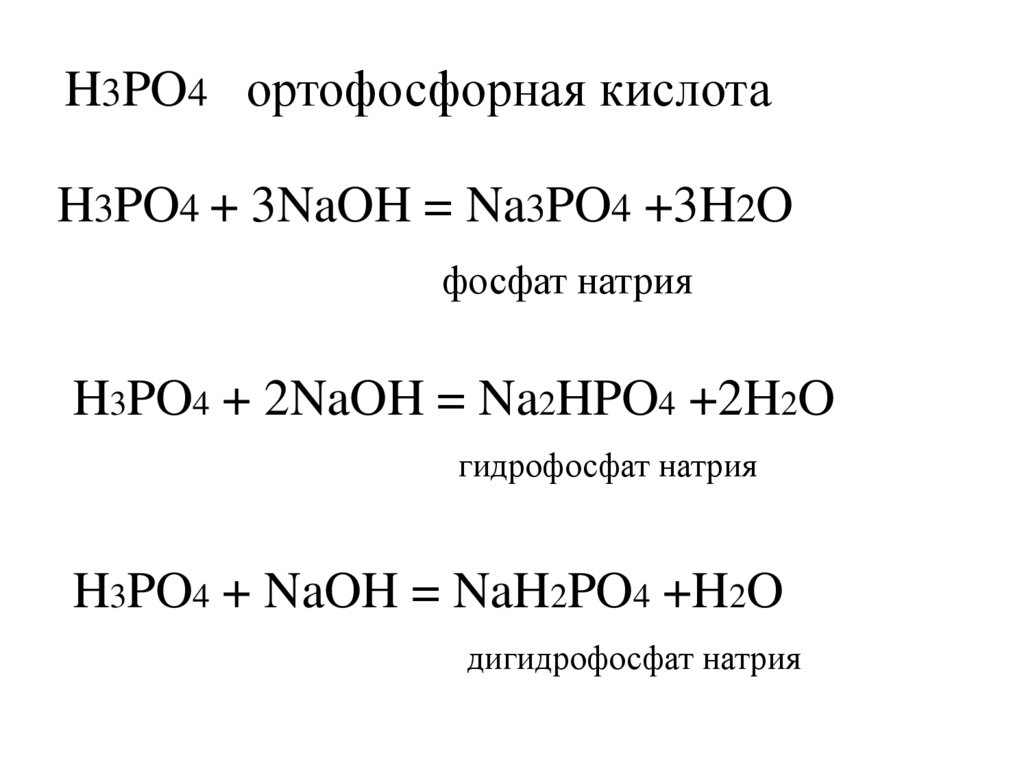
H3PO4 ортофосфорная кислотаH3PO4 + 3NaOH = Na3PO4 +3H2O
фосфат натрия
H3PO4 + 2NaOH = Na2HPO4 +2H2O
гидрофосфат натрия
H3PO4 + NaOH = NaH2PO4 +H2O
дигидрофосфат натрия
7.
8.
9.
10.
Ca3(PO4)2 + SiO2+C = CaSiO3 + P + COКакую массу фосфора можно
получить из 290,6 г. фосфорита,
содержащего 20% примесей?
Ca3(PO4)2 +3SiO2+5C=3CaSiO3+2P+5CO
m= 290,6х0,8 = 232,5(г)
M(Ca3(PO4)2)=310 г/ моль
n= 232,5/ 310= 0,75 моль
n(P) = 2nCa3(PO4)2 =1,5 моль
m= 1,5х31= 46,5 г
11.
Домашнее задание:п. 28, упр.3
12.
Урок окончен.Спасибо за внимание!









 Химия
Химия








