Похожие презентации:
Неметаллы
1. НЕМЕТАЛЛЫ Титков Иван 9 класс
г. Екатеринбург2. НЕМЕТАЛЛЫ - химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и
НЕМЕТАЛЛЫхимические
элементы, которые образуют в
свободном состоянии простые
вещества, не обладающие
физическими и химическими
свойствами металлов.
-
3.
Свойства неметаллов:1. Отсутствие металлического блеска
(исключение – кремний)
I - йод
C - углерод
S - сера
Si - кремний
4.
Свойства неметаллов:2. Низкая теплопроводность (газовая прослойка –
наилучший теплоизолятор)
3. Низкая электрическая проводимость
(исключение – графит)
5.
Свойства неметаллов:4. Высокие значения потенциала ионизации
e
+11 Na
0
-
-
-
2e , 8e , 1e +
или
e
Na
0
-
+9 F
0
-
2e , 7e
+
Na F
-
-
+
F
0
+
Na F
_
_
6.
Свойства неметаллов:5. Хрупкость
7.
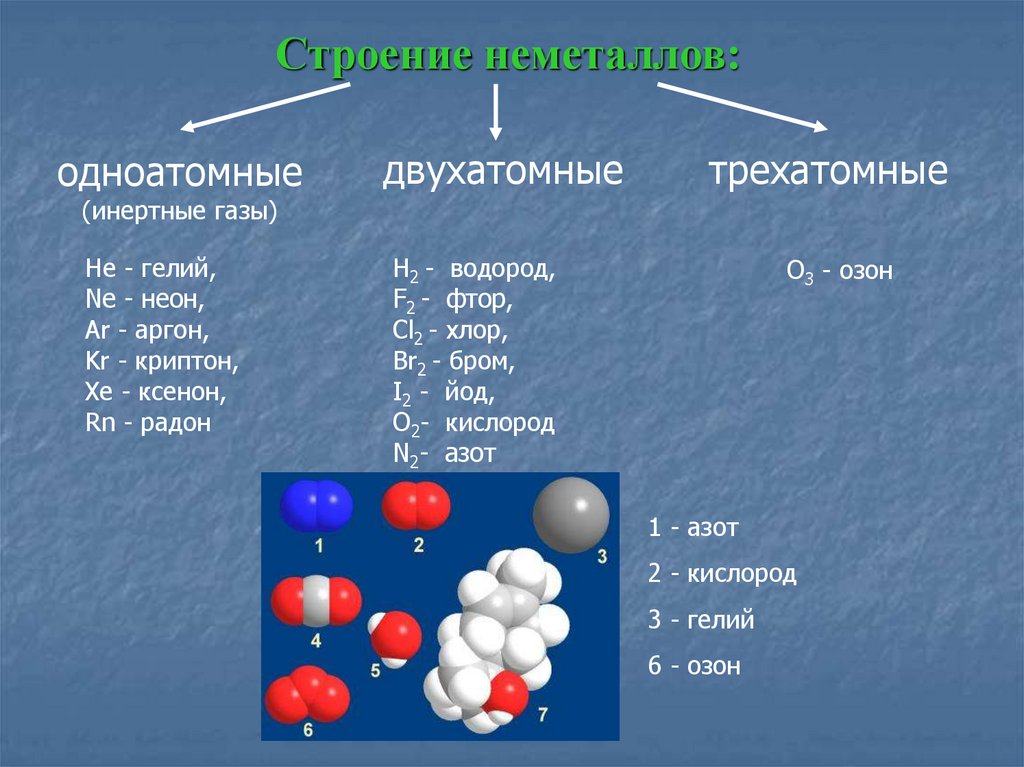
Строение неметаллов:одноатомные
двухатомные
трехатомные
(инертные газы)
He - гелий,
Ne - неон,
Ar - аргон,
Kr - криптон,
Xe - ксенон,
Rn - радон
H2 - водород,
F2 - фтор,
Cl2 - хлор,
Br2 - бром,
I2 - йод,
O2- кислород
N2- азот
O3 - озон
1 - азот
2 - кислород
3 - гелий
6 - озон
8.
Свойства неметаллов:У атомов элементов-неметаллов в периоде с увеличением порядкового
номера:
- заряд ядра увеличивается;
- радиусы атомов уменьшаются;
- число электронов на внешнем слое увеличивается;
- число валентных электронов увеличивается;
- электроотрицательность увеличивается;
- окислительные (неметаллические) свойства усиливаются (кроме
элементов VIIIA группы).
У атомов элементов-неметаллов в подгруппе (или в группе) с увеличением
порядкового номера:
- заряд ядра увеличивается;
- радиус атома увеличивается;
- электроотрицательность уменьшается;
- число валентных электронов не изменяется;
- число внешних электронов не изменяется (за исключением водорода и
гелия);
- окислительные (неметаллические) свойства ослабевают (кроме элементов
VIIIA группы).
9.
Химические свойства неметаллов:Характерными для большинства неметаллов являются
окислительные свойства:
- с металлами:
Ca + Cl2 = CaCl2
4Li + O2 = 2Li2O
- с менее электротрицательными неметаллами:
H2 + S = H2S
P4 + 5O2 = 2P2O5
- со сложными веществами:
2FeCl2 + Cl2 = 2FeCl3
CH4 + Br2 = CH3Br + HB
10.
Химические свойства неметаллов:Менее характерны для неметаллов
восстановительные свойства:
-
с более электротрицательными неметаллами:
Si + 2F2 = SiF4
C + O2 = CO2
C + 2S = CS2
- со сложными веществами:
H2 + HCHO = CH3OH
6P + 5KClO3 = 5KCl + 3P2O5
11.
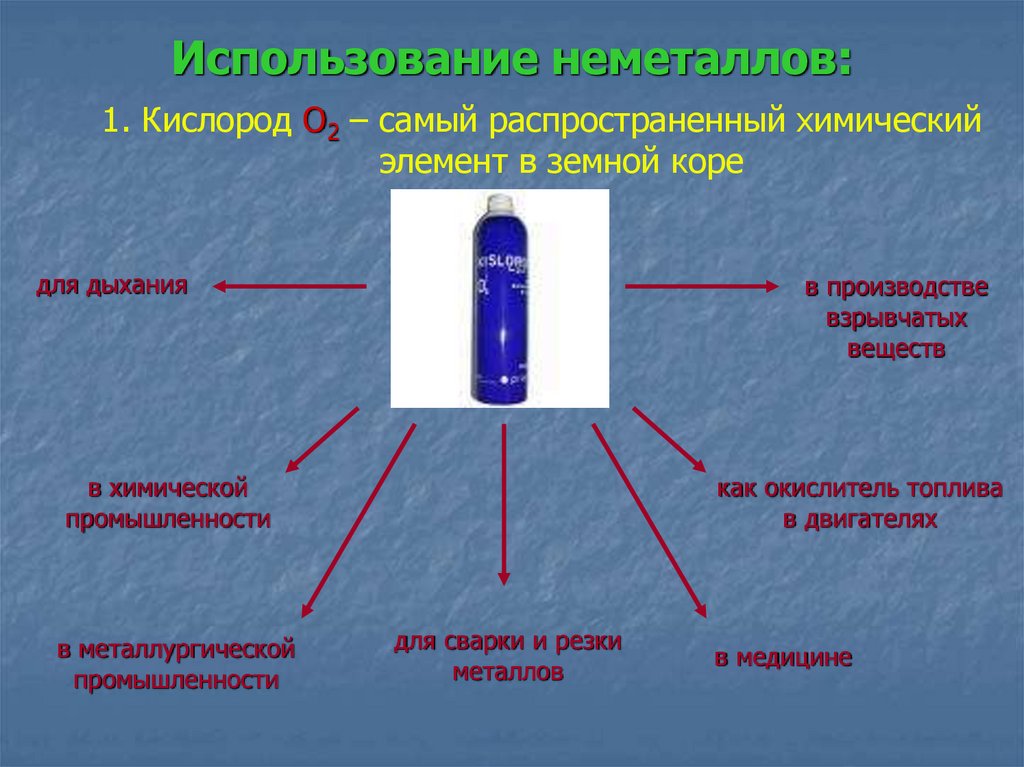
Использование неметаллов:1. Кислород О2 – самый распространенный химический
элемент в земной коре
для дыхания
в производстве
взрывчатых
веществ
в химической
промышленности
в металлургической
промышленности
как окислитель топлива
в двигателях
для сварки и резки
металлов
в медицине
12.
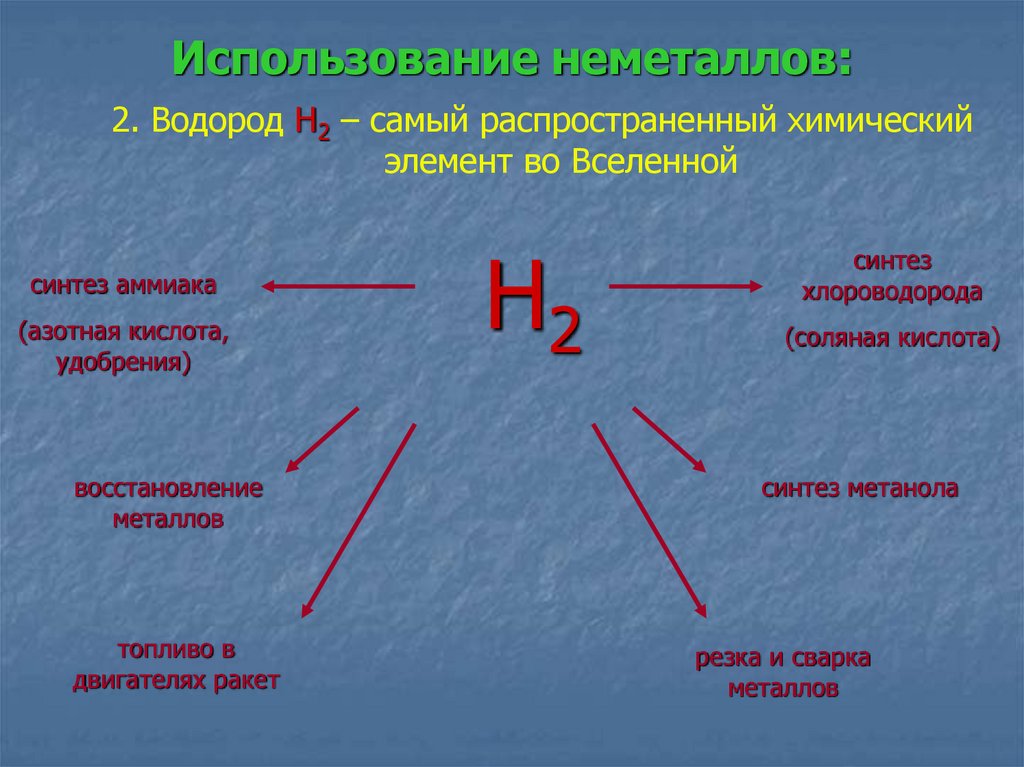
Использование неметаллов:2. Водород Н2 – самый распространенный химический
элемент во Вселенной
синтез аммиака
(азотная кислота,
удобрения)
восстановление
металлов
топливо в
двигателях ракет
Н2
синтез
хлороводорода
(соляная кислота)
синтез метанола
резка и сварка
металлов
13.
Использование неметаллов:3. Вода Н2О – универсальный растворитель, самое
распространенное вещество на Земле
Вода применяется для:
• в жизни растений, животных и человека;
• в быту;
• в различных отраслях промышленности и сельского хозяйства;
• для получения щелочей;
• для получения кислот;
• для получения водорода.
14.
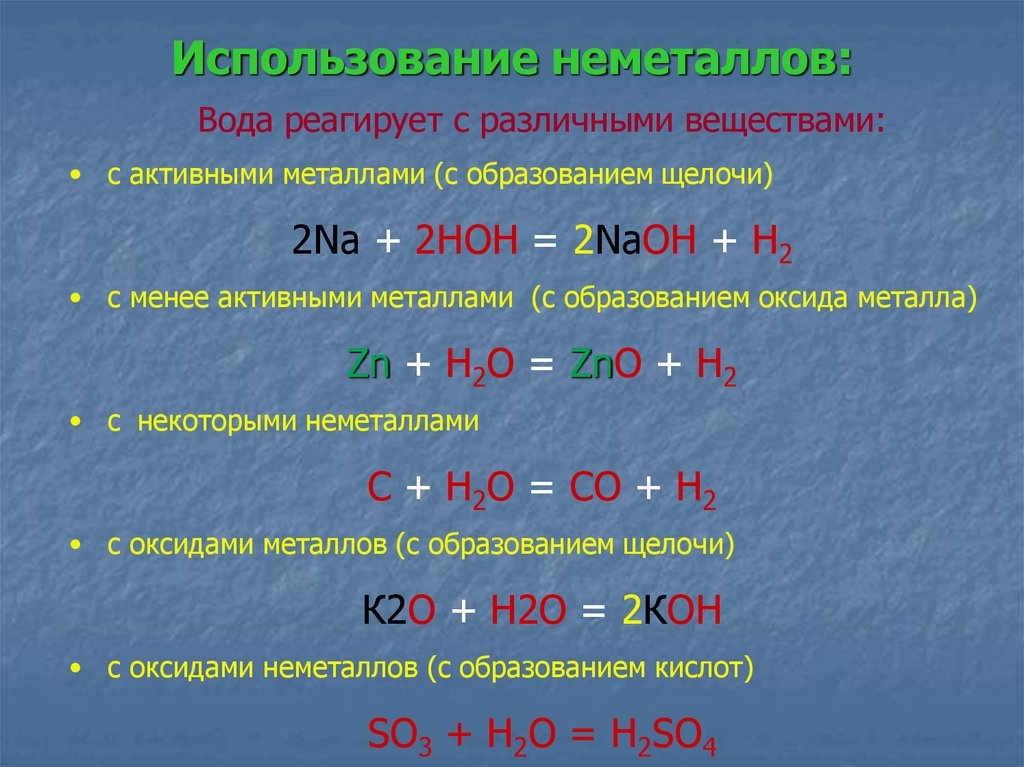
Использование неметаллов:Вода реагирует с различными веществами:
• с активными металлами (с образованием щелочи)
2Na + 2HOH = 2NaOH + H2
• с менее активными металлами (с образованием оксида металла)
Zn + H2O = ZnO + H2
• с некоторыми неметаллами
С + Н2О = СО + Н2
• с оксидами металлов (с образованием щелочи)
К2О + Н2О = 2КОН
• с оксидами неметаллов (с образованием кислот)
SO3 + H2O = H2SO4
15.
Использование неметаллов:4. Азот Н2
Специальные
ткани
N2
Лекарства
азотная кислота
удобрения
топливо в
двигателях ракет
взрывчатые
вещества
16.
Использование неметаллов:5. Фосфор Р
P
Зажигательные
вещества
удобрения
фосфорная
кислота
Лекарства
Участие в обмене
веществ организмов
17.
Использование неметаллов:6. Галогены F2, Cl2, Br2, I2
Хлор Cl2
НCl
NaCl
Фтор F2
НF
НBr
Лекарства
Йод I2
Бром Br2
НI













 Химия
Химия








