Похожие презентации:
Неметаллы
1. Неметаллы
НЕМЕТАЛЛЫВыполнила:Мальцева Арина
Ученица 11 класса А
МБОУ СОШ №18
г.Новороссийск
2.
НЕМЕТАЛЛЫ - химические элементы, которые образуют в свободном состояниипростые вещества, не обладающие физическими и химическими свойствами металлов .
3. Свойства неметаллов:
СВОЙСТВА НЕМЕТАЛЛОВ:1.Отсутствие металлического блеска (исключение – кремний) I - йод C - углерод S - сера Si – кремний
2.Низкая теплопроводность (газовая прослойка –наилучший теплоизолятор)
3.Низкая электрическая проводимость (исключение – графит)
4.Хрупкость
У атомов элементов-неметаллов в периоде с увеличением порядкового номера:
-заряд ядра увеличивается;
-радиусы атомов уменьшаются;
-число электронов на внешнем слое увеличивается;
-число валентных электронов увеличивается;
-электроотрицательность увеличивается;
У атомов элементов-неметаллов в подгруппе (или в группе) с увеличением порядкового номера:
- заряд ядра увеличивается;
- радиус атома увеличивается;
-электроотрицательность уменьшается;
-число валентных электронов не изменяется;
-число внешних электронов не изменяется (за исключением водорода и гелия);
-окислительные (неметаллические) свойства ослабевают (кроме элементов VIIIA группы).
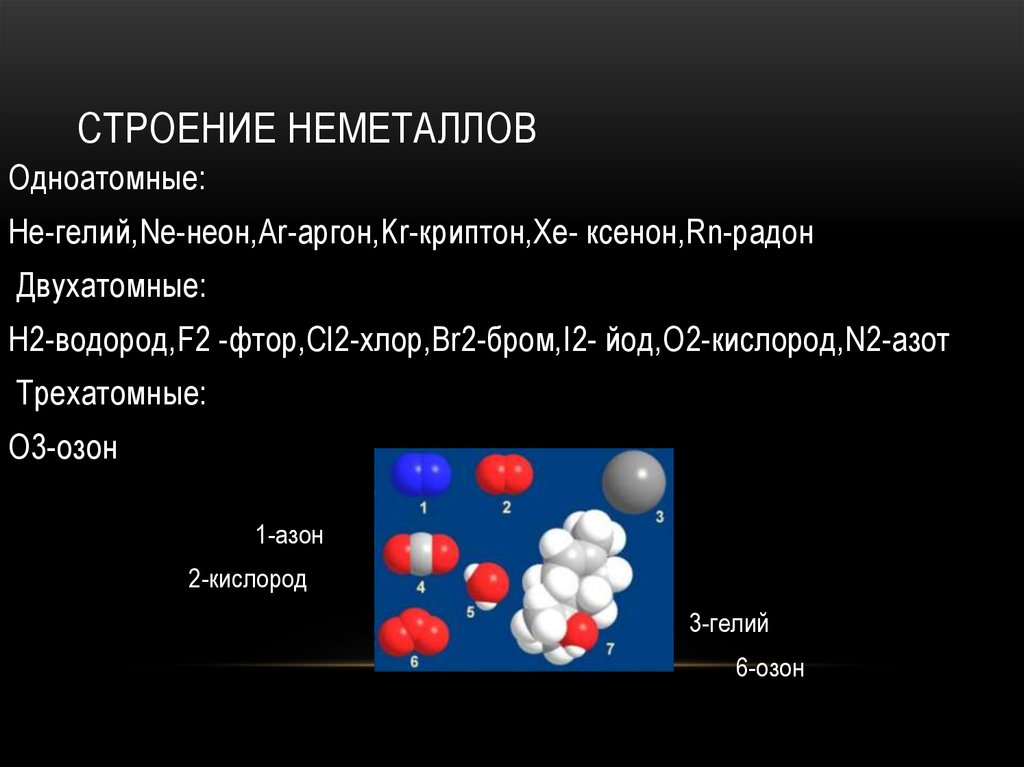
4. Строение неметаллов
СТРОЕНИЕ НЕМЕТАЛЛОВОдноатомные:
He-гелий,Ne-неон,Ar-аргон,Kr-криптон,Xe- ксенон,Rn-радон
Двухатомные:
H2-водород,F2 -фтор,Cl2-хлор,Br2-бром,I2- йод,O2-кислород,N2-азот
Трехатомные:
О3-озон
1-азон
2-кислород
3-гелий
6-озон
5.
Сера является жизненно важным элементом для живых организмов, является составной частьюбелка. Она способствует нейтрализации в организме ядовитых веществ, роста хрящевой и костной
тканей, кожи, волос, ногтей. Вместе с другими компонентами участвует в формировании структуры
соединительной ткани. Дефицит серы может привести к нарушению синтеза инсулина. Кожа
становится сухой, морщинистой, появляются трещины, наступает раннее старение организма. Серу
используют для извлечения серной кислоты, изготовление резины из каучука, производства спичек,
черного пороха, лекарственных препаратов.
Азот используют для наполнения электролампочек, создания инертной среды при сварке
металлов, в вакуумных установках, глубокого охлаждения и замораживания, добыча
аммиака, азотной кислоты, нитратов.
Фосфор в организме является источником энергии. В промышленности для создания
моющих средств, для смягчения воды. Фосфорорганические соединения для борьбы с
сорняками. Красный фосфор для изготовления спичек, дымовых завес,
фосфорорганических соединений, полимеров, против коррозии, полупроводников, для
уничтожения насекомых.
6. Применение:
ПРИМЕНЕНИЕ:Хлор применяют для производства соляной кислоты, винилхлорида, каучука и многих
органических веществ и пластмасс, в текстильной и бумажной промышленности используют
в качестве отбеливающего средства, в быту – для обеззараживания питьевой воды.
Кварц очень мало расширяется при нагревании, поэтому кварцевый посуду, раскаленный
добела, не трескается, если погрузить в холодную воду. Кварц используют в изготовлении
мониторов компьютеров, линз телескопов, хрустальные изделия, зеркала, в радиотехнике,
оптике, в ювелирном деле.
Бром и йод используют в синтезе полимерных материалов, для приготовления
лекарственных препаратов и др.
7.
Графит для изготовления огнеупорных тиглей, синтетических алмазов, масел, электродов,труб, теплообменников, грифелей для карандашей. В ядерных реакторах в качестве
замедлителя нейтронов.
Уголь для выплавки чугуна и стали, производство черного пороха, красок, для поглощения
газов, очистки их. Активированный уголь — в медицине в качестве адсорбента, для
изготовления противогазов, как катализатор, для очистки сахара от примесей, улавливания
ценных органических растворителей.








 Химия
Химия








