Похожие презентации:
Оксид серы IV. Сернистая кислота
1.
ОТВЕТЬТЕ НА ВОПРОСЫ ТЕСТА:1)Распределение электронов в атоме серы:
2,6
2,8,8
2,8,6
2,8,8,6
2)Сера –более сильный окислитель, чем::
Фтор;
Хлор;
Фосфор;
Кислород.
2.
ОТВЕТЬТЕ НА ВОПРОСЫ ТЕСТА:3) Атомы кислорода и серы имеют:
Одинаковое число электронных слоев;
Одинаковое число валентных электронов;
Одинаковое число протонов в ядре;
Одинаковый радиус атомов.
4) Возможные степени окисления серы….
5) Газ, обладающий запахом тухлых яиц, образующийся при растворении в воде
слабую кислоту :
Сернистый;
Угарный;
Сероводород;
Йодоводород .
3.
ОТВЕТЬТЕ НА ВОПРОСЫ ТЕСТА:• 6) Какими окислительно-восстановительными свойствами обладает
сероводород?
• Окислитель
Восстановитель
Окислитель-восстановитель
7)К какой по силе кислоте относится сероводородная кислота?
Кислота средней силы
Слабая кислота
Сильная кислота
8). Какие соли образует сероводородная кислота?
Сульфиты
Сульфиды
Сульфаты
4.
ОТВЕТЬТЕ НА ВОПРОСЫ ТЕСТА:• 9) При помощи какого катиона можно обнаружить анион
S2-?
Na+
Ba2+
Pb2+
10) Как называются кислые соли сероводородной кислоты?
Гидросульфиды
Дигидросульфиты
Гидросульфиты
5.
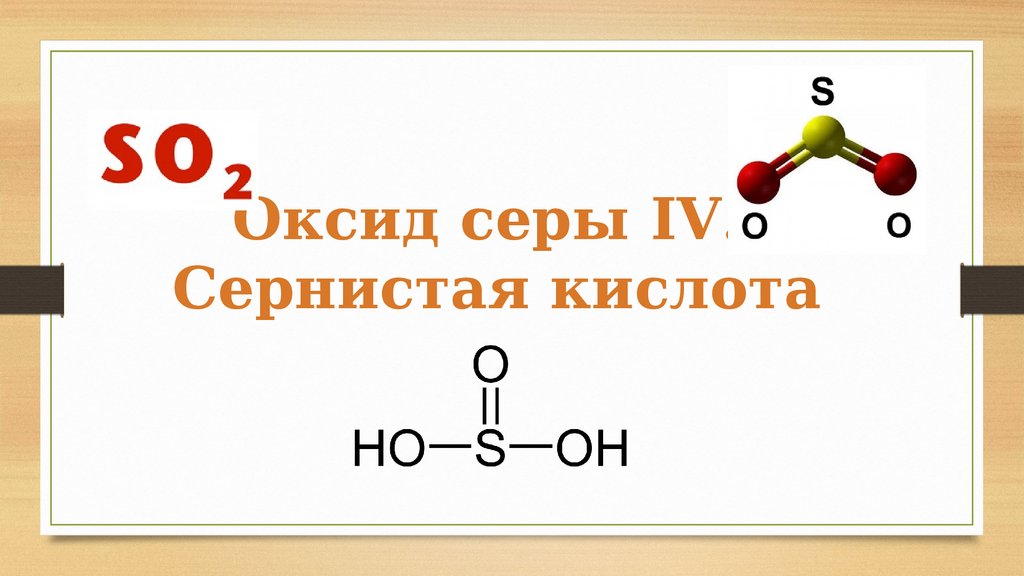
Оксид серы IV.Сернистая кислота
6.
Соотнесите формулы веществ и степени окисления серы в них-2
-1
0
+2
+4
+6
7.
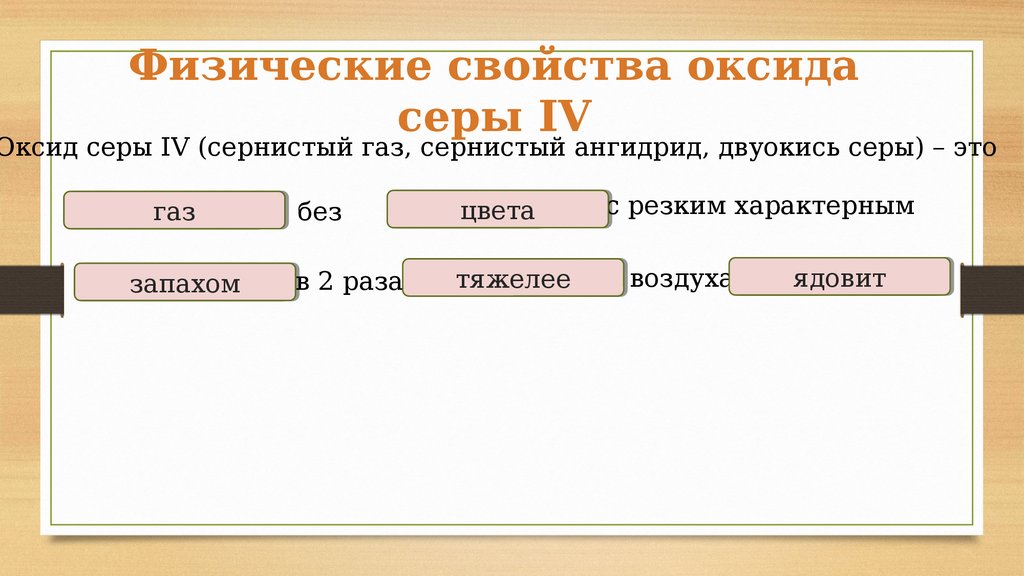
Физические свойства оксидасеры IV
Оксид серы IV (сернистый газ, сернистый ангидрид, двуокись серы) – это
газ
газ
запахом
запахом
без
цвета
цвета
в 2 раза
тяжелее
тяжелее
с резким характерным
воздуха,
ядовит
ядовит
8.
Химические свойстваСо времен Гомера известен этот оксид –
бесцветный газ с резким запахом.
Одиссей, хитроумный герой Троянской
войны, окуривал им помещение, в
котором сражался, и в конце концов
победил женихов Пенелопы. Плиний
Старший, римский историк (23-79 гг. н.
э.), тоже упоминал в своих сочинениях о
газообразном оксиде, который
уничтожает инфекцию и вредных
насекомых. Тот же оксид стал причиной
смерти Плиния во время извержения
Везувия в 79 г н.э. Когда «газ Одиссея»
смешивают с влажным сероводородом,
выделяется сера, а пероксид водорода в
водном растворе превращает его в
сильную кислоту.
9.
Химические свойства оксида+4 -e
- 2 -e серы IV
+6
S
восстановитель
+4
SO2
окислитель
0
S
10.
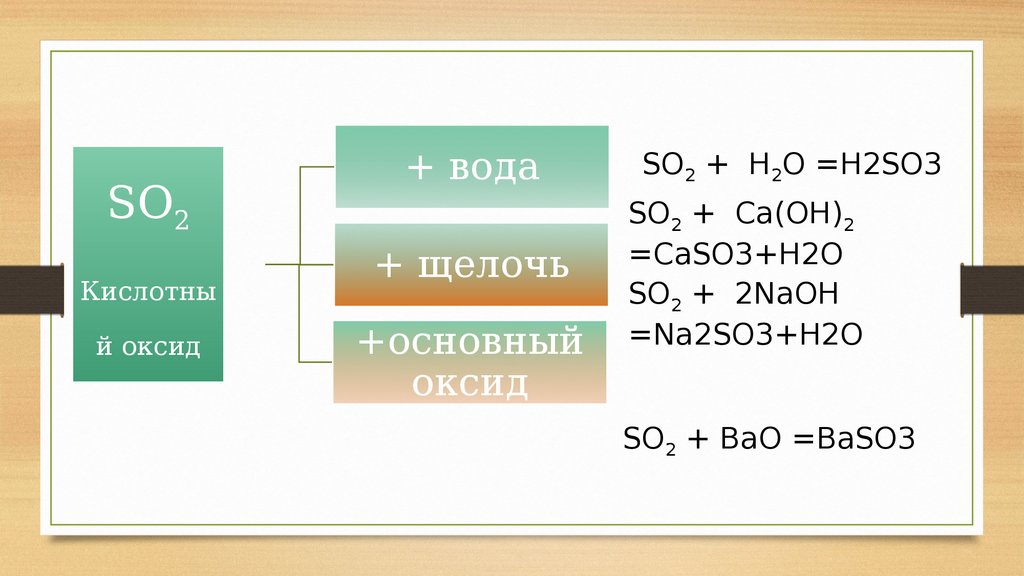
SO2Кислотны
й оксид
+ вода
+ щелочь
+основный
оксид
SO2 + H2O =H2SO3
SO2 + Ca(OH)2
=CaSO3+H2O
SO2 + 2NaOH
=Na2SO3+H2O
SO2 + BaO =BaSO3
11.
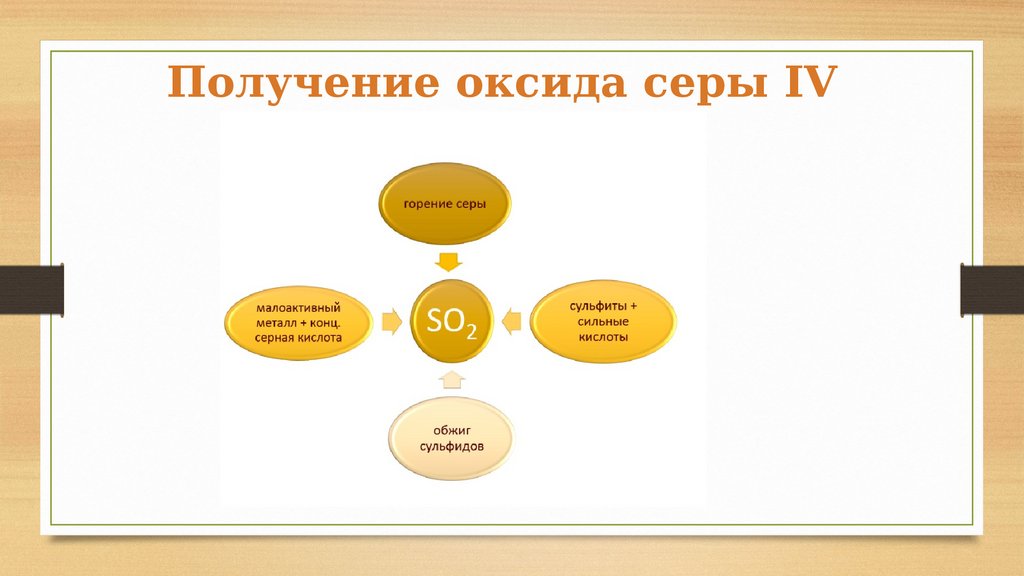
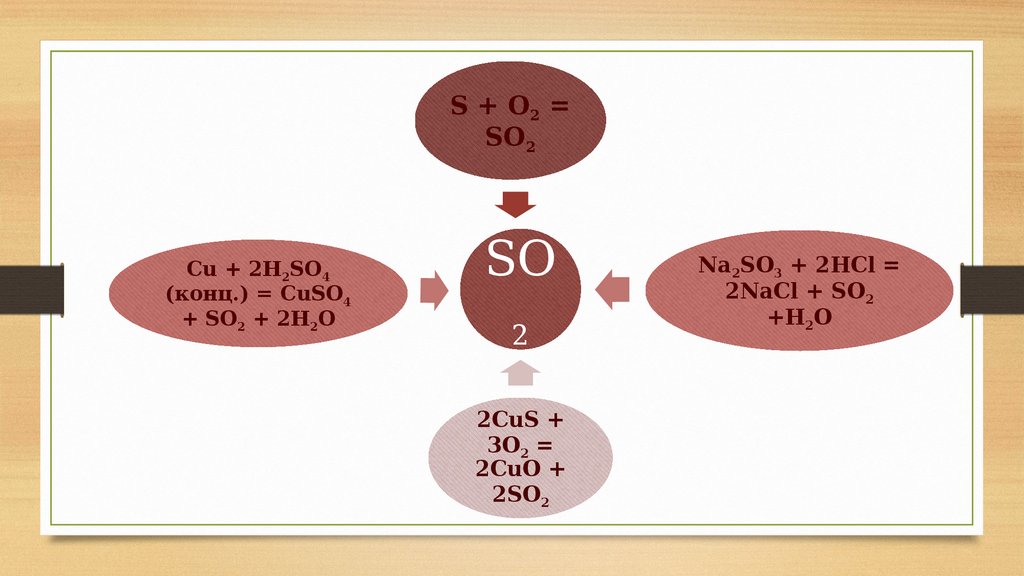
Получение оксида серы IV12.
S + O2 =SO2
Cu + 2H2SO4
(конц.) = CuSO4
+ SO2 + 2H2O
SO
2
2CuS +
3O2 =
2CuO +
2SO2
Na2SO3 + 2HCl =
2NaCl + SO2
+H2O
13.
SO2
Вреден или полезен?
14.
15.
Сернистая кислота - H2SO316.
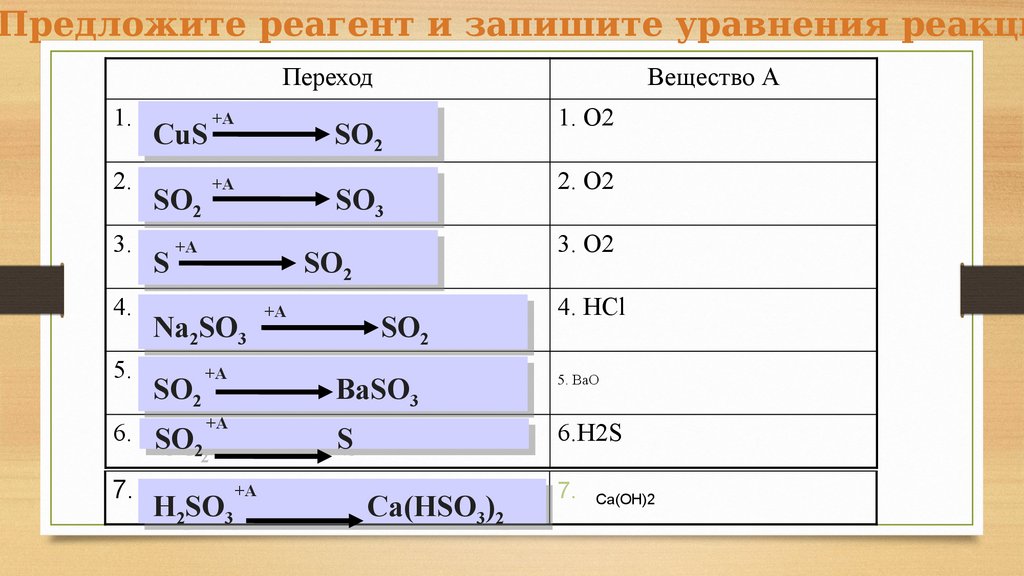
Предложите реагент и запишите уравнения реакциПереход
1.
2.
3.
4.
5.
+A
+A
СuS
СuS
SO
SO22
SO
SO22
+A
+A
SO
SO33
+A
+A
SS
Na
Na22SO
SO33
+A
+A
+A
+A
H
H22SO
SO33
+A
+A
1. O2
2. O2
3. O2
SO
SO22
SO
SO22
+A
6. SO +A
SO22
7.
Вещество А
SO
SO22
BaSO
BaSO33
SS
Ca(HSO
Ca(HSO33))22
4. HCl
5. BaO
6.H2S
7.
Ca(OH)2
17.
Задание № 2Серу сожгли в избытке кислорода, образовавшееся вещество растворили в воде,
образовавшемуся раствору прилили гидроксид бария, наблюдали выпадение белого осадка.
Составьте уравнения описанных реакций.
18.
Домашнее задание:1)Прочитать пар.20. Записать конспект по теме «Оксид серы (IV).
Сернистая кислота»
2) Письменно:
Осуществить превращения:
S → H2S →SO2 →K2SO3 →BaSO3
Решить задачу: Вычислите объем сероводорода,
образовавшегося при реакции соляной кислоты с
10г сульфида железа (II), содержащего 15%
примесей.
19.
По желанию рассмотреть и записать задачуЗадача:
В оксиде серы на 1 массовую часть серы
приходится 1 массовая часть кислорода.
Установите формулу вещества. Запишите
формулу соответствующего гидроксида.
SxOy - ?
20.
Задача:В оксиде серы на 1 массовую часть серы
приходится 1 массовая часть кислорода.
Установите формулу вещества. Запишите
формулу соответствующего гидроксида.
SxOy - ?
Решение:
v (S):v(O) =1/32:1/16 = 0,03125 : 0,0625= 1:2
Ответ:
Оксид серы IV – SO2
Соответствующий гидроксид – сернистая
кислота – H2SO3














 Химия
Химия








