Похожие презентации:
Биология и биомедицина
1.
Биология и биомедицинаБиологические
исследования в медицине
Молекулярная биология и
биохимия
Медицинские технологии
https://vk.com/biomedtechnology
ВК-сообщество
2.
3.
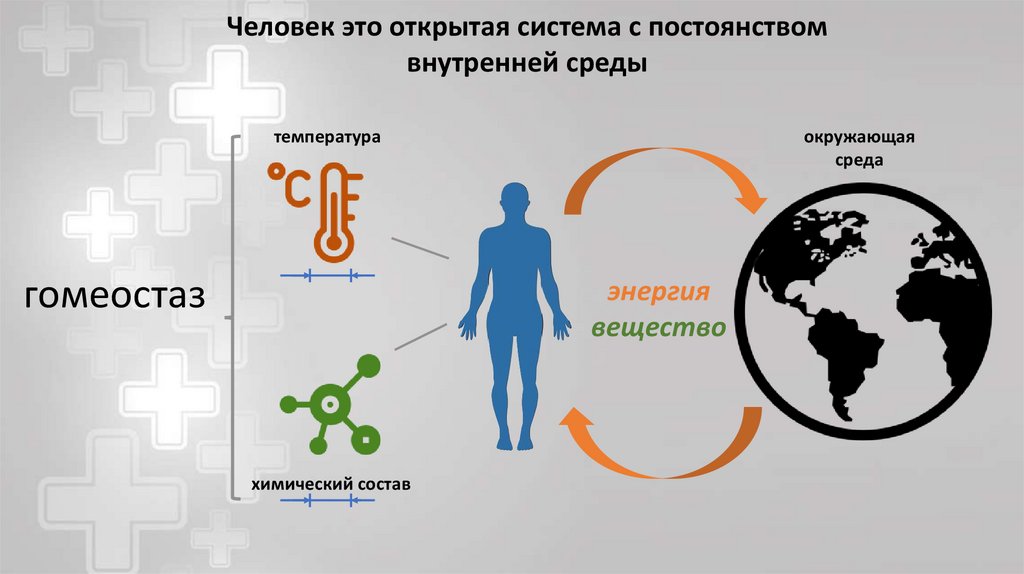
Человек это открытая система с постоянствомвнутренней среды
температура
гомеостаз
окружающая
среда
энергия
вещество
химический состав
4.
Постоянствокислотно,
основного
состояния
5.
Показатели КОСАбсолютные
pCO2 парциальное
давление углекислого газа
BB буферные основания
крови
и другие
Относительный
pH
6.
Показателькислотности
pH
7.
слюна pH 6,5 - 7,5межклеточная жидкость
pH 7,36 – 7,44
Справочник врача
https://www.rosmedlib.ru/doc/ISBN9785
970433911-0012/-esf2k2z11-tabrelmode-pgs.html
венозная кровь pH
7,32– 7,42
желудочный сок
pH 1,5 – 2
жёлчь в пузыре
pH 5,4 – 6,9
моча pH 4,8 – 7,5
Источник: Литвинова Т.Н. Химия. Основы
химии для студентов медицинских вузов:
учебник для вузов, стр. 69
8.
pH введён датским физикомхимиком Сёренсеном в 1909 годуЗдание исследовательской лаборатории пивной компании «Карлсберг» в
Копенгагене, которой Сёренсен руководил с 1901 по 1938 гг.
Søren Peter
Lauritz Sørensen
9.
Показатель кислотности pHPotencia Hydrogenii (лат.) –
сила водорода
или
Pondus Hydrogenii – вес
водорода
+
H
10.
Почему pHэто
показатель
кислотности?
11.
Почему кислотности?Согласно теории Брёнстеда-Лоури (1923 год)
Кислота это молекула или ион - донор
протонов
(или ядер водорода, что то же самое)
Донор – то, что
отдаёт
HCl → H+ + ClОснование это молекула или ион - акцептор
протонов
NH3 + H+ → NH4+
Акцептор – то,
что принимает
12.
Кислота донор протоновОснование
протонов
акцептор
13.
Согласно теории БрёнстедаЛоури (1923 год) окислительновосстановительные реакции это«борьба за +протон»
H
14.
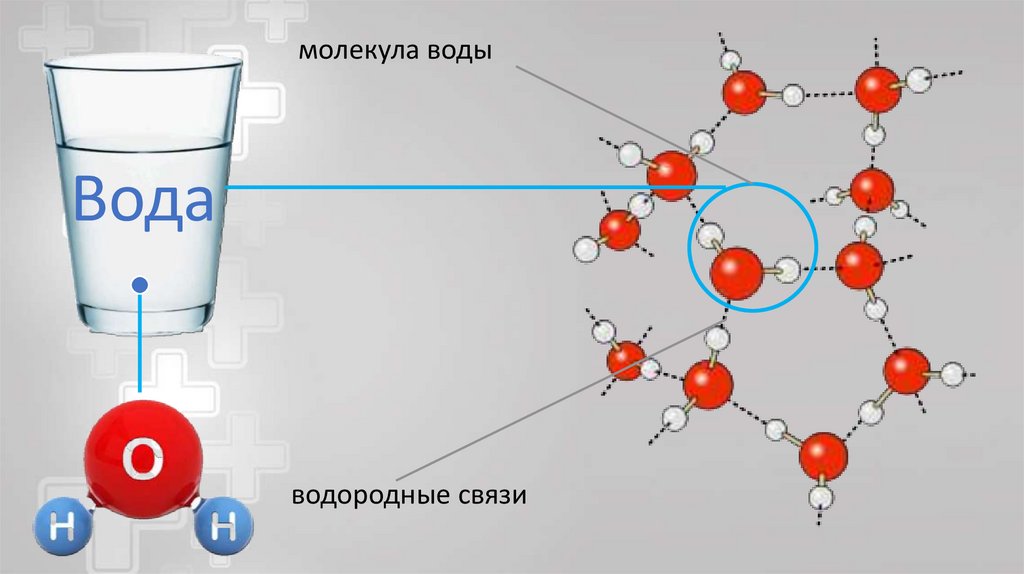
Рассмотрим …воду
15.
молекула водыВода
водородные связи
16.
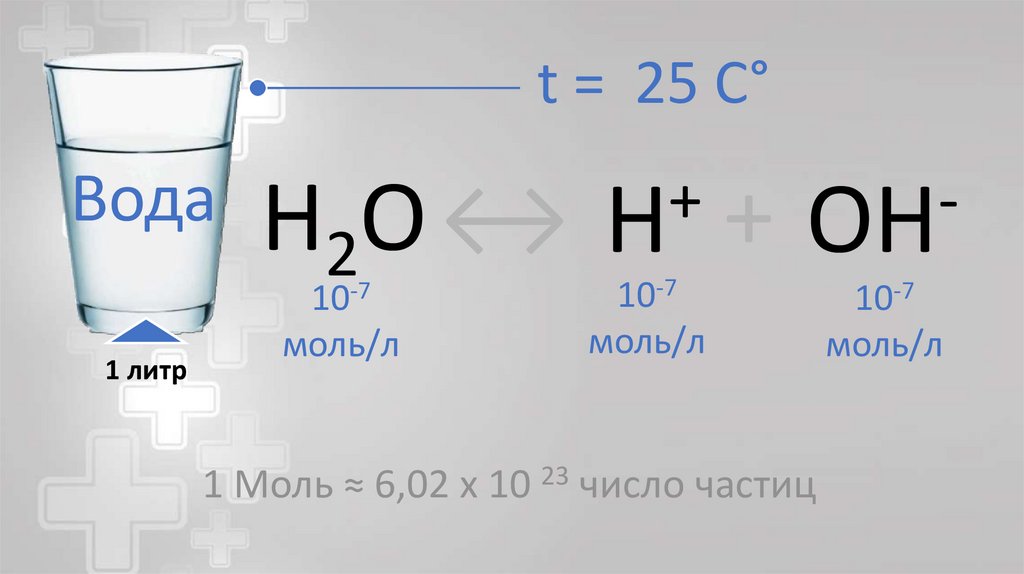
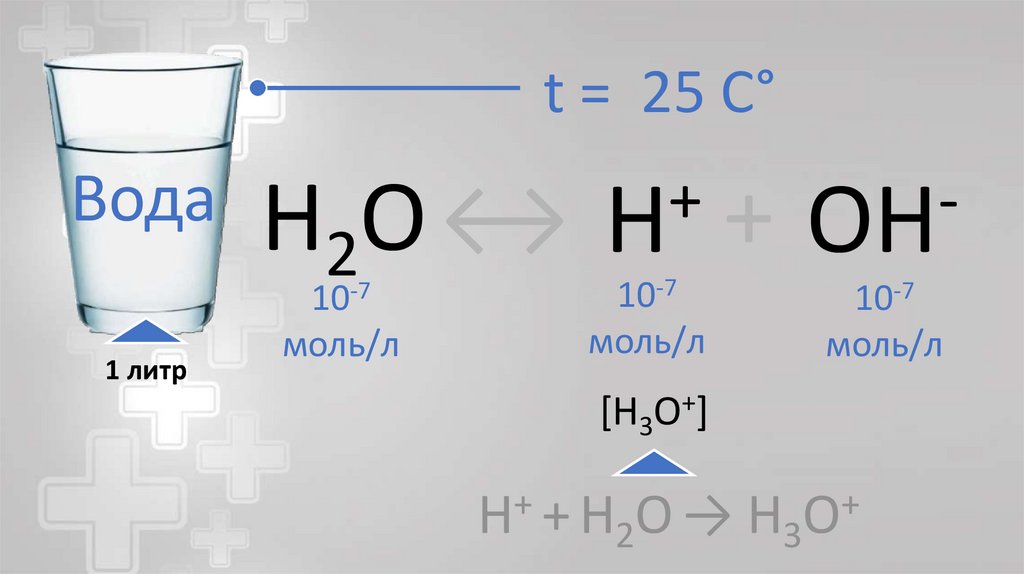
t = 25 C°Вода
1 литр
H2O ↔
10-7
моль/л
+
H
10-7
моль/л
+
OH
1 Моль ≈ 6,02 x 10 23 число частиц
10-7
моль/л
17.
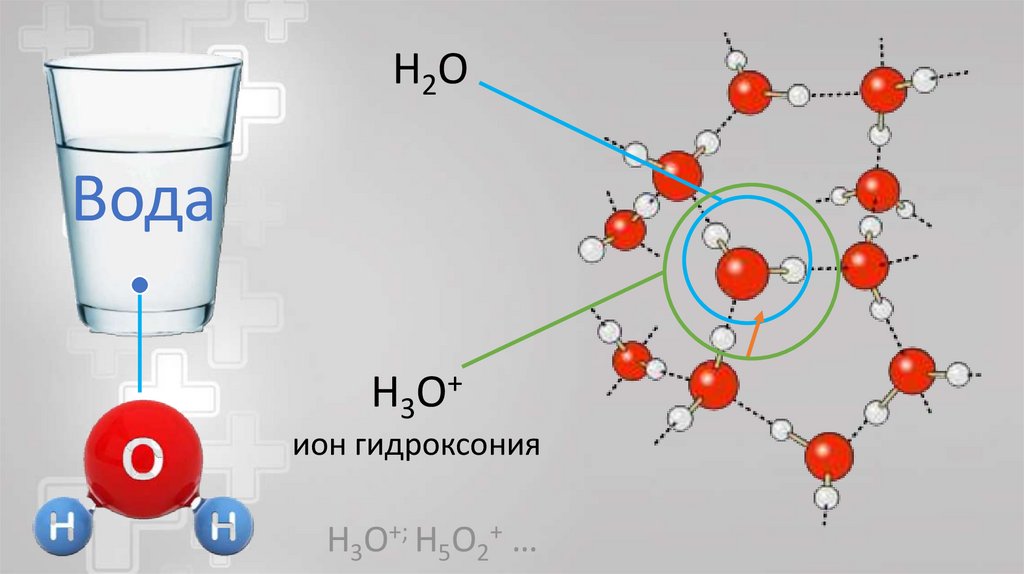
H2OВода
H 3 O+
ион гидроксония
H3O+; H5O2+ …
18.
t = 25 C°Вода
1 литр
H2O ↔
10-7
моль/л
+
H
+
10-7
моль/л
OH
10-7
моль/л
[H3O+]
+
H + H2O →
+
H3O
19.
Подходим к определению pH+
[H ]
-7
10
=
+
pH = - Lg [H ]
Введён для удобства счёта в оценке кислотности
20.
Подходим к определению pH+
[H ]
=
-7
10
pH = - Lg
+
[H ]
pH = - Lg
-7
(10 )
t = 25 C°
Lg X = Log10X
= - (-7) Lg 10 = 7
Lg 10 = Log1010 = 1
21.
Определение pHpH – это отрицательный
десятичный
логарифм
концентрации
ионов
водорода в растворе
pH = - Lg
+
(H )
22.
23.
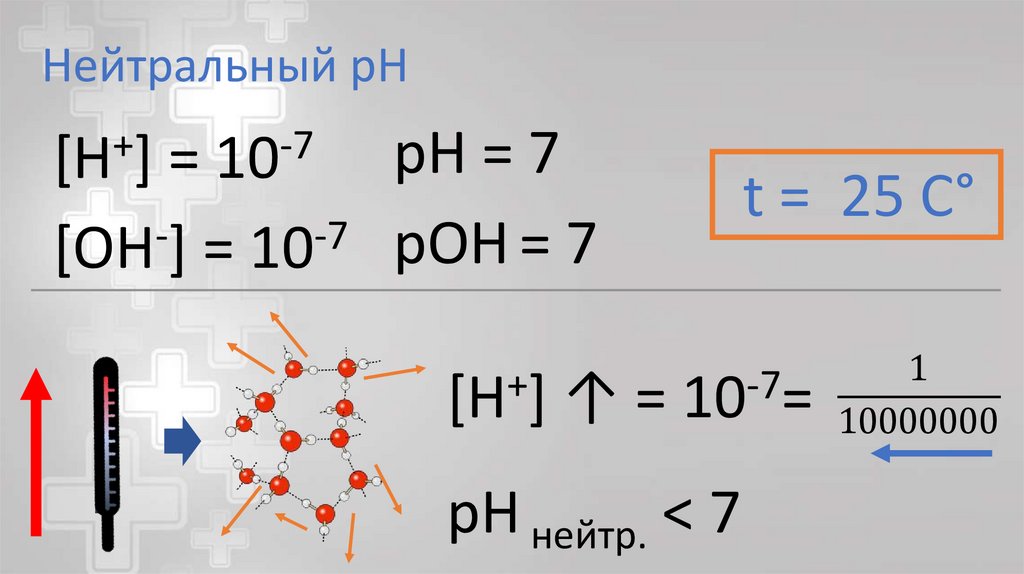
Нейтральный pHpH = 7
=
-7
[OH ] = 10 pOH = 7
+
[H ]
-7
10
+
[H ]
↑=
t = 25 C°
-7
10 =
pH нейтр. < 7
24.
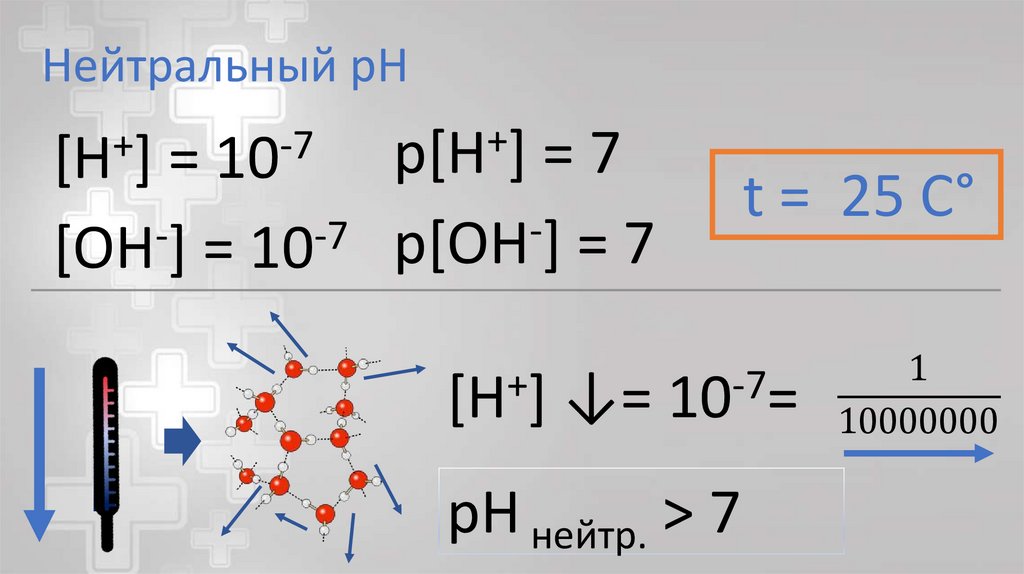
Нейтральный pH+
p[H ]
=7
=
-7
[OH ] = 10 p[OH ] = 7
+
[H ]
-7
10
+
[H ]
↓=
t = 25 C°
-7
10 =
pH нейтр. > 7
25.
Нейтральный и физиологичный pH вчеловеческом организме
Центральная
температура
–
температура
центральной нервной системы, внутренних органов и
брюшной полости
t = ~37 C°
pH нейтр. ~6,8
pH артериальной крови = 7,35 – 7,45
26.
Нарушения физиологичного pHpH артериальной крови = 7,35 – 7,45
pH < 7,35 - ацидоз
pH > 7,45 - алкалоз
лат. acidus кислый
позднелат. alcali щелочь
27.
Буферныесистемы
крови
28.
Буферные системы«Буфер» от английского «to buff» смягчать
толчки.
В химии «буферная система» - раствор,
сохраняющий постоянное значение pH при
добавлении кислот и щелочей, а также и при
его разведении.
29.
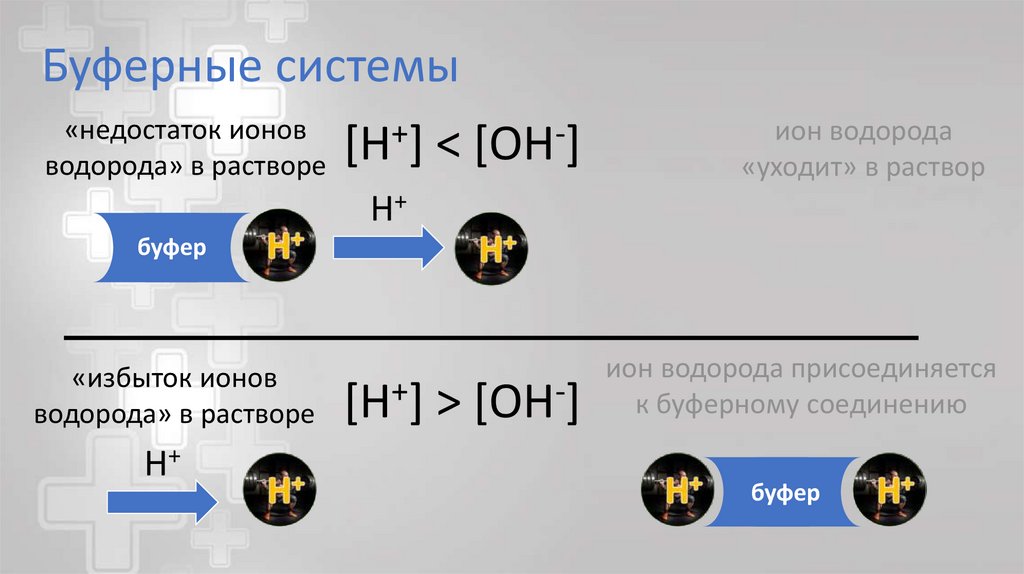
Буферные системы«недостаток ионов
водорода» в растворе
[H+]
<
[OH-]
ион водорода
«уходит» в раствор
H+
буфер
«избыток ионов
водорода» в растворе
H+
[H+] > [OH-]
ион водорода присоединяется
к буферному соединению
буфер
30.
Закрепим стихомPH есть водородный показатель,
Что в Дании
В далёком 1909
Сёренсен химик изобрел
Причина в том, что показатель наш
Есть минус логарифм от дробного числа.
При росте уровня H+ значений,
Знаменатель претерпевает уменьшение.
Он показатель этот ввёл,
Чтобы оценивать кислотность разных сред
Для нужд научных и различных промысловых
дел.
Стабильные значения pH важны
Для всех биологических процессов.
(7,35 - 7,45) в крови Наш организм поддерживать стремится.
PH можно расшифровать как "сила водорода“.
И в самом деле выражает он количество
протонов,
Которые среду как раз и закисляют,
Условия химических процессов этим изменяя.
Использует системы буферных растворов,
Которые способны поделиться
водородом,
Или его излишек захватить,
PH исходный уровень восстановить.
Особенность pH-метрической системы в том,
Что счёт идёт наоборот,
То есть, чем больше ионов водорода,
Тем меньше численно pH раствора.
Мастерская Философского Менеджмента, 2021
31.
Биология и биомедицинаБиологические
исследования в медицине
Молекулярная биология и
биохимия
Медицинские технологии
https://vk.com/biomedtechnology
ВК-сообщество
32.
Источники информацииУчебный фильм Medfors Урок 1 - рН - КЩС под силу каждому
https://www.youtube.com/watch?v=LK0NCfOR_NM
Введение в буферные растворы https://ru.khanacademy.org/science/biology/water-acids-andbases/acids-bases-and-ph/v/buffer-system
https://www.youtube.com/watch?v=n6FD-5zPGkc
Литвинова Т.Н. Хорунжий В.В. Химия. Основы химии для студентов медицинских вузов: учебник для
вузов
Справочник врачаhttps://www.rosmedlib.ru/doc/ISBN9785970433911-0012/-esf2k2z11-tabrel-modepgs.html
Википедия
Словарь Академик
https://dic.academic.ru/searchall.php?SWord=%D0%B0%D0%BB%D0%BA%D0%B0%D0%BB%D0%BE%D0%B
7&from=ru&to=xx&did=&stype=0
33.
Спасибоза
внимание

























 Биология
Биология








