Похожие презентации:
Сероводород
1.
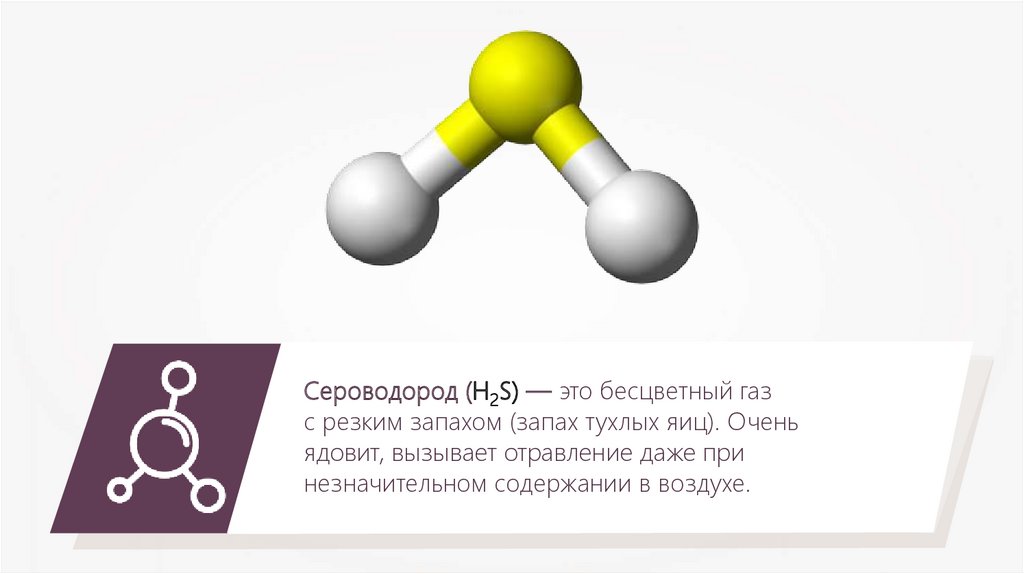
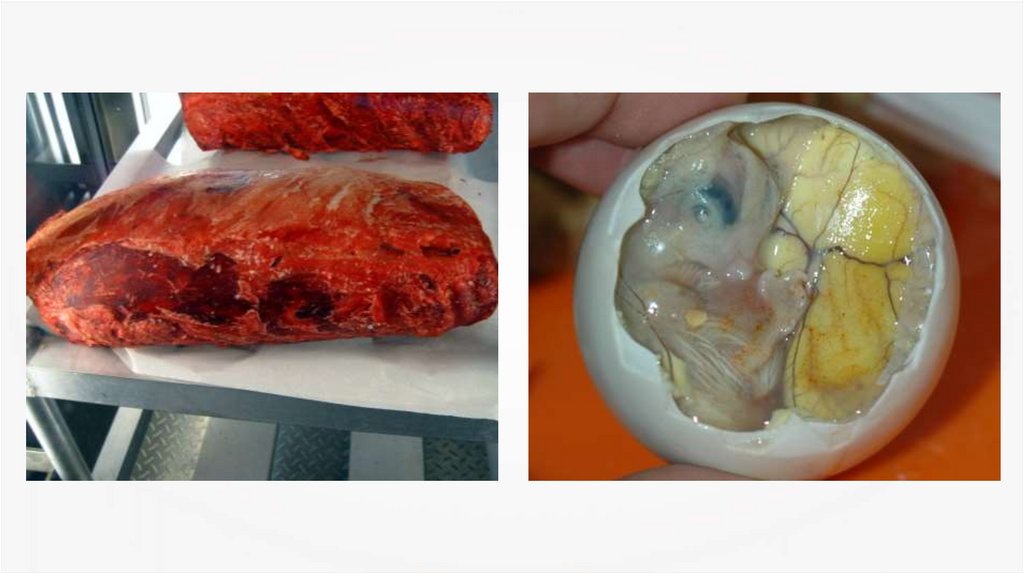
Сероводород (H2S) — это бесцветный газс резким запахом (запах тухлых яиц). Очень
ядовит, вызывает отравление даже при
незначительном содержании в воздухе.
2.
Сероводород также имеет лечебноезначение, он является составной частью
некоторых минеральных вод (Пятигорск,
Серноводск, Мацеста).
3.
4.
5.
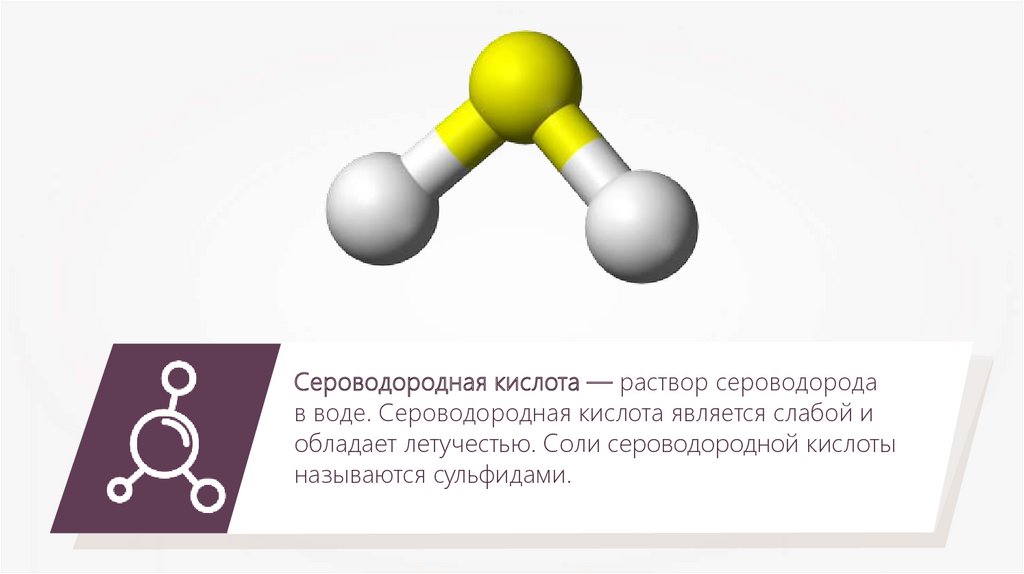
Сероводородная кислота — раствор сероводородав воде. Сероводородная кислота является слабой и
обладает летучестью. Соли сероводородной кислоты
называются сульфидами.
6.
Горение сероводородаГорение сероводорода в недостатке кислорода:
2H2S + O2 = 2H2O + 2S↓
Горение сероводорода в избытке кислорода:
2H2S + 3O2 = 2H2O + 2SO2↑
7.
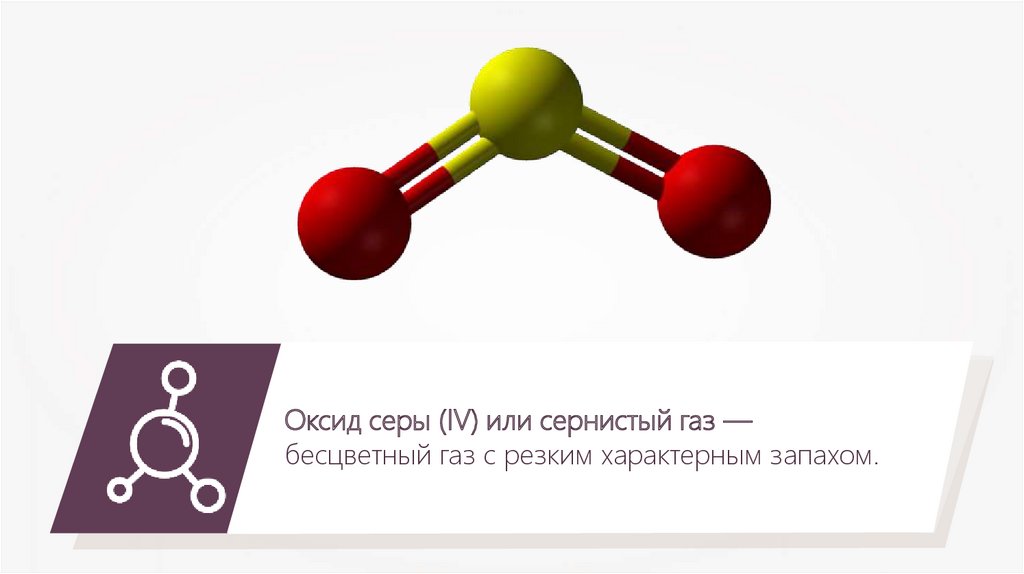
Оксид серы (IV) или сернистый газ —бесцветный газ с резким характерным запахом.
8.
Типы солей сернистой кислотыСернистая кислота — это слабая двухосновная кислота,
ей соответствуют два типа солей:
• средние — сульфиты;
Na2SO3, BaSO3
• кислые — гидросульфиты.
NaHSO3, Ba(HSO3)2
9.
Взаимодействие сернистого газа с кислородом2SO2 + O2 = 2SO3
10.
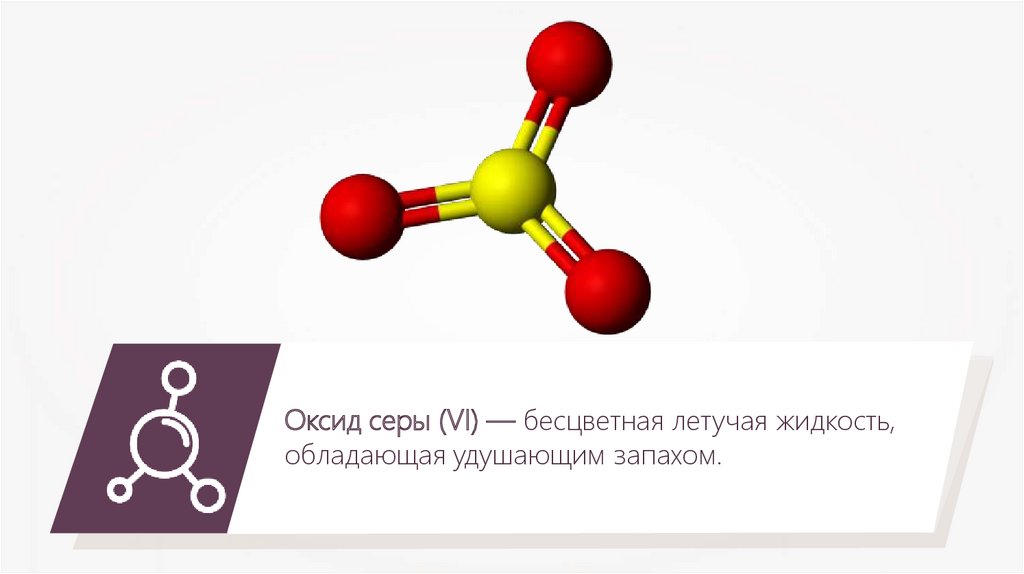
Оксид серы (VI) — бесцветная летучая жидкость,обладающая удушающим запахом.
11.
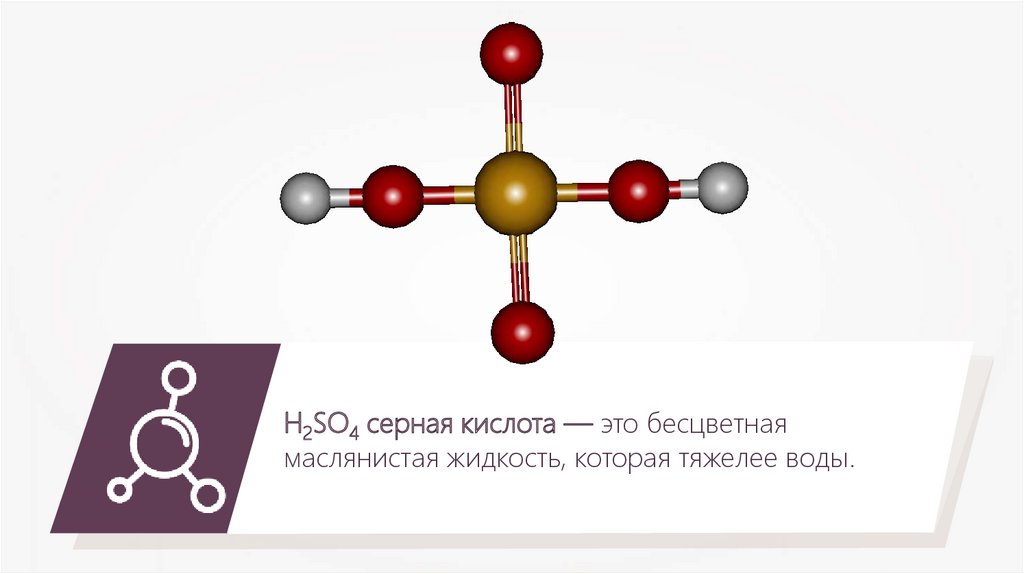
H2SO4 серная кислота — это бесцветнаямаслянистая жидкость, которая тяжелее воды.
12.
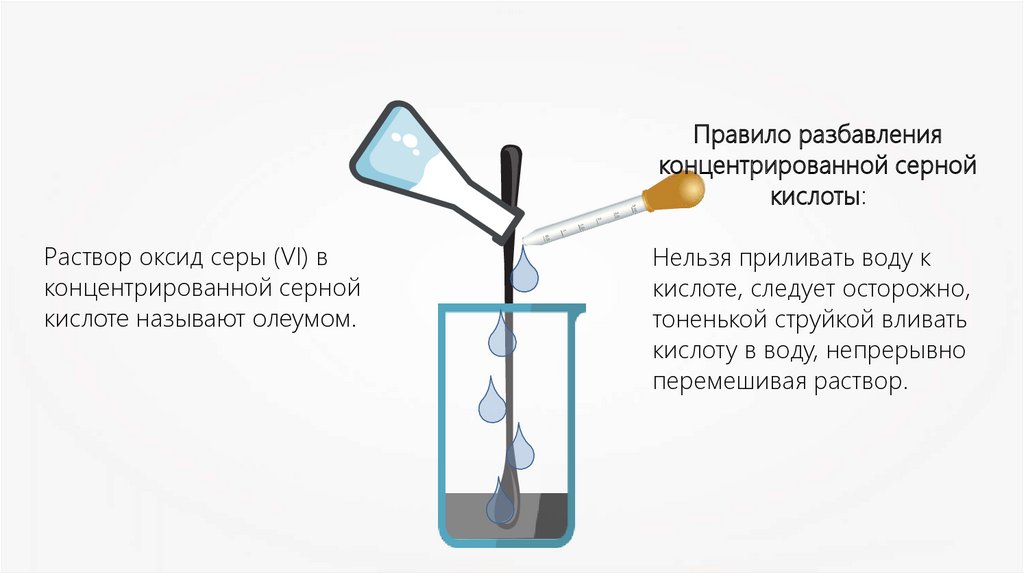
Правило разбавленияконцентрированной серной
кислоты:
Раствор оксид серы (VI) в
концентрированной серной
кислоте называют олеумом.
Нельзя приливать воду к
кислоте, следует осторожно,
тоненькой струйкой вливать
кислоту в воду, непрерывно
перемешивая раствор.
13.
Химические свойства разбавленной серной кислотыВзаимодействует с металлами, стоящими в ряду активности
металлов до водорода:
3H2SO4 + 2Al = Al2(SO4)3 + 3H2↑
Взаимодействует с основными и амфотерными оксидами
металов:
H2SO4 + CaO = CaSO4 + H2O
3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O
14.
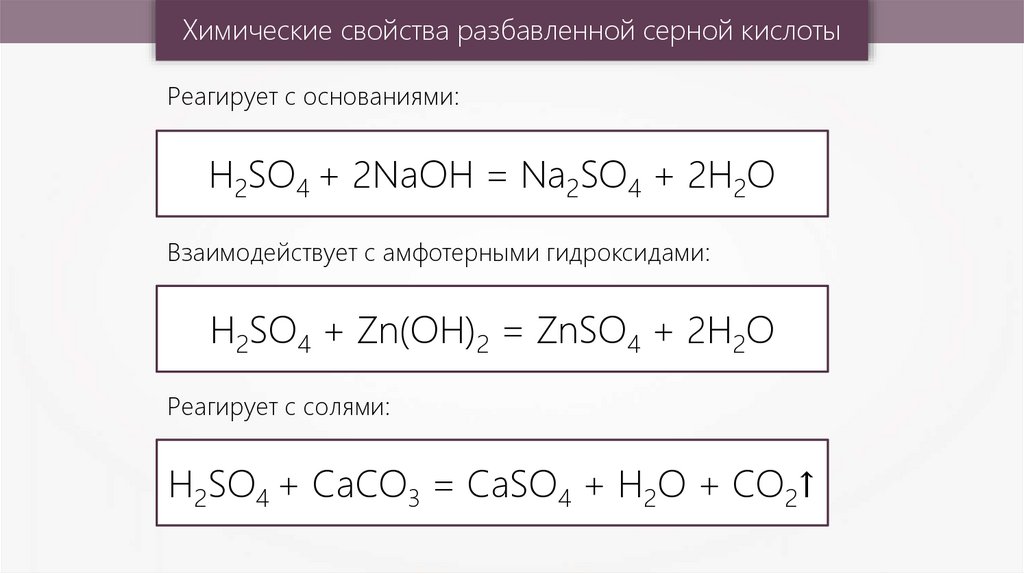
Химические свойства разбавленной серной кислотыРеагирует с основаниями:
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Взаимодействует с амфотерными гидроксидами:
H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O
Реагирует с солями:
H2SO4 + CaCO3 = CaSO4 + H2O + CO2↑
15.
Серная кислота является двухосновной кислотой,поэтому ей соответствуют два типа солей:
Средние — сульфаты:
K2SO4, CaSO4
Кислые — гидросульфаты:
KHSO4, Ca(HSO4)2
16.
Для качественного обнаружения серной кислоты и её солей чаще всегоиспользуют BaCl2. В результате серная кислота или её соли с хлоридом
бария образуют белый нерастворимый сульфат бария, выпадающий в
осадок BaSO4:
2+
2-
Ba + SO4 = BaSO4↓
17.
Химические свойства концентрированной серной кислотыСпособна взаимодействовать с металлами, стоящими в ряду
активности металлов после водорода:
2H2SO4 + Cu = CuSO4 + 2H2O + SO2↑
В реакциях между концентрированной серной кислотой и
металлами, стоящими в ряду активности металлов до водорода,
могут образовываться S, SO2 или H2S:
5H2SO4 + 4Zn = 4ZnSO4 + H2S↑ + 4H2O
18.
В реакциях между концентрированнойсерной кислотой и металлами в результате
не образуется Н2, что связано с тем,
что в данном случае в роли окислителя
2выступают SO4, а не H+.
Некоторые металлы, например, железо
и алюминий пассивируются
концентрированной серной кислотой.
19.
Серная кислота также способнавытеснять другие кислоты из их солей
H2SO4 + NaCl = NaHSO4 + HCl↑
20.
Применение серной кислоты:– производство минеральных удобрений,
соляной, уксусной и многих других кислот,
моющих средств, взрывчатых веществ,
лекарств, красителей;
– используют в металлургии, как
электролит в кислотных аккумуляторах,
для очистки нефтепродуктов и т.д.
H2SO4
21.
Применение солей серной кислоты:– используют в качестве минеральных
удобрений;
– в строительстве;
– для борьбы с вредителями растений;
– в производстве соды и стекла;
– в медицине.
H2SO4
22.
Получение серной кислоты на производстве1. Получение SO2:
S + O2 = SO2
2H2S + 3O2 = 2SO2 + 2H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2. Получение SO3:
2SO2 + O2 = 2SO3
3. Получение H2SO4:
SO3 + H2O → H2SO4
23.
Выбросы и отходы сернокислотных заводов приводят к гибели растений, негативно влияютна дыхательную систему человека и животных, ускоряют коррозию металлов, разрушают
сооружения из известняка и мрамора, приводят к закислению почв и т.д.














 Химия
Химия








