Похожие презентации:
Сероводород и оксид серы
1. Сероводород.
Лавандой, ландышем, фиалкойИли простой еловой палкой
Пусть будет пахнуть – нам не жалко.
Но никогда не будет моды
На запах сероводорода!
«… Тогда услышал я (о, диво!) запах скверный,
Как будто тухлое разбилося яйцо»...
А. С. Пушкин
2.
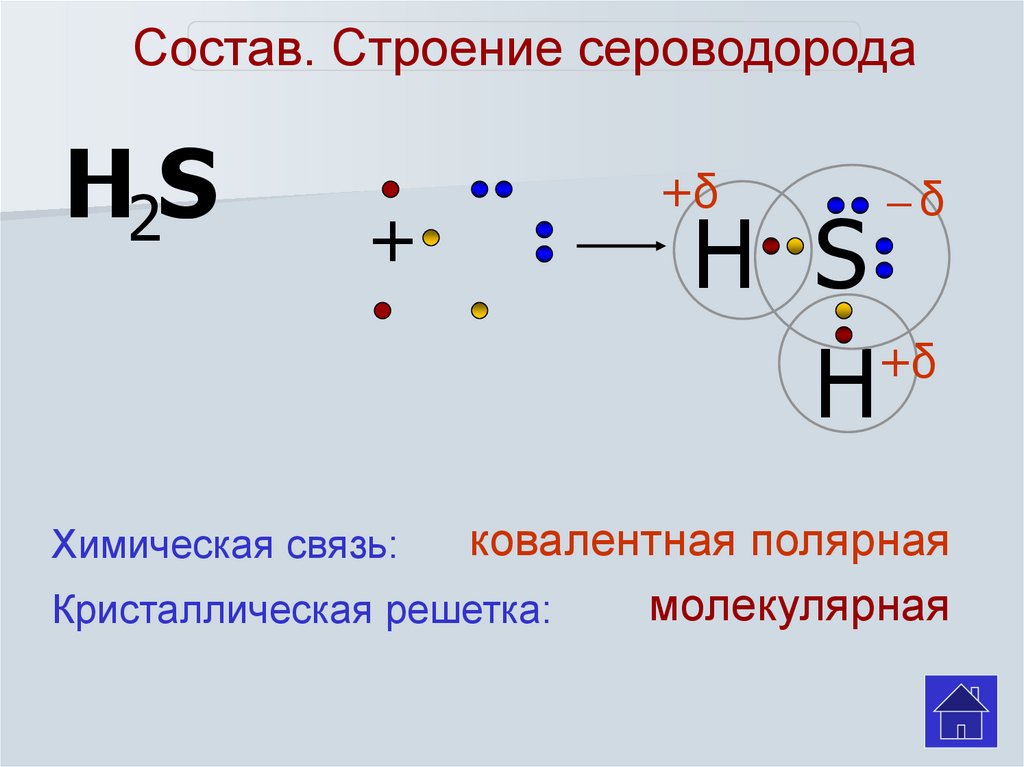
Состав. Строение сероводородаH2S
+
+δ
─δ
H S
+δ
H
ковалентная полярная
молекулярная
Кристаллическая решетка:
Химическая связь:
3. Нахождение в природе
Сероводород входит в состав вулканических газов, атакже содержится в воде некоторых минеральных
источников. Сероводород образуется при гниении
серосодержащих остатков растительного и животного
происхождения.
4. Получение сероводорода
В промышленности сероводород получают как побочныйпродукт при очистке нефти, природного и коксового газов.
В лаборатории его получают взаимодействием соляной
или разбавленной серной кислот с сульфидами цинка или
железа.
Составьте уравнение реакции взаимодействия сульфида
цинка и соляной кислоты:
ZnS + 2HCl = ZnCl2 + H2S
ZnS + 2H+ + 2Cl¯ = Zn2+ + 2Cl¯ + H2S
ZnS + 2H+ = Zn2+ + H2S
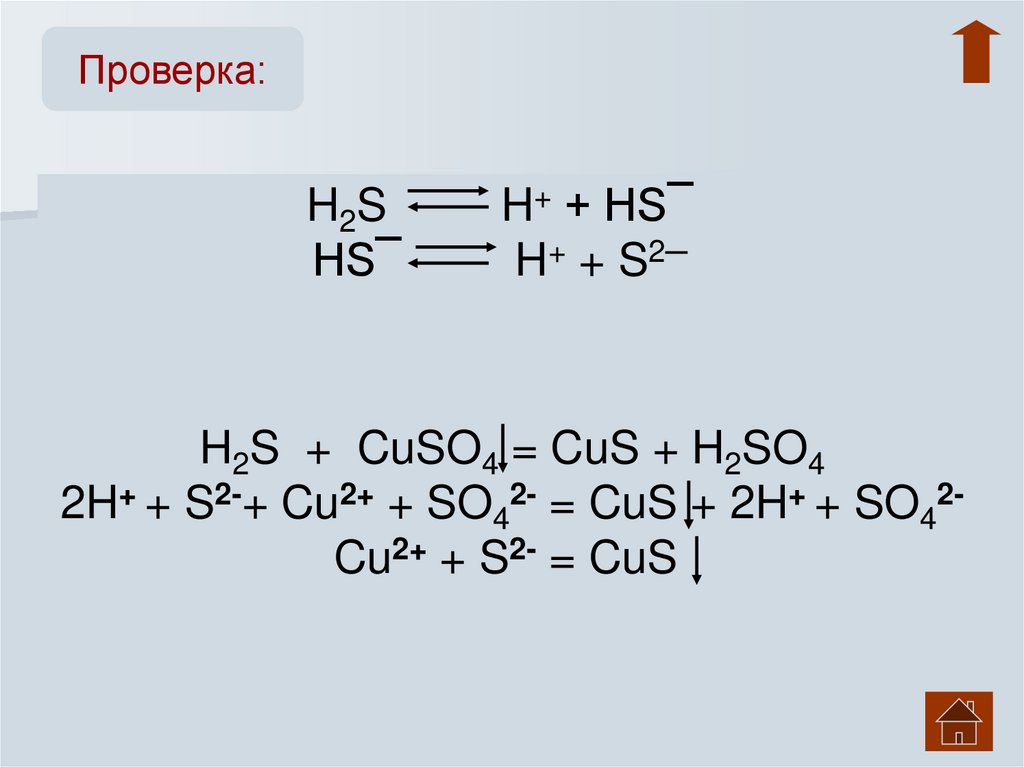
5.
Проверка:H 2S
HS¯
H+ + HS¯
H+ + S2─
H2S + CuSO4 = CuS + H2SO4
2H+ + S2-+ Cu2+ + SO42- = CuS + 2H+ + SO42Cu2+ + S2- = CuS
6.
Химические свойстваКакую степень окисления проявляет сера в сероводороде?
-2
Какие свойства характерны для соединений, в которых элемент
проявляет низшую степень окисления?
Сероводород – это сильный восстановитель.
Составьте уравнение реакции сгорания сероводорода в кислороде:
2H2S + 3O2 = 2SO2 + 2H2O (избыток кислорода)
2H2S + O2 = 2S + 2H2O
(недостаток кислорода)
опыт
Сероводород легко окисляется галогенами
, оксидом серы (IV),
хлоридом железа (III):
На воздухе сероводород окисляет
серебро, что и объясняет почернение
2H2S + SO2 = 2H2O + 3S
серебряных изделий, которое
H2S + 2FeCl3 + S + 2HCl
наблюдается со временем.
2H2S + 4Ag + O2 = 2Ag2S + 2H2O
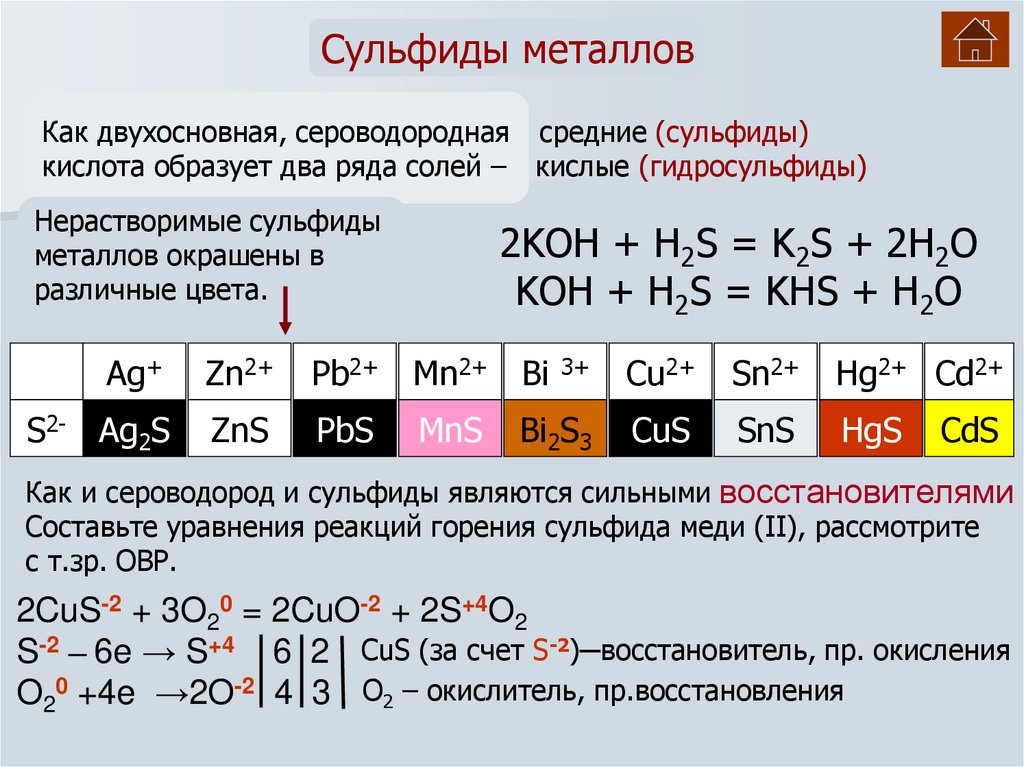
7.
Сульфиды металловКак двухосновная, сероводородная средние (сульфиды)
кислота образует два ряда солей – кислые (гидросульфиды)
Нерастворимые сульфиды
металлов окрашены в
различные цвета.
2KOH + H2S = K2S + 2H2O
KOH + H2S = KHS + H2O
Ag+
Zn2+
Pb2+
Mn2+ Bi
3+
Cu2+
Sn2+
Hg2+ Cd2+
S2- Ag2S
ZnS
PbS
MnS
Bi2S3
CuS
SnS
HgS
CdS
Как и сероводород и сульфиды являются сильными восстановителями
Составьте уравнения реакций горения сульфида меди (II), рассмотрите
с т.зр. ОВР.
2CuS-2 + 3O20 = 2CuO-2 + 2S+4O2
S-2 ─ 6e → S+4 6 2 CuS (за счет S-2)─восстановитель, пр. окисления
O20 +4e →2O-2 4 3 О2 – окислитель, пр.восстановления
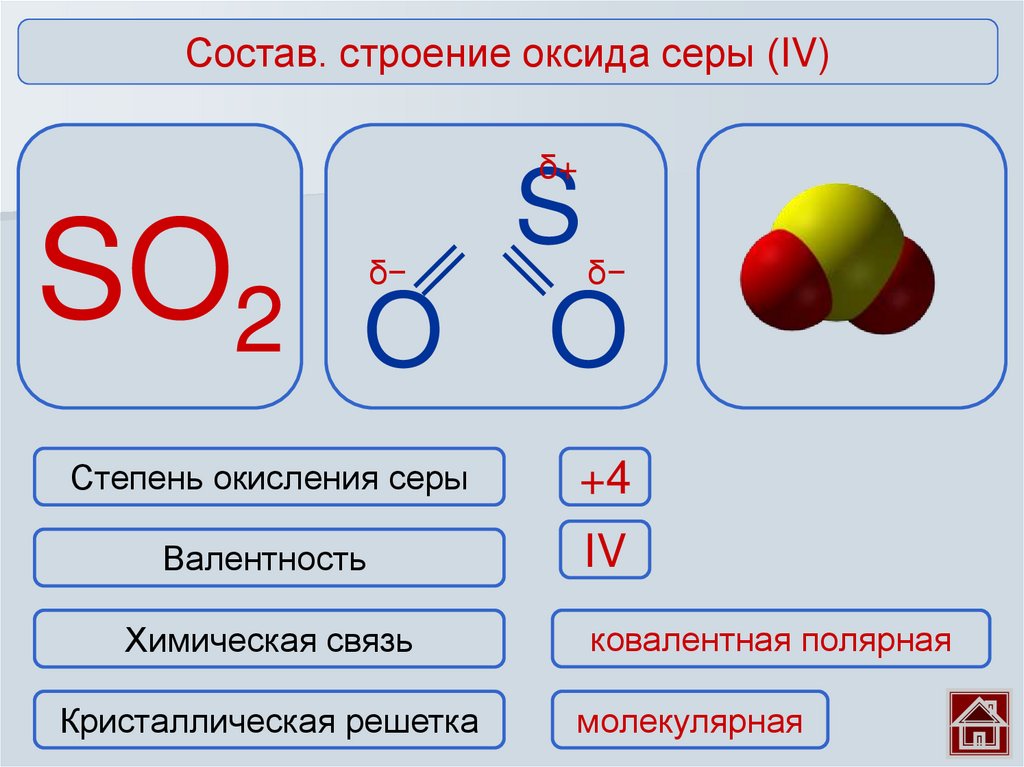
8.
Состав. строение оксида серы (IV)δ+
S
SO2 O O
δ−
δ−
Степень окисления серы
+4
Валентность
IV
Химическая связь
Кристаллическая решетка
ковалентная полярная
молекулярная
9.
Физические свойстваОксид серы (IV) – сернистый газ.
Это бесцветный газ с резким запахом,
вызывающим приступы удушья; t плавления = −75°С,
t кипения=−10°С; в 100 г воды при н.у. растворяется
7,89 л сернистого газа. Водный раствор SO2 –
сернистая кислота
10.
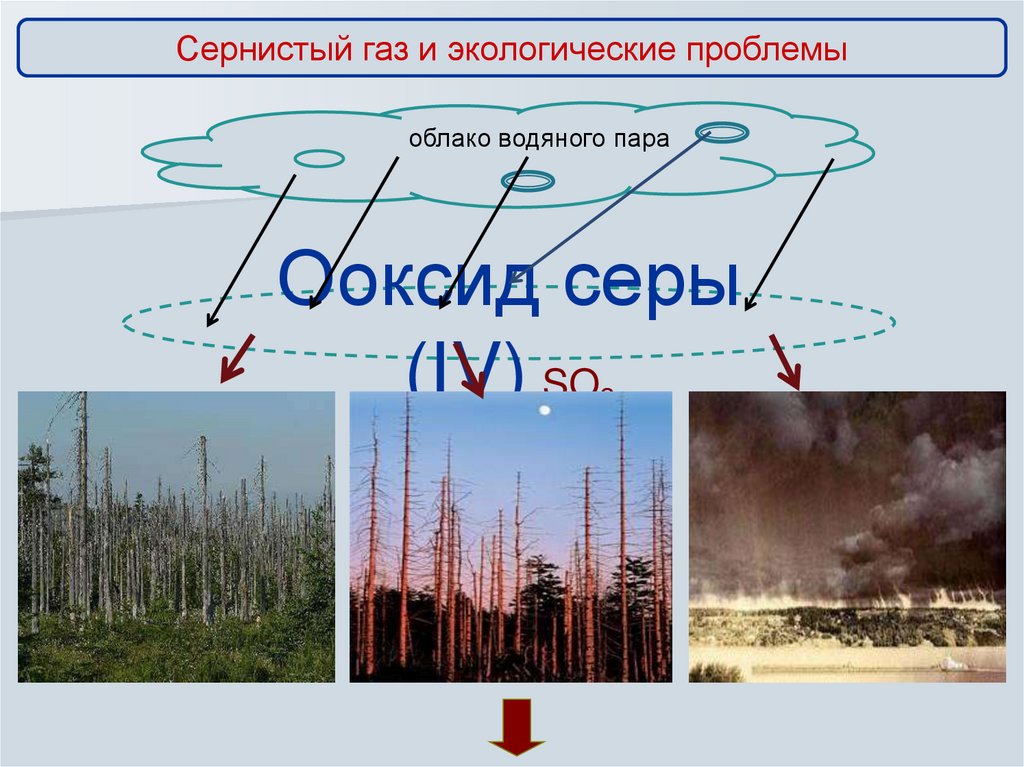
Сернистый газ и экологические проблемыоблако водяного пара
Ооксид серы
(IV) SO
2
11.
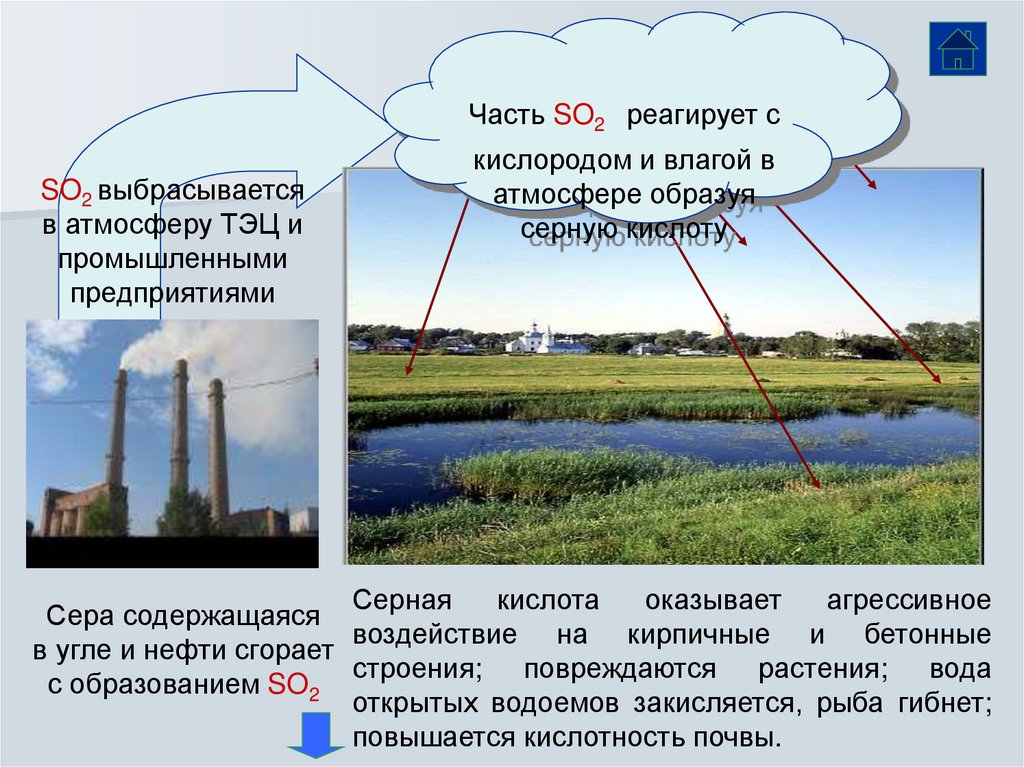
Часть SO2 реагирует сSO2 выбрасывается
в атмосферу ТЭЦ и
промышленными
предприятиями
кислородом и влагой в
атмосфере образуя
серную кислоту
Серная
кислота
оказывает
агрессивное
Сера содержащаяся
воздействие на кирпичные и бетонные
в угле и нефти сгорает
строения; повреждаются растения; вода
с образованием SO2
открытых водоемов закисляется, рыба гибнет;
повышается кислотность почвы.
12.
Экология нас учит: если кислый дождь из тучи, то природнаясреда вся в опасности тогда.
13.
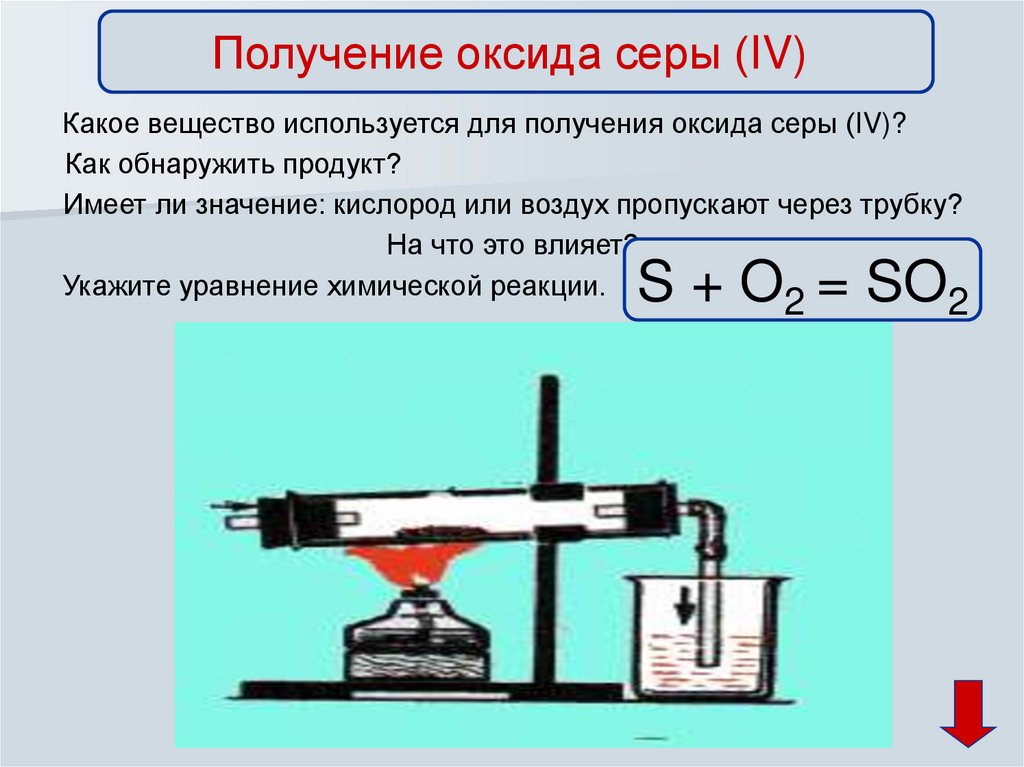
Получение оксида серы (IV)Какое вещество используется для получения оксида серы (IV)?
Как обнаружить продукт?
Имеет ли значение: кислород или воздух пропускают через трубку?
На что это влияет?
Укажите уравнение химической реакции.
S + O2 = SO2
14.
Оксид серы (IV) или сернистый газ получают при горениисероводорода, а также при обжиге сульфидов.
Составьте уравнения реакций данных способов получения
сернистого газа.
2H2S + 3O2 = 2SO2 + 2H2O
2CuS + 3O2 = 2SO2 + 2H2O
15.
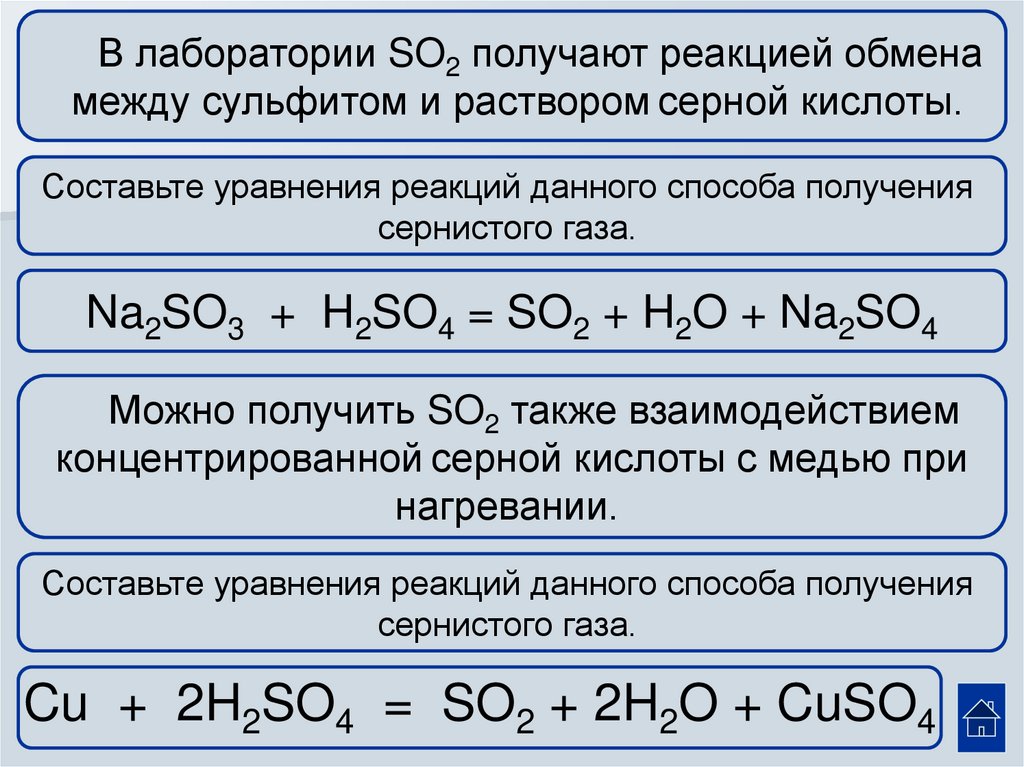
В лаборатории SO2 получают реакцией обменамежду сульфитом и раствором серной кислоты.
Составьте уравнения реакций данного способа получения
сернистого газа.
Na2SO3 + H2SO4 = SO2 + H2O + Na2SO4
Можно получить SO2 также взаимодействием
концентрированной серной кислоты с медью при
нагревании.
Составьте уравнения реакций данного способа получения
сернистого газа.
Cu + 2H2SO4 = SO2 + 2H2O + CuSO4
16.
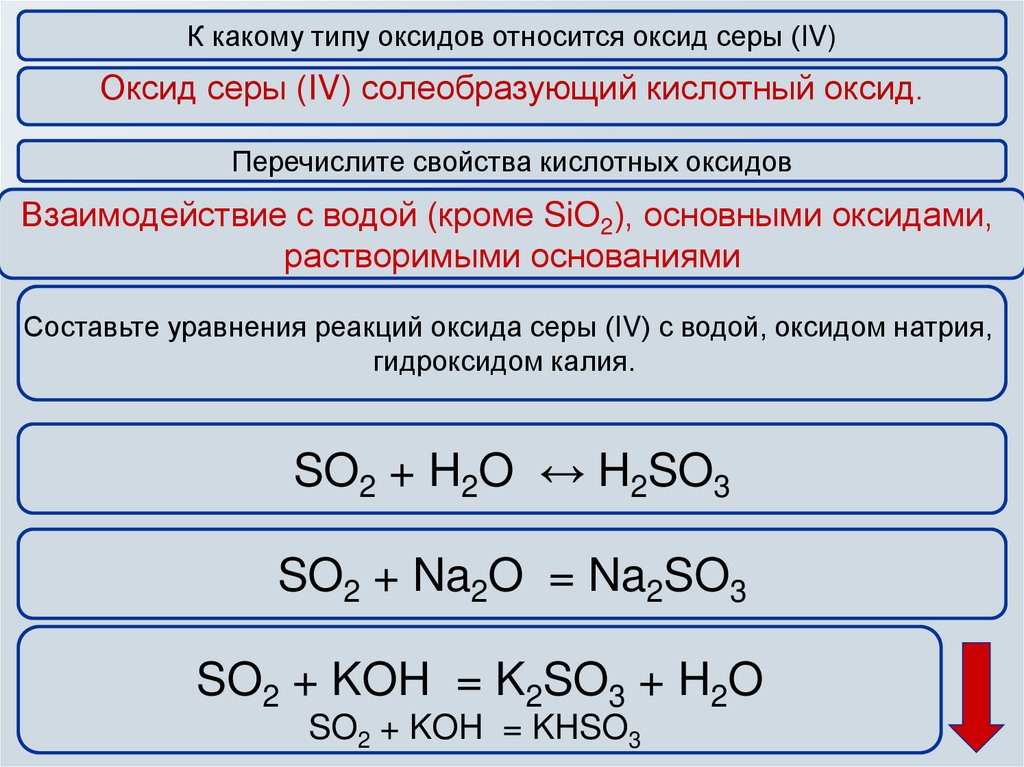
К какому типу оксидов относится оксид серы (IV)Оксид серы (IV) солеобразующий кислотный оксид.
Перечислите свойства кислотных оксидов
Взаимодействие с водой (кроме SiO2), основными оксидами,
растворимыми основаниями
Составьте уравнения реакций оксида серы (IV) с водой, оксидом натрия,
гидроксидом калия.
SO2 + H2O ↔ H2SO3
SO2 + Na2O = Na2SO3
SO2 + KOH = K2SO3 + H2O
SO2 + KOH = KHSO3
17.
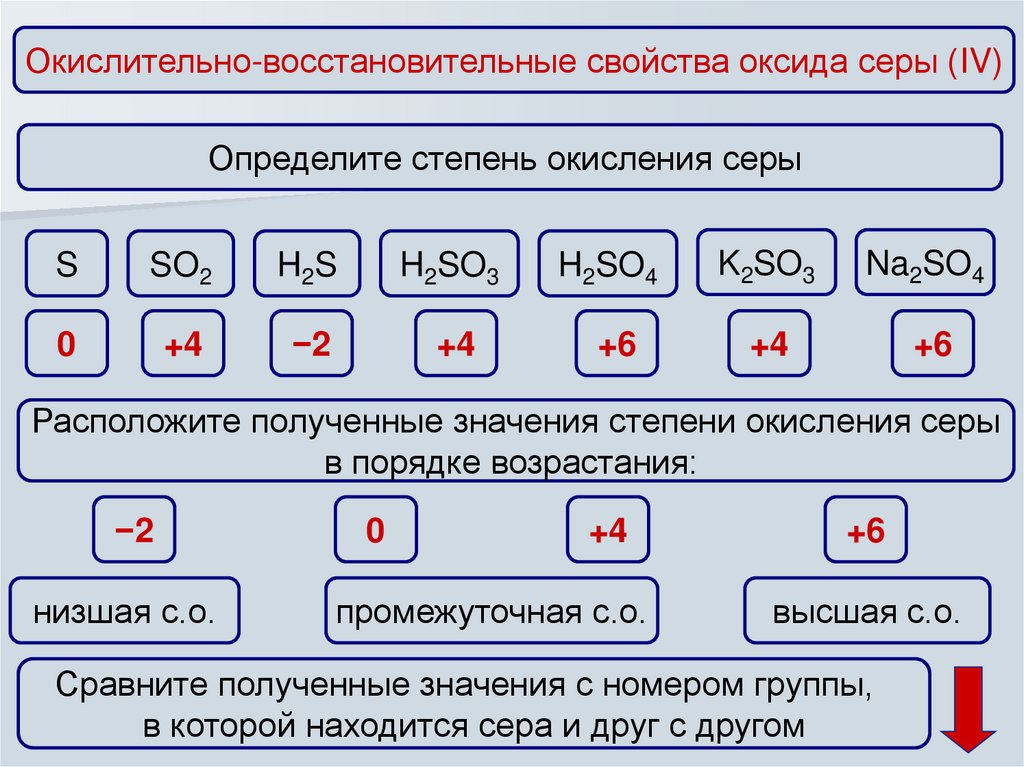
Окислительно-восстановительные свойства оксида серы (IV)Определите степень окисления серы
S
SO2
H2S
H2SO3
H2SO4
K2SO3
Na2SO4
0
+4
−2
+4
+6
+4
+6
Расположите полученные значения степени окисления серы
в порядке возрастания:
−2
низшая с.о.
0
+4
промежуточная с.о.
+6
высшая с.о.
Сравните полученные значения с номером группы,
в которой находится сера и друг с другом
18.
Только восстановительные свойства проявляют элементы,находящиеся в низшей степени окисления
Только окислительные свойства проявляют элементы,
находящиеся в высшей степени окисления
Элементы, находящиеся в промежуточной степени
окисления, могут проявлять как окислительные, так и
восстановительные свойства, т.к способны как к отдаче
электронов, так и к приему электронов
19.
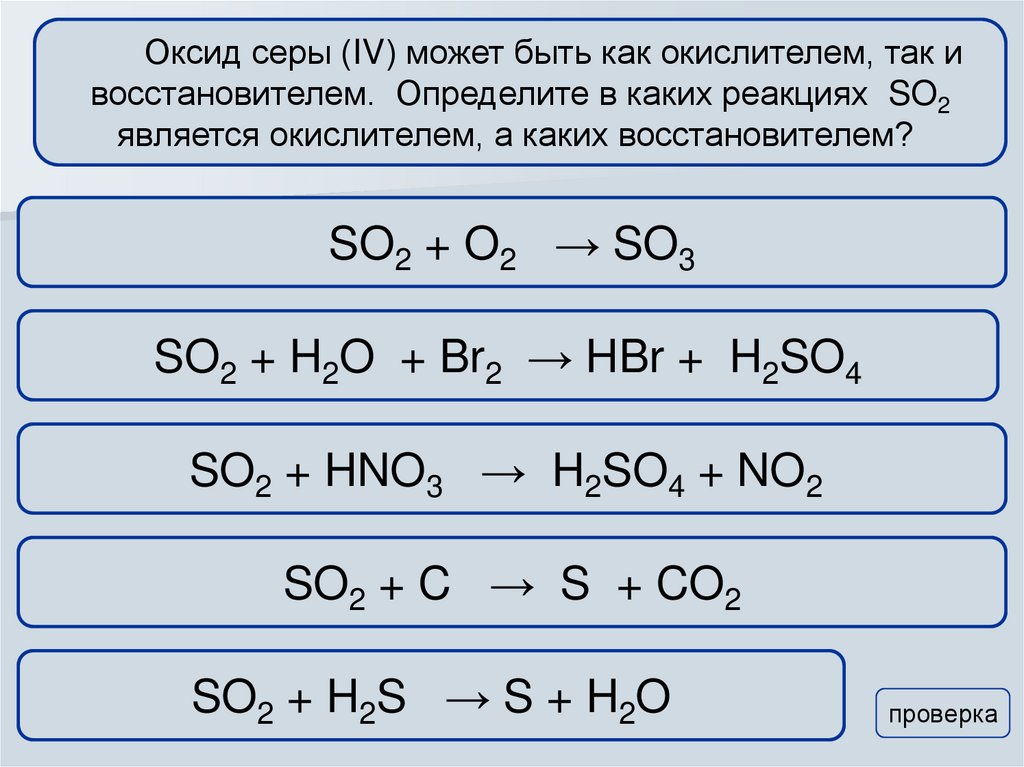
Оксид серы (IV) может быть как окислителем, так ивосстановителем. Определите в каких реакциях SO2
является окислителем, а каких восстановителем?
SO2 + O2 → SO3
SO2 + H2O + Br2 → HBr + H2SO4
SO2 + HNO3 → H2SO4 + NO2
SO2 + C → S + CO2
SO2 + H2S → S + H2O
проверка








 Химия
Химия








