Похожие презентации:
Коллигативные свойства растворов. Осмос. Осмотическое давление
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра химии
Коллигативные свойства
растворов. Осмос. Осмотическое
давление
1. Закон Рауля, следствия из закона Рауля.
2. Осмос, осмотическое давление.
3. Биологическое значение осмоса.
Лектор: Ирина Петровна Степанова, доктор
биологических наук, профессор, зав. кафедрой химии
2.
Коллигативные свойства растворовКоллигативными
(коллективными)
свойствами растворов называют такие
свойства, которые не зависят от природы
растворенного вещества и растворителя,
а определяются, главным образом,
общим числом частиц в растворе.
3.
Коллигативные свойства растворовК коллигативным свойствам относятся:
• понижение давления насыщенного пара
над раствором по сравнению с чистым
растворителем;
• повышение температуры кипения и
понижение
температуры
замерзания
раствора по сравнению с чистым
растворителем;
• осмос и осмотическое давление.
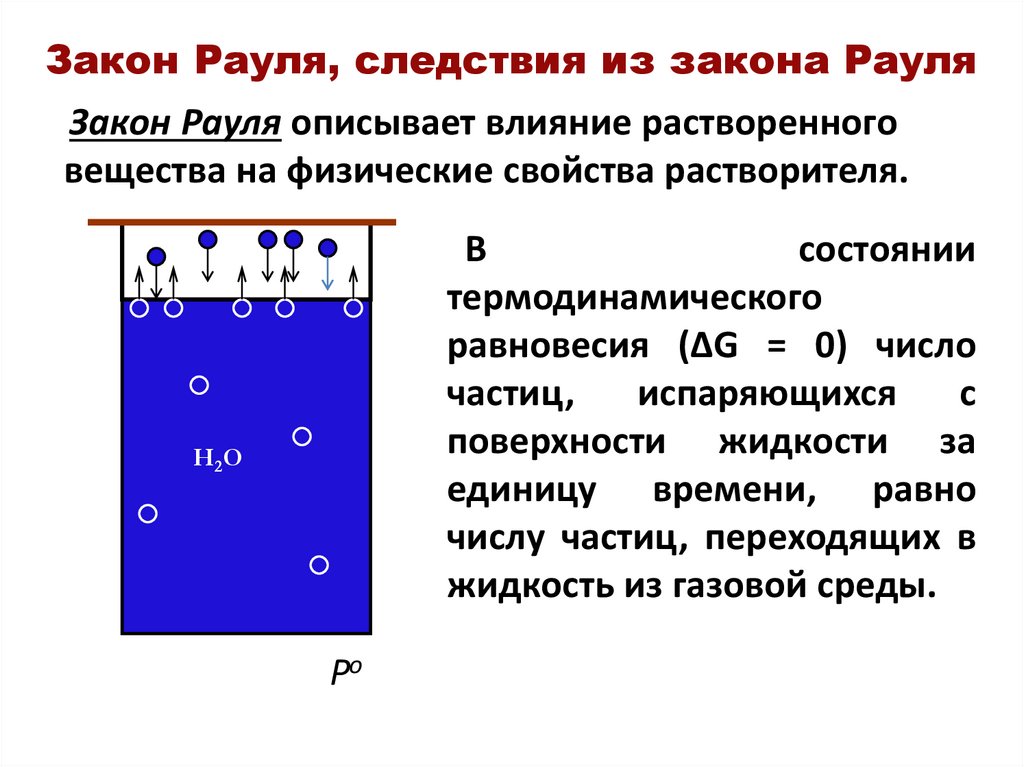
4. Закон Рауля, следствия из закона Рауля
Закон Рауля описывает влияние растворенноговещества на физические свойства растворителя.
В
состоянии
термодинамического
равновесия (∆G = 0) число
частиц,
испаряющихся
с
поверхности жидкости за
единицу времени, равно
числу частиц, переходящих в
жидкость из газовой среды.
Н 2О
Po
5. Закон Рауля, следствия из закона Рауля
Закон Рауля описывает влияние растворенноговещества на физические свойства растворителя.
Пар,
находящийся
в
равновесии с жидкостью,
называют
насыщенным.
Давление такого пара Ро
называют давлением или
упругостью
насыщенного
пара чистого растворителя.
Н 2О
Po
6.
Закон Рауля, следствия из закона РауляПовышение концентрации вещества понижает давление
пара растворителя над раствором.
Н 2О
раствор
Po
>
p
7.
Закон РауляОтносительное понижение давления
насыщенного пара растворителя над
раствором
нелетучего
электролита
равно
мольной
(молярной)
доле
растворенного вещества.
Закон Рауля точно соблюдается только для
идеальных
растворов
и
приближенно
для
разбавленных реальных растворов.
8.
Закон Рауля, следствия из закона РауляМатематическое выражение закона:
Po P
n , где
Po
n N
Po – давление пара над чистым растворителем, Па;
Р – давление пара растворителя над раствором
нелетучего вещества, Па;
Ро - Р – абсолютное понижение давления пара над
раствором;
P o P – относительное понижение давления пара
Po
над раствором;
n – число моль растворенного вещества;
N – число моль растворителя;
n
– мольная доля растворенного вещества.
n N
9.
Закон Рауля, следствия из закона РауляДля растворов электролитов в уравнение Рауля
вводится изотонический коэффициент Вант-Гоффа i.
P P
i n
o
i n N
P
N i , где
i
N0
Ni – число частиц в растворе,
Nо – число частиц, подвергшихся диссоциации.
o
Например, AlCl3
Al+3 + 3Cl-, i = 4/1 = 4
Для растворов неэлектролитов Ni = Nо, тогда i = 1.
Для растворов электролитов Ni > Nо, тогда i >1.
10.
Закон Рауля, следствия из закона РауляВеличина изотонического коэффициента зависит
от степени диссоциации α (в долях от единицы) и
числа дочерних частиц ν:
i 1 ( 1)
Для сильных электролитов α стремится к 1, тогда
i 1 1( 1)
i
Например, NaCl Na+ + Clα → 1, ν = 2, i = 2
11.
Следствия из закона Рауля1.
Повышение
температуры
кипения
разбавленных
растворов
неэлектролитов
по
сравнению с чистым растворителем прямо
пропорционально
моляльной
концентрации
вещества в растворе.
Tкип K, Э b(x)
где
Кэ – эбуллиоскопическая постоянная растворителя,
численно равная повышению температуры кипения
одномоляльного
раствора,
коэффициент
пропорциональности, кг∙К/моль;
b(х) – моляльная концентрация, моль/кг.
12.
Закон Рауля, следствия из закона Рауля2. Понижение температуры замерзания
разбавленных растворов неэлектролитов
по
сравнению с чистым растворителем прямо
пропорционально
моляльной
концентрации
вещества в растворе.
Tзам K З b(x) , где
Кз – криоскопическая постоянная растворителя,
численно равная понижению температуры
замерзания
одномоляльного
раствора,
коэффициент пропорциональности, кг∙К∙моль-1;
b(х) – моляльная концентрация, моль∙кг-1.
13.
Закон Рауля, следствия из закона РауляЭбуллиометрические
и криоскопические
константы
зависят
только
от
природы
растворителя и не зависят от природы
растворенного вещества (идеальные растворы).
Следствия из закона Рауля для растворов
электролитов с поправкой на изотонический
коэффициент имеют вид:
Tкип i K Э b(x)
Tзам i K З b(x)
14.
Закон Рауля, следствия из закона РауляЭбуллиоскопические и криоскопические
константы некоторых веществ
Растворитель
Ткип, 0С
Кэб
Тзам,0С
Ккр
Вода
100
0,52
0,0
1,85
Бензол
80
2,57
5,5
5,1
Уксусн. кислота
118
3,07
16,5
3,9
15.
Закон Рауля, следствия из закона РауляСледствия из закона Рауля применяют в
физико-химических методах исследования.
Эбуллиоскопия (от лат.
ebulio – вскипаю и греч.
σκοπέω
– смотрю) –
физико-химический метод
исследования, основанный
на измерении повышения
температуры
кипения
раствора по сравнению с
температурой
кипения
чистого растворителя.
16.
Закон Рауля, следствия из закона РауляКриоскопия (от греч.
κρύο
– холод и
греч. σκοπέω смотрю) –
физико-химический
метод
исследования,
основанный
на
измерении
разности
между
температурой
замерзания раствора и
чистого растворителя.
17.
Закон Рауля, следствия из закона РауляАвтоматический
криоскопический осмометр
измеряет
тотальную
осмолярность
водных
растворов.
Удобен
для
использования в палатах
интенсивной
терапии
и
реанимационных
отделениях,
позволяя
проводить прямой контроль
инфузионной терапии.
18.
Закон Рауля, следствия из закона РауляЭти методы используются для определения:
• значения криоскопической константы для
веществ с известной молекулярной массой;
• моляльной концентрации растворов;
• молярной массы вещества;
• степени диссоциации разбавленных растворов
электролитов;
• активности растворителя и растворенного
вещества и других величин.
19.
Закон Рауля, следствия из закона РауляМолярные массы (г ∙ моль-1) растворенных веществнеэлектролитов рассчитываются по формулам:
М
М
К эб m рв
Т к m р л ь
К кр m рв
Т з m р л ь
Для растворов электролитов с учетом i:
М
М
iК эб m рв
Т к m р л ь
iК кр m рв
Т з m р л ь
20.
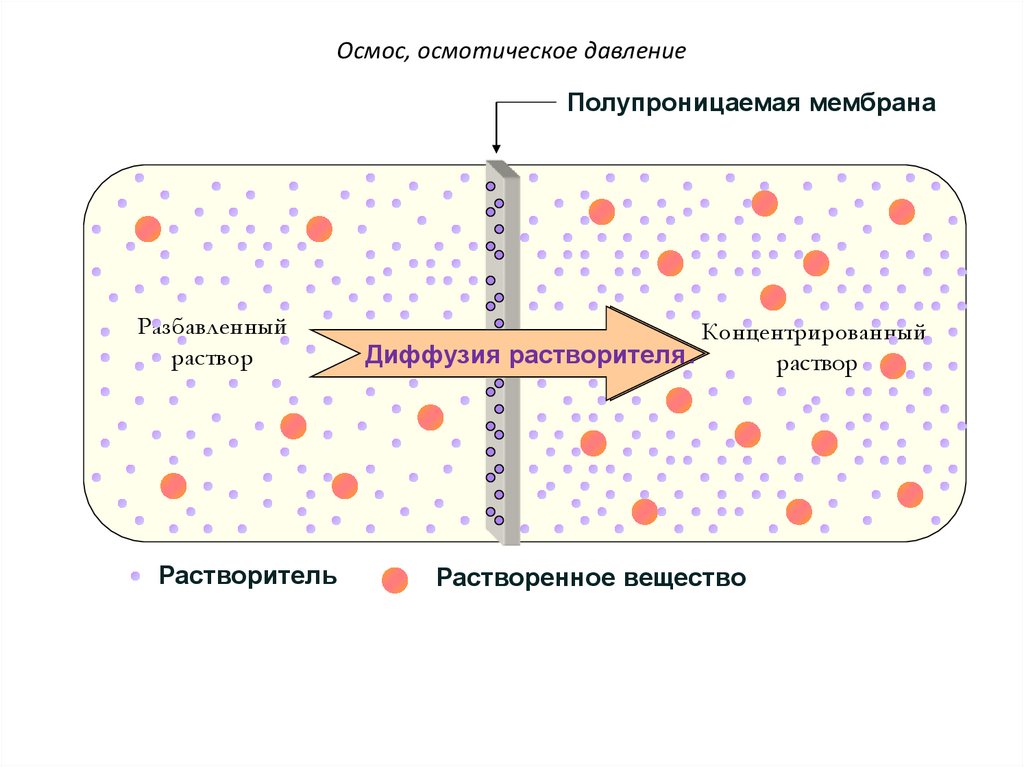
Осмос. Осмотическое давлениерастворов
Осмосом
называют
преимущественно
одностороннюю
диффузию
молекул
растворителя
(например,
воды)
через
полупроницаемую мембрану из раствора с
меньшей концентрацией вещества в более
концентрированный раствор..
21.
Осмос, осмотическое давлениеПолупроницаемая мембрана
Разбавленный
раствор
Растворитель
Концентрированный
Диффузия
Диффузиярастворителя
растворителя
раствор
Растворенное вещество
22.
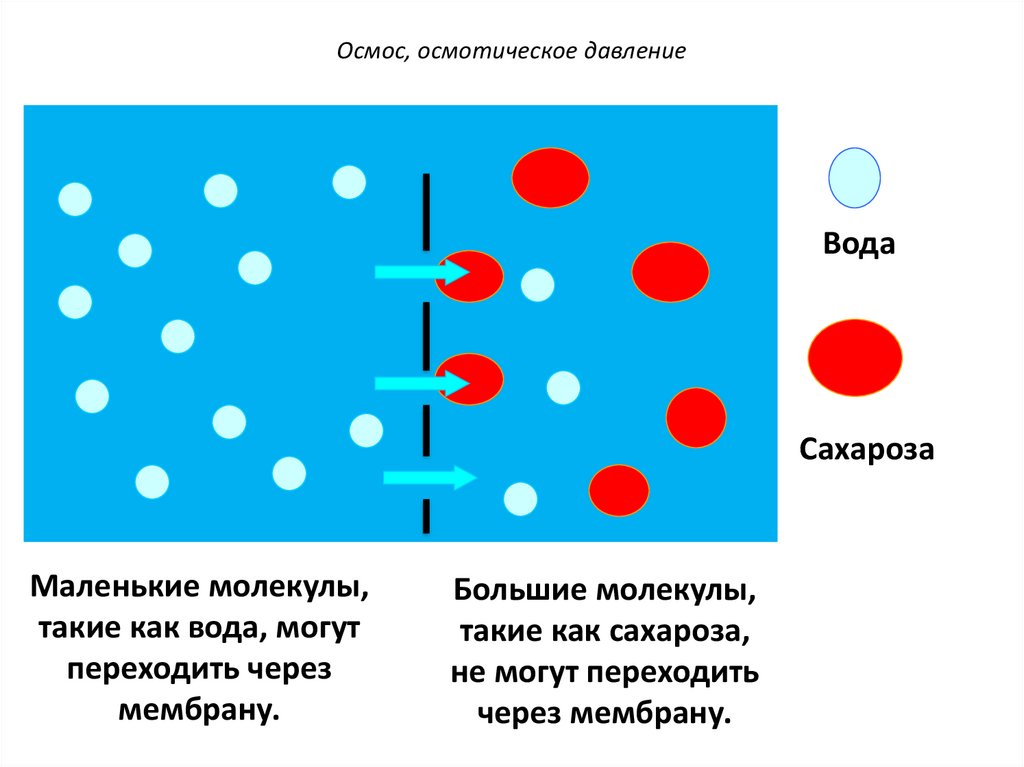
Осмос, осмотическое давлениеПолупроницаемые мембраны – мембраны,
избирательно
пропускающие через свои поры
частицы только определенных размеров, т.е.
мембраны обладают селективностью действия.
мембрана
вода
раствор сахарозы
23.
МембраныЖивотного
происхождения
Растительного
происхождения
Искусственного
происхождения
стенки кишечника,
мочевого пузыря
клетки
растительных
тканей
целлофан,
алюмосиликатные
смолы
24.
Осмос, осмотическое давлениеМембраны животного происхождения свободно
пропускают неорганические ионы и
низкомолекулярные вещества, а задерживают
высокомолекулярные структуры белков, пептидов,
гликогена.
25.
Осмос, осмотическое давлениеВода
Сахароза
Маленькие молекулы,
такие как вода, могут
переходить через
мембрану.
Большие молекулы,
такие как сахароза,
не могут переходить
через мембрану.
26.
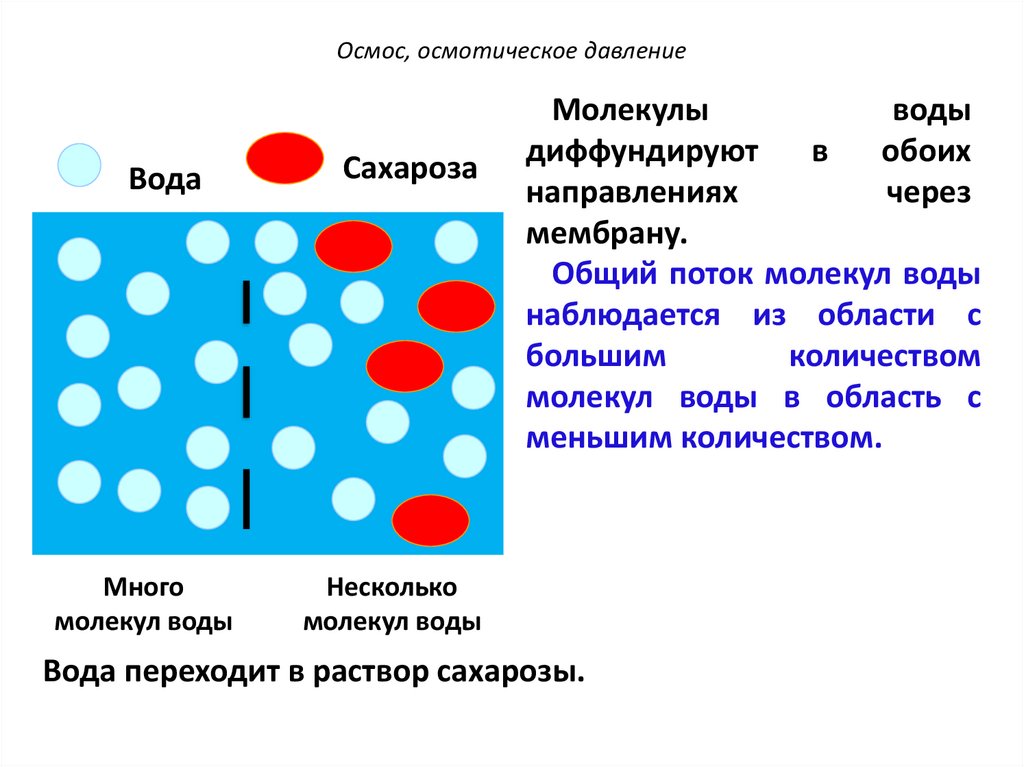
Осмос, осмотическое давлениеВода
Много
молекул воды
Сахароза
Молекулы
воды
диффундируют
в
обоих
направлениях
через
мембрану.
Общий поток молекул воды
наблюдается из области с
большим
количеством
молекул воды в область с
меньшим количеством.
Несколько
молекул воды
Вода переходит в раствор сахарозы.
27.
Осмос, осмотическое давлениеС точки зрения термодинамики движущей силой
осмоса
является
стремление
системы
к
выравниванию
свойств,
в
данном
случае
концентрации, по обе стороны мембраны.
При этом энтропия системы возрастает, энергия
Гиббса уменьшается, химические потенциалы
выравниваются,
поэтому
осмос
–
самопроизвольный процесс.
28.
Осмос, осмотическое давление29.
Осмос, осмотическое давлениеВода или
разбавленный
раствор
Концентрированный
раствор
Уровень
падает
Уровень
повышается
мембрана
Вода переходит из разбавленного ...пока концентрации в-в
раствора в концентрированный… не становятся равными
30.
Осмос, осмотическое давлениеh
Если в сосуд с водой
поместить сосуд меньшего
диаметра, заполненный
водным раствором глюкозы,
дно которого представляет
собой полупроницаемую
мембрану, то в результате
осмоса объем раствора
увеличится и уровень
жидкости повысится на
высоту h.
31.
Осмос, осмотическое давлениеПри
этом
создается
дополнительное
гидростатическое давление столба жидкости
высотой h на мембрану и возрастает вероятность
обратного движения молекул воды.
Осмотическое равновесие характеризуется
одинаковой скоростью диффузии молекул воды в
двух противоположных направлениях через
мембрану и является динамическим.
32.
Осмос, осмотическое давлениеОсмотическим давлением раствора
называют
величину,
измеряемую
минимальным
дополнительным
гидростатическим давлением, которое
нужно приложить к мембране со стороны
раствора, чтобы осмос прекратился (т.е.
наступило осмотическое равновесие).
33.
Осмос, осмотическое давлениеJacobus Henricus van't
Hoff
(1852-1911),
первый Нобелевский
лауреат по химии
(1901)
Осмотическое
давление
рассчитывается
по
уравнению
Вант-Гоффа (1887 г.) Ученый
рассмотрел
поведение
частиц
вещества в растворе аналогично
поведению
молекул
газа,
занимающего
одинаковый
с
раствором объем. Это позволило
ему
использовать
уравнение
Менделеева-Клапейрона:
P V n( x ) RT
34.
Осмос, осмотическое давлениеУравнение осмотического давления (π) Вант-Гоффа:
n( x )
RT
V
m( x )
n( x )
n( x),
C ( x ),
Если учесть, что
M ( x)
V
,
m( x)
то получим:
RT или C ( x) RT
M ( x) V
35.
Осмос, осмотическое давлениеn( x )
m( x)
RT
RT C ( x) RT , где
V
M ( x) V
π – осмотическое давление, Па;
R - универсальная газовая постоянная,
R = 8,314 Дж∙моль-1∙К-1;
Т – абсолютная температура, К;
V – объем, м3;
m(x) – масса вещества, г;
М(х) – молярная масса вещества, г ∙ моль-1 ;
С(х) – концентрация раствора, моль ∙ м-3;
n(x) – количество вещества, моль.
36.
Осмос, осмотическое давлениеДля расчета осмотического давления растворов
электролитов вводят изотонический коэффициент
Вант-Гоффа i:
i C ( x) RT
37.
Осмос, осмотическое давлениеИзотонический
коэффициент
рассчитывается по формуле:
Вант-Гоффа
N i , где
i
N0
Ni – число частиц в растворе,
Nо – число частиц, подвергшихся диссоциации.
Например, Ca(NO3)2
Ca+2 + 2NO3-, i = 3/1 = 3
Для растворов неэлектролитов Ni = Nо, тогда i = 1.
Для растворов электролитов Ni >Nо, тогда i >1.
38.
Закон Рауля, следствия из закона РауляВеличина изотонического коэффициента зависит
от степени диссоциации α (в долях от единицы) и
числа дочерних частиц ν:
i 1 ( 1)
Для сильных электролитов α стремится к 1, тогда:
i 1 1( 1)
i
Например, Al(NO3)3 Al+3 + 3NO3α → 1, ν = 4, i = 4
39.
Осмос, осмотическое давлениеОсмотическое давление в растворе
электролита
зависит
от
силы
электролита, т.е. от степени его
диссоциации,
состава
молекулы,
температуры и концентрации вещества в
растворе.
40.
Осмос, осмотическое давлениеВ растворах высокомолекулярных веществ
осмотическое давление рассчитывают по уравнению
Галлера:
C ВМВ
2
, где
RT bC ВМВ
M ВМВ
СВМВ – весовая концентрация ВМВ, г ∙ м-3;
МВМВ – молярная масса ВМВ, г ∙ моль-1 ;
b – коэффициент, учитывающий особенности
гомологического ряда полимера (формулу, гибкость,
размеры, природу макромолекул).
2
0 , тогда
Если СВМВ невелика, то слагаемое bC ВМС
уравнение Галлера переходит в уравнение ВантГоффа.
41. Биологическая роль осмоса
42.
Биологическое значение осмосаОсмос
играет
огромную
роль
в
жизнедеятельности
организма.
Благодаря
осмосу, регулируется поступление воды в клетку
и межклеточные структуры. Благодаря осмосу,
происходит усвоение питательных веществ и
выведение продуктов жизнедеятельности.
43.
Биологическое значение осмосаОсмос
является
одним
из
мембранного потенциала клетки:
механизмов
м ем брана 1 2 , где
ϕмембрана – мембранный потенциал клетки, мВ;
ϕ1, ϕ2 – потенциалы по обе стороны мембраны
клетки, мВ.
Мембранные
потенциалы
определяются
концентрацией ионов по обе стороны мембраны,
также зависят от природы и свойств мембраны.
44.
Биологическое значение осмосаОсновной
причиной
возникновения
потенциала клетки является неравномерное
распределение ионов калия и натрия между
содержимым клетки и межклеточной жидкостью.
Содержание ионов K+ в клетке в 20-40 раз выше,
чем в межклеточной жидкости. Содержание
ионов Na+, наоборот, в 10-20 раз выше в
межклеточной жидкости, чем в клетке. Поэтому
осмотическое
давление
внутриклеточной
жидкости выше, чем во внеклеточной. Это
обусловливает тургор клеток, т.е. их упругость,
что способствует поддержанию эластичностей
тканей, сохранению органами определенной
формы.
45.
Биологическое значение осмосаОсмотический градиент, определяющий собой
силу, с которой вода всасывается в клетку, численно
равен разности между осмотическим и тургорным
давлениями. Вода, избирательно всасывающаяся
клеткой, создает в ней давление, достигающее
0,4-2,0 мПа (4-20 атм). Осмотическое давление
плазмы крови характеризуется достаточным
постоянством и при 370С имеет высокое значение
0,74-0,78 мПа, т.е. 7,7-8,1 атм. Отклонение от этой
величины является патологией.
46.
РастворыИзотонические
Растворы,
Изотоническими
имеющиекрови
плазме
одинаковое
(πплазма
=740-780 кПа
илиосмотическое
7,4 -7,7 атм)
давление
являются
0,85-0,89%
растворы NaCl, а
также 4,5 – 5,0%
раствор глюкозы.
Гипертонические
Например,
Растворы с
внутривенно
большим 10%
применяют
осмотическим
раствор
CaCl2.
давлением
по
Для
очистки
отношению кран
гнойных
данному
используются
раствору
гипертонические
повязки.
Гипотонические
Используются для
поддержания
Растворы с
тургора
стенок
меньшим
кишечника
осмотическим
(например,
давлением по
раствор
Рингераотношению
к
Локка),
в составе
данному
глазных
раствору
витаминных
капель, а также в
косметологии.
47.
Биологическое значение осмосаДействие слабительных средств - горькой
соли MgS04 • 7Н20 и глауберовой соли Na2S04 • 10Н2О
также основано на явлении осмоса. Эти соли плохо
всасываются через стенки кишечника, поэтому они
создают в нем гипертоническую среду и вызывают
поступление в кишечник большого количества воды
через его стенки, что приводит к послабляющему
действию.
48. Осмос в клетках животного происхождения
1. Если живую клетку поместить визотонический раствор, то клетка сохраняет
свой размер и нормально функционирует.
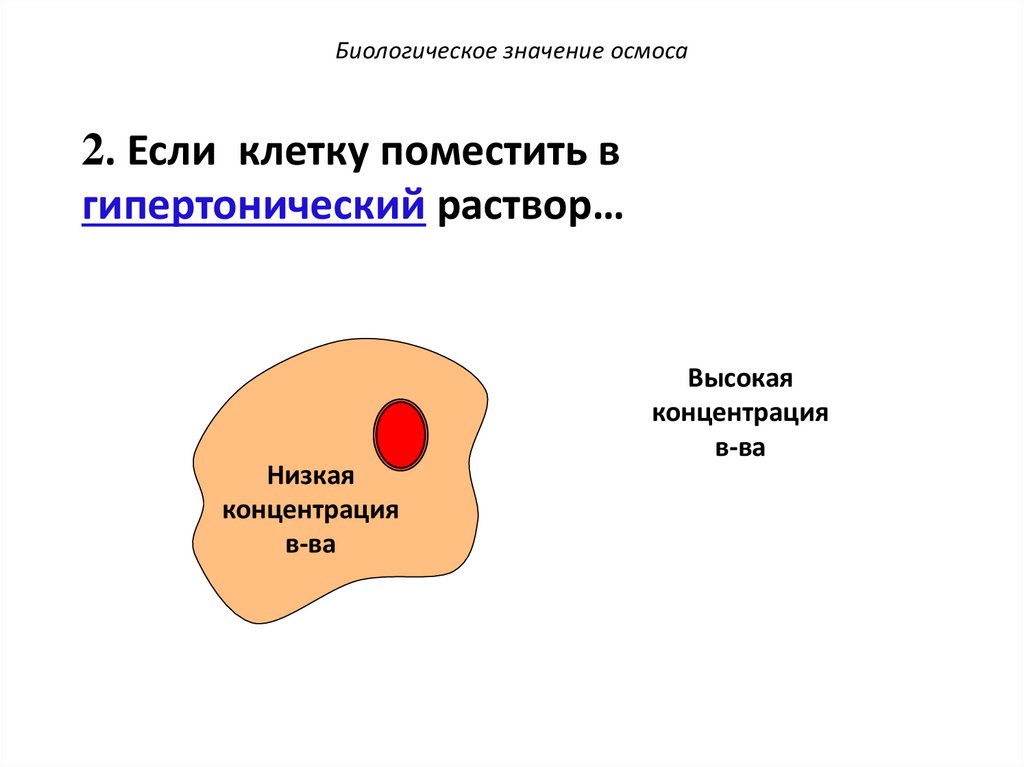
49.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
50.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Низкая
концентрация
в-ва
Высокая
концентрация
в-ва
51.
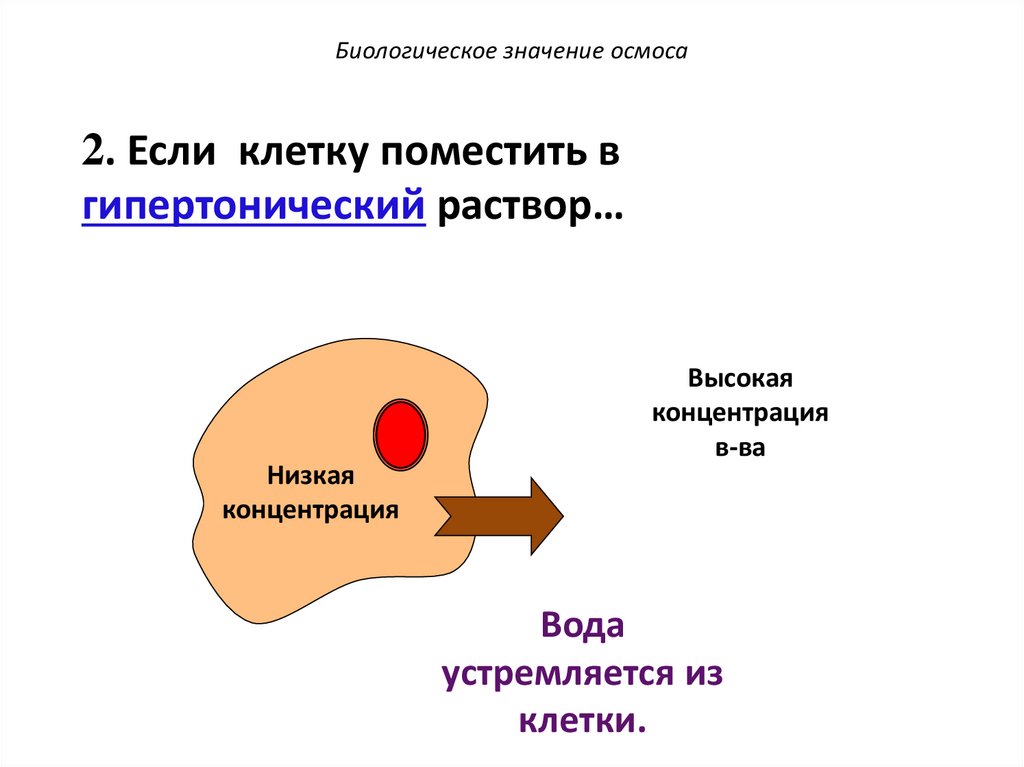
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Низкая
концентрация
Высокая
концентрация
в-ва
Вода
устремляется из
клетки.
52.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Клетка
сморщивается.
Вода
устремляется из
клетки.
53.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Клетка
сморщивается.
Вода
устремляется из
клетки.
54.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Клетка
сморщивается.
Вода
устремляется из
клетки.
55.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Клетка
сморщивается.
Вода
устремляется из
клетки.
56.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Это явление
называется
плазмолизом.
Вода
устремляется из
клетки.
57.
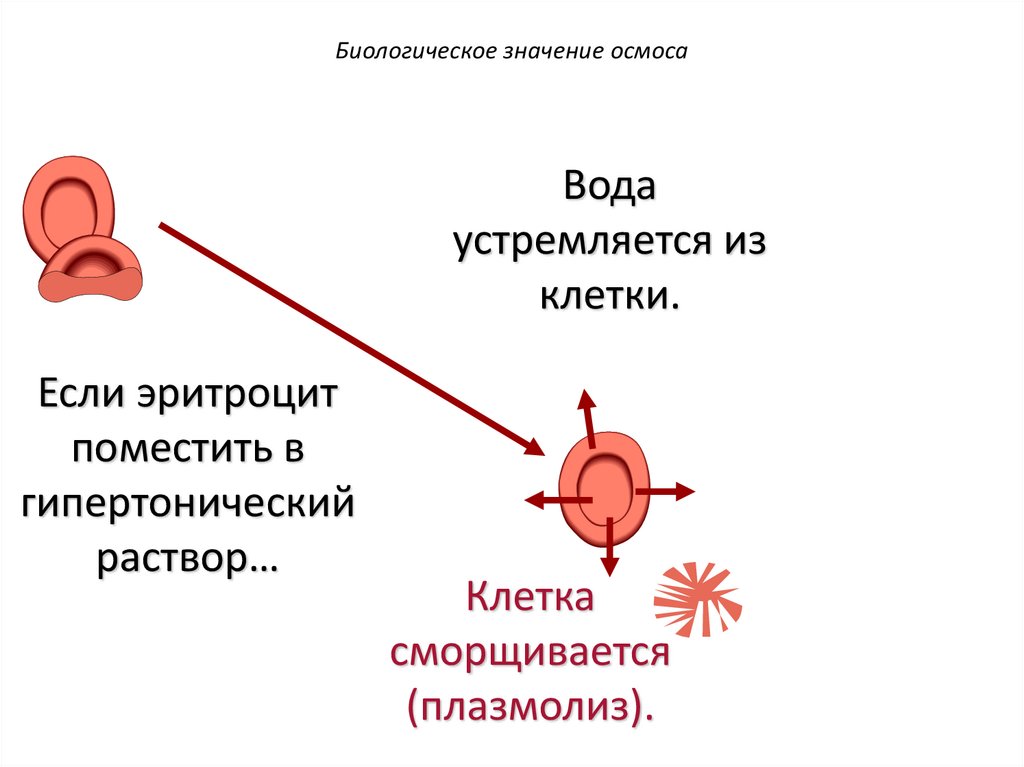
Биологическое значение осмосаЕсли эритроцит
поместить в
гипертонический
раствор…
58.
Биологическое значение осмосаВода
устремляется из
клетки.
Если эритроцит
поместить в
гипертонический
раствор…
Клетка
сморщивается
(плазмолиз).
59.
Биологическое значение осмосаВ некоторых случаях плазмолиз является
обратимым
процессом,
т.е.
возможен
деплазмолиз.
Гипертонические растворы соли (рассол) и
сахара
(сироп)
используют
при
консервировании продуктов, так как в этой
среде
происходит
плазмолиз
микроорганизмов.
60.
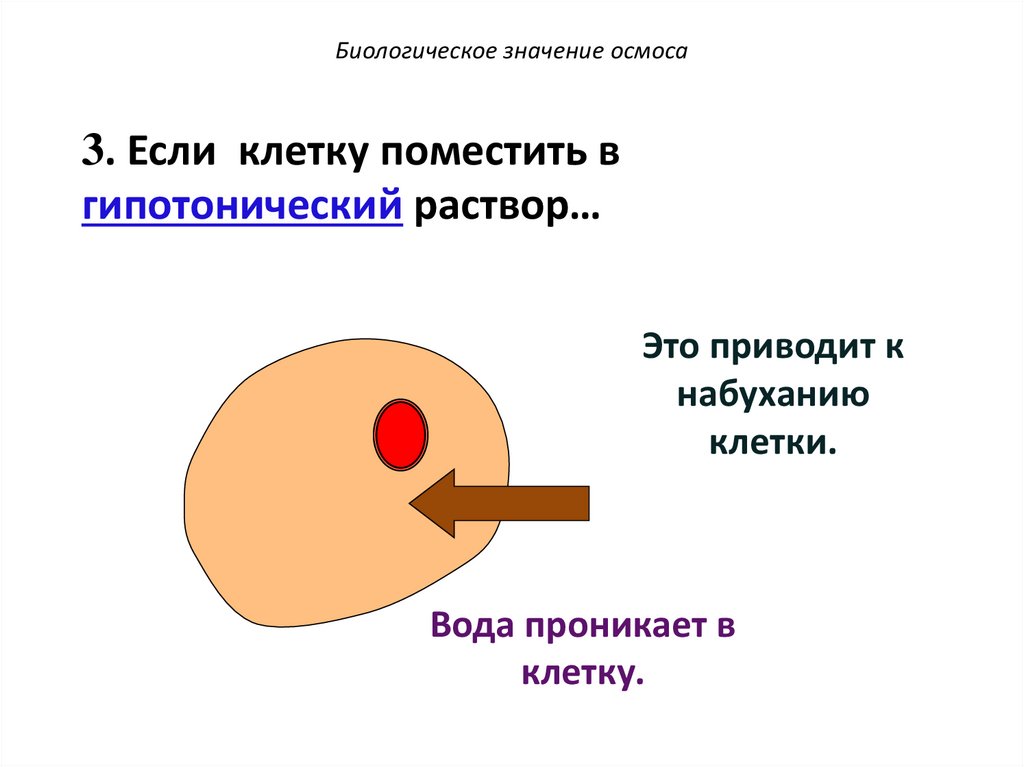
Биологическое значение осмоса3. Если клетку поместить в
гипотонический раствор…
61.
Биологическое значение осмоса3. Если клетку поместить в
гипотонический раствор…
Низкая
концентрация
в-ва
Высокая
концентрация
в-ва
Вода проникает в
клетку.
62.
Биологическое значение осмоса3. Если клетку поместить в
гипотонический раствор…
Это приводит к
набуханию
клетки.
Вода проникает в
клетку.
63.
Биологическое значение осмоса3. Если клетку поместить в
гипотонический раствор…
Это приводит к
набуханию
клетки.
Вода проникает в
клетку.
64.
Биологическое значение осмоса3. Если клетку поместить в
гипотонический раствор…
Это приводит к
набуханию
клетки.
Вода проникает в
клетку.
65.
Биологическое значение осмоса3. Если клетку поместить в
гипотонический раствор…
В конечном итоге
клетка лопается.
Это явление
называют
лизисом.
Вода проникает в
клетку.
66.
Биологическое значение осмосаЕсли эритроцит
поместить в
гипотонический
раствор…
67.
Биологическое значение осмосаЕсли эритроцит
поместить в
гипотонический
раствор…
Оболочка
Вода
клетки
устремляется
в клетку. разрывается
(гемолиз).
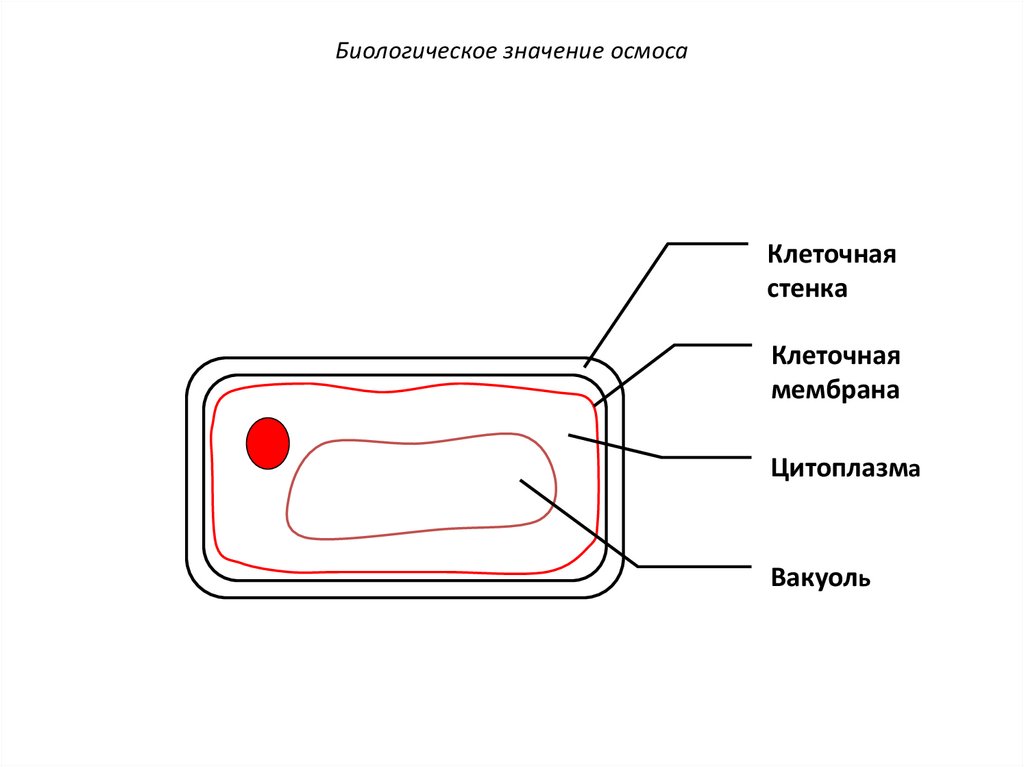
68. Осмос в клетках растительного происхождения
Клеточнаястенка
69.
Биологическое значение осмосаКлеточная
стенка
Клеточная
мембрана
70.
Биологическое значение осмосаКлеточная
стенка
Клеточная
мембрана
Цитоплазма
Вакуоль
71.
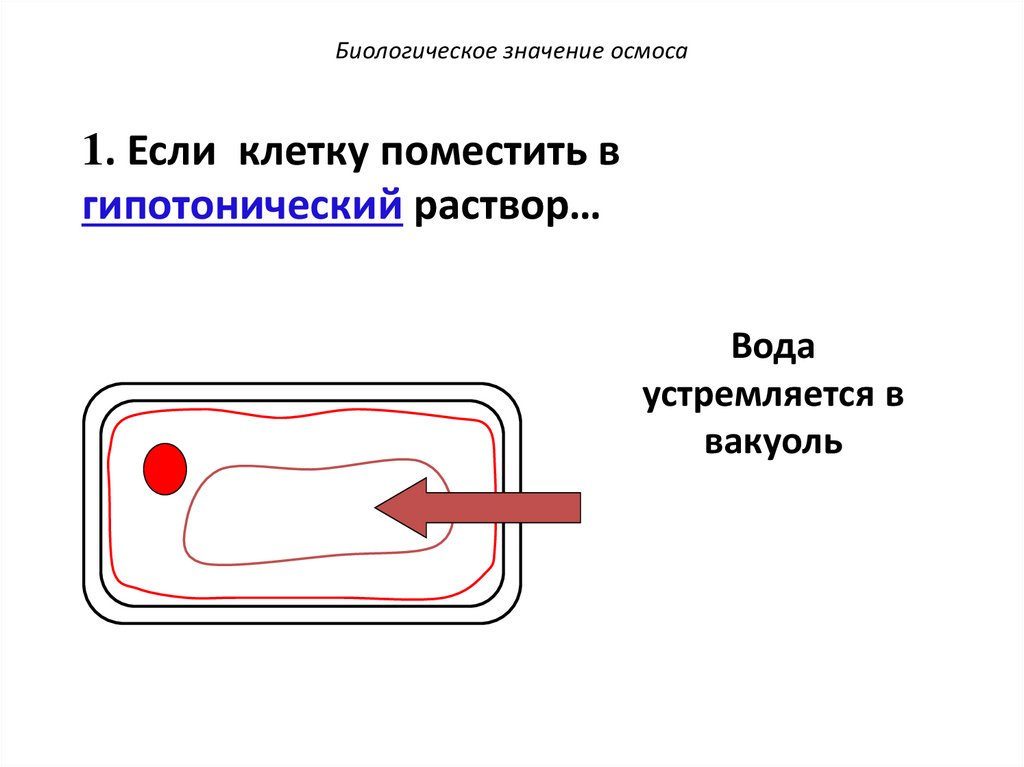
Биологическое значение осмоса1. Если клетку поместить в
гипотонический раствор…
Вода
устремляется в
вакуоль
72.
Биологическое значение осмоса1. Если клетку поместить в
гипотонический раствор…
Вакуоль набухает,
оттесняя
цитоплазму к
клеточной стенке.
73.
Биологическое значение осмоса1. Если клетку поместить в
гипотонический раствор…
Неупругая клеточная
стенка, препятствуя
продвижению
цитоплазмы, вызывает
напряженное состояние
клетки - тургор.
74.
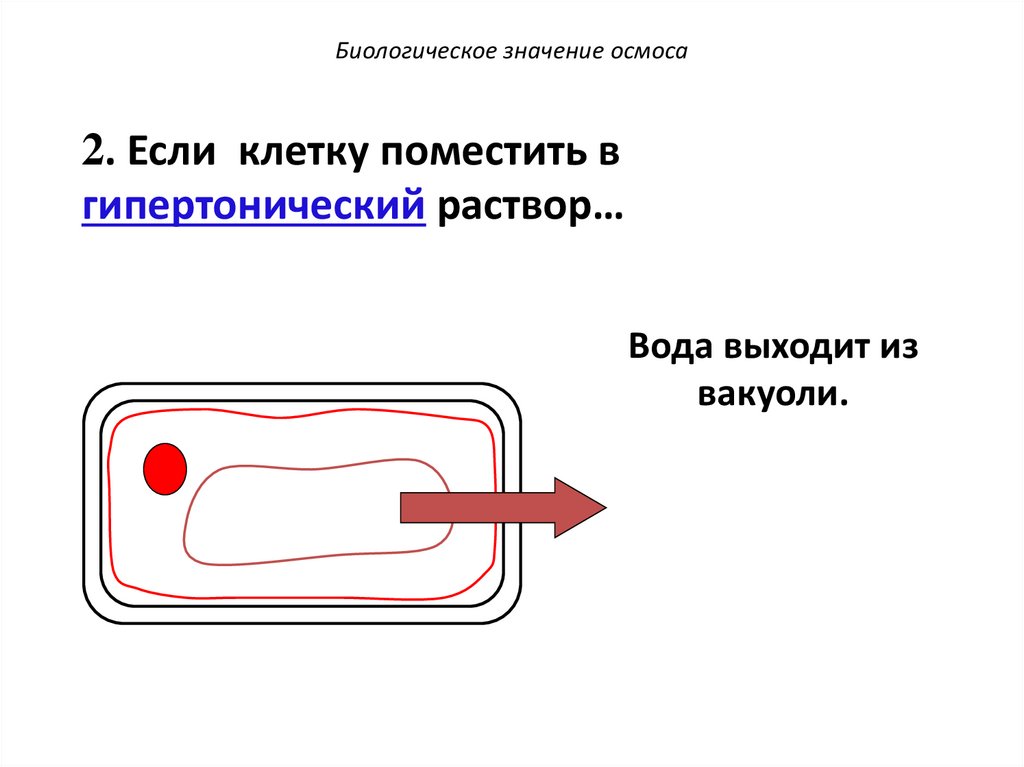
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Вода выходит из
вакуоли.
75.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Вода выходит из
вакуоли.
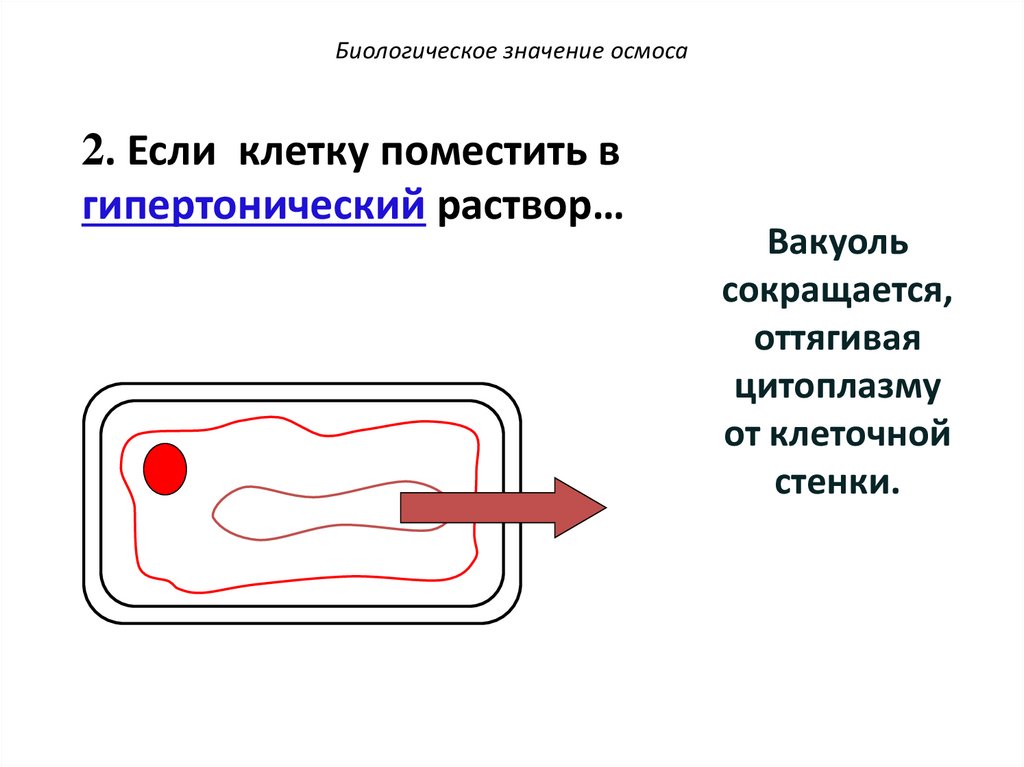
76.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Вакуоль
сокращается,
оттягивая
цитоплазму
от клеточной
стенки.
77.
Биологическое значение осмоса2. Если клетку поместить в
гипертонический раствор…
Клетка находится в
состоянии плазмолиза.
78.
Биологическое значение осмосаклеточная
стенка
вакуоль
Ячейка поглощает воду
путем осмоса…
цитоплазма и клеточная
мембрана
… но клеточная стенка
препятствует расширению.
79.
Биологическое значение осмосаЕсли концентрация клеточного сока больше в одной
клетке, чем в соседней, вода будет проходить путем
осмоса из менее концентрированного в более
концентрированный раствор.
Более концентрированный
раствор
Менее концентрированный
раствор
80.
Биологическое значение осмосаЧасть осмотического давления крови,
обусловленная присутствием в ней
высокомолекулярных веществ (главным
образом,
белков),
называют
онкотическим давлением.
Онкотическое давление составляет примерно 0,5%
от величины осмотического давления крови и равно
2,5-3,9 кПа, тем не менее, оно играет важную
физиологическую роль.
При
снижении концентрации белка в крови
онкотическое
давление уменьшается, поэтому
молекулы воды устремляются в сторону большего
давления, то есть в ткани, что приводит к
возникновению отеков.
81.
Биологическое значение осмосаИнтерстициальная жидкость
соли
Концентрация воды = 90%
протеины
Кровь
соли
Концентрация воды = 70%
протеины
cell
82.
Биологическое значение осмосаОтеки
делятся
на
«голодные»
(когда
организм не получает в
достаточном
количестве
белков
с
пищей) и «почечные»
(когда
часть
белков
вследствие дисфункции
почек теряется с мочой).
83.
Биологическое значение осмосаОсмотический
гомеостаз
регулируется работой
органов
дыхания,
отделения пота, но
главным
образом
работой почек.
84. Вопросы для самоконтроля
1. Сформулируйте закон Рауля длянеэлектролитов и его следствия.
2. По каким формулам можно рассчитать
изотонический коэффициент ВантГоффа?
3. Какой процесс называется осмосом?
4. От каких факторов зависит
осмотическое давление?
5. Охарактеризуйте биологическую роль
осмоса.
6. Дайте определение онкотическому
давлению.
85.
БЛАГОДАРЮ ЗАВАШЕ ВНИМАНИЕ!









































































 Химия
Химия








