Похожие презентации:
Коллигативные свойства растворов
1. Коллигативные
свойстварастворов
2. Коллигативные свойства растворов – это свойства, которые зависят от числа частиц растворенного в веществе и не зависят от его
природы:1. Понижение давления насыщенного пара (ДНП) над
раствором
2. Понижение температуры замерзания раствора (ΔТз)
и повышение температуры кипения раствора (ΔТк)
3. Осмотическое давление (π).
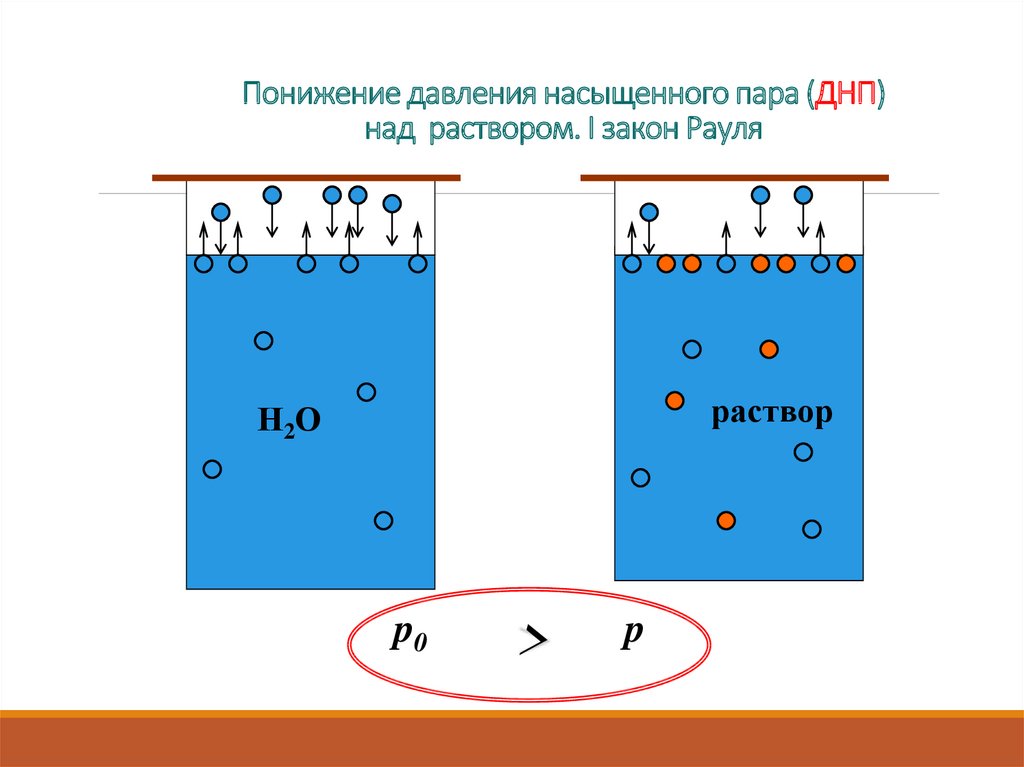
3. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля
Н2Оp0
4. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля
↑t ↑p0H2O:
00C – 4,6 мм рт. ст.
200C – 17,4 мм рт. ст.
1000C – 760 мм рт. ст.
p0= pатм. жидкость закипает
5. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля
растворН2О
p0
>
p
6. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля
Относительное понижение ДНП растворителя надраствором нелетучего неэлектролита равно молярной доле
растворенного вещества.
РО – Р = N(x ); N(x ) =
n(x2)
m
;
n
=
2
2
PO
n(x2) + n(x1)
M
PO – ДНП над чистым растворителем (Па, атм, мм рт.ст.);
Р – ДНП над раствором;
N(x2) – молярная доля растворенного вещества;
n(x2) – количество растворенного вещества (моль);
n(x1) – количество растворителя (моль);
m – масса вещества (г);
М – молярная масса вещества (г/моль);
Чем больше концентрация растворенного вещества, тем ниже ДНП над
раствором
7. II закон Рауля
ΔТзамерзания = Тзамерзания р-ля – Тзамерзания р-ра = ΔТзΔТкипения = Ткипения р-ра – Ткипения р-ля = ΔТк
Повышение температуры кипения (ΔТк) и
понижение температуры замерзания (ΔТз)
разбавленных растворов неэлектролитов прямо
пропорционально моляльной концентрации
раствора.
ΔТк = Кэ·Сm;
ΔТз = Кз·Сm;
8. II закон Рауля
Чем больше концентрация растворенного вещества, тем выше Тк и нижеТз раствора.
ΔТк = Кэ·Сm;
ΔТз = Кз·Сm;
Сm – моляльная концентрация – количество растворенного
вещества в 1 кг растворителя (моль/кг):
m вещ-ва
Cm = ————————
M · m раств-ля (кг)
Кэ – эбулиометрическая const;
Кз (КК) – криометрическая const;
Эти константы зависят от природы растворителя.
При Cm = 1 моль/кг; Кз = ΔТз; Кэ = ΔТк.
КзН2О = 1,86 кг·К/моль; КэН2О = 0,52 кг·К/моль;
9. Криометрия –метод определения молярной массы вещества (М) по температуре замерзания: Кз · m вещ-ва М вещ-ва = —————— (г/моль)
ΔТз·m раств-ля (кг)10. Осмос. Осмотическое давление
Осмос – это односторонняядиффузия
воды через полупроницаемою
мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор
с большей концентрацией.
Вода из сосуда переходит через
полупроницаемую мембрану (целлофан,
h
оболочка мочевого пузыря) в сосуд
с более концентрированным раствором.
Уровень жидкости в этом сосуде поднимается
на высоту h.
Осмотическое давление π – это сила, вызывающая ОСМОС или
гидростатическое давление столба жидкости, высотой h , от которого
прекращается осмос.
11.
Закон Вант-Гоффа – для определения π :Осмотическое давление прямо пропорционально молярной
концентрации раствора и абсолютной температуре:
π = R* C(x)* T
R – газовая постоянная = 8,31 кПа * л/моль * К или 0,083 атм * л/моль *К
Т – абсолютная температура по К (СО + 273);
С(х) – молярная концентрация (моль/л) – количество моль растворенного
вещества в 1 л раствора.
m вещ-ва
C(x) = (моль/л)
M вещ-ва * V р-ра (л)
На практике π определяют по ΔТз раствора (C(x)≈Cm):
R * T * ΔТз
π =
Кз
12. Значение осмоса
упругость, тургор клетокэластичность тканей, форма органов
усвоение пищи, образование лимфы, мочи, кала
действие лекарств
За счет осмоса вода в организме распределяется между кровью, тканями, клетками.
13. Осмотическое давление крови
Состав плазмы крови: 90 % Н2О, 7 % белков, 0,9 % эл-отв (> NaCl), ≈2 % (лип., а/к, глюкозы, органических кислот).
π = π НМС + π ВМС
(эл. + неэл.) (белки)
ΔТз·R·T
По ΔТз крови =0,56 Сº определяют π плазмы = ———— =
Кз
0,56·0,083·(273+37º)
= ————————— = 7,65 атм
1,86
π пл вмс (белки) = 0,04 – 0,03 атм
π плазмы = π НМС + π ВМС = 7,65 + 0,03(0,04) ≈ 7,7 – 8,1 атм
14. Осмотическое давление, которое зависит от белков называется онкотическим (0,03 – 0,04 атм.). При длительном голодании, болезни
почек концентрация белков в крови уменьшается,онкотическое давление в крови снижается и возникают
онкотические отеки: вода переходит из сосудов в ткани, где πОНК
больше. При гнойных процессах πОНК возрастает в 2–3 раза в очаге
воспаления, так как увеличивается число частиц из-за разрушения
белков.
В организме осмотическое давление должно быть постоянным (≈
7,7 атм.). При болезнях больным вводят изотонические растворы.
Это растворы, осмотическое давление которых равно π ПЛАЗМЫ ≈ 7,7
атм. (0,9 % NaCl – физиологический раствор, 5 % раствор глюкозы).
Растворы, у которых π больше, чем у π ПЛАЗМЫ, называются
гипертоническими. В медицине они применяются для очистки ран
от гноя (10 % NaCl), для удаления аллергических оттенков (10 %
CaCl2, 20 % – глюкоза), в качестве слабительных лекарств
(Na2SO4∙10H2O, MgSO4∙7H2O).
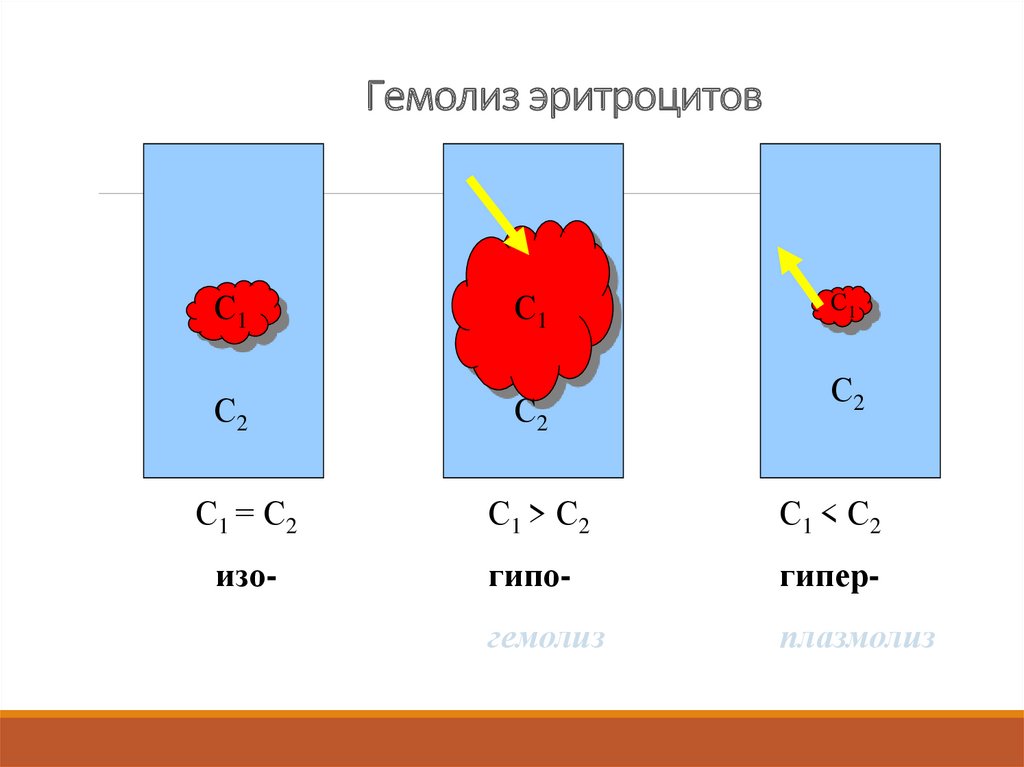
15. Гемолиз эритроцитов
С1С2
С1
С2
С1
С2
С1 = С2
С1 > С2
С1 < С2
изо-
гипо-
гипер-
гемолиз
плазмолиз
16. Плазмолиз – явление сжатия, высушивания клеток в гипертоническом растворе. Идет осмос воды из клетки в раствор, где π больше.
Гемолиз – явление набухания и разрыва клетокэритроцитов в гипотоническом растворе. Идет осмос
воды в клетки. Клетка набухает, оболочка разрывается.
Растворы, у которых π меньше, чем у π ПЛАЗМЫ,
называются гипотоническими.
Плазмолиз – явление сжатия, высушивания клеток в
гипертоническом растворе. Идет осмос воды из клетки в
раствор, где π больше. Растворы, у которых π больше, чем у
π ПЛАЗМЫ, называются гипертоническими.
17. Коллигативные свойства растворов электролитов
В растворах электролитов число частиц больше из-за диссоциации.Вант-Гофф дал поправочный изотонический коэффициент i,
который учитывает диссоциацию электролитов.
i = 1+ α (n – 1)
/
\
степень
число частиц
диссоциации
из 1 молекулы
На практике i определяют по ΔТз, ΔТк, π.
ΔТз пр
ΔТк пр
π пр
i = ———— = ————— = —————
ΔТз теор
ΔТк теор
π теор
С учетом i формулы для определения коллигативных свойств имеют вид:
РО – Р
——— = i · N(x2); ΔТз = i · Кз· Сm; ΔТк = i · Кэ · Cm; π = i · R · C(x)
РО
18. Для сильных электролитов (α≈1):
α=(i-1)/(n-1)NaCl ↔ Na+ + Cl2 иона => n=2, i=2 при α=1
CaCl2 ↔ Ca2+ + 2Cl3 иона => n=3, i=3 при α=1
19.
Спасибо за внимание.1ое занятие 2го семестра посвящено данной теме!

















 Химия
Химия








