Похожие презентации:
Уравнение Шредингера. Квантовые числа
1.
U i2m
t
2
Дифференциальное ур-ие 2-го
порядка в частных производных –
Стационарное
уравнение Шредингера.
2
2m
( x, y, z ) ( E U ) ( x, y, z ) 0
Полная энергия
системы
Задаётся потенциальная энергия U
Находится Е и Ψ(x, y, z)
Плотность вероятности обнаружения частицы в
данной точке пространства.
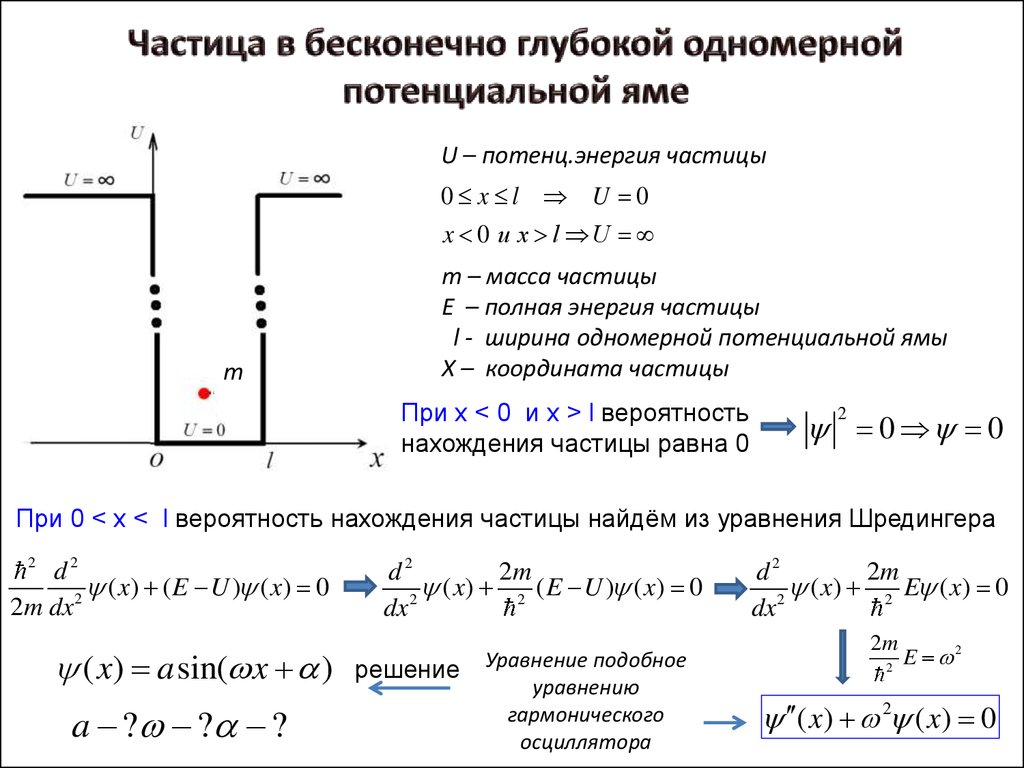
2.
U – потенц.энергия частицы0 x l U 0
x 0 и x l U
m
m – масса частицы
E – полная энергия частицы
l - ширина одномерной потенциальной ямы
X – координата частицы
При х < 0 и x > l вероятность
нахождения частицы равна 0
0 0
2
При 0 < х < l вероятность нахождения частицы найдём из уравнения Шредингера
2
d2
( x) ( E U ) ( x) 0
2
2m dx
( x) a sin( x )
a ? ? ?
d2
2m
(
x
)
( E U ) ( x) 0
2
2
dx
решение
Уравнение подобное
уравнению
гармонического
осциллятора
d2
2m
(
x
)
E ( x) 0
2
2
dx
2m
2
E 2
( x) 2 ( x) 0
3.
Уравнение подобноеуравнению
гармонического
осциллятора
( x) ( x) 0
2
( x) a sin( x )
Непрерывность волновой
функции → граничные условия :
m
E
2
En
2
2m
x 0
x l
En En 1 En
2ml
x 0
x l
Собственнные значения энергии
2
0
0 a sin l 0 l n n 1, 2...
2m
2 2
2
2
E
2 n
2
l
2
n
2
2
0 a sin 0 0
2 2
2ml
a ? ? ?
(2n 1)
2
Квантование энергии!
Вытекает прямо из уравнения
Шредингера
Расстояние между соседними
энергетическими уровнями
4.
Найдём Ψ( x) a sin( x )
2
2
2
l
0
n
( x) n ( x) a sin
2
a ?
l
Условие нормировки :
dx 1
частица с вероятностью 1 находится в
потенциальной яме:
m
n
x
l
0
1
n
n
2 1
dx
a
(sin
x
)
dx
a
(
1
cos
2
x)dx
0
0
l
2
l
1
1
*
2
2
0
1 l
l
2n l 1 a 2l 1
a ( x0
sin
x 0) 2
2
4n
l
2
2
n
n ( x)
sin
x
l
l
2 2 n
sin
x
l
l
2
n
2
a
l
Собственные функции, соответствующие
собственным значениям энергии с квантовым
числом n (n=1, 2, 3….∞).
Плотность вероятности обнаружить частицу в
данной точке
5.
Плотность вероятности обнаружить частицу вданном месте
Квантование энергии
En
2 2
2ml
2
n
2
n ( x)
2
n
sin
x
l
l
2
En
o
E4
2 2 n
sin
x
l
l
2
n
n 4
o
n 3
o
n 1
n 2
o
o
o
E3
E2
E1
l
0
En
2
2ml
2
(2n 1)
2
m ...
l ...
x
0
Классическая
физика
l
x
6.
Найдём масштаб квантования энергии.Пример 1: электрон, m≈10-30 кг, размер ямы l=10 см (свободный электрон
в металле)
2 2
2
2
68
6
.
6
10
37
18
n
En
(
2
n
1
)
n
10
n
Дж
10
n эВ
2
2
2
30
2
ml
2ml
4 10 10
2
2
Спектр энергии – практически непрерывный
классическая физика
Пример 2: электрон, размер ямы l ≈ 10-8 см
Размеры области
порядка размера атома
2 6.62 10 68
19
n
10
n Дж 1n эВ(!!)
En
n
2
30
20
2
4 10 10
ml
2 2
Энергия квантована!
7.
Общие выводы из рассмотренногопримера:
Квантование энергии – следствие «волновых»
свойств частиц – получается из основных
положений квантовой механики (уравнение
Шредингера) без каких-либо дополнительных
предположений (постулатов).
Результат решения уравнения Шредингера:
информация о распределении вероятности
нахождения частицы с определенным
(дискретным) значением энергии в
соответствующем квантовом состоянии с
номером n.
Увеличение массы частицы или увеличение линейных размеров
пространства приводит к переходу от дискретного спектра энергии к
непрерывному, т.е. квантовая механика не противоречит классической
физике, а является более общей теорией.
8.
9.
Решение уравнения Шредингера для электрона вцентрально-симметричном поле ядра
Система: ядро с зарядом +Ze и один электрон
Полная энергия
системы
2
2m
Потенциальная
энергия системы
( x, y, z ) ( E U ) ( x, y, z ) 0
Ze2
U
4 0 r
Ур-е Шредингера
Можно показать: уравнение Шредингера имеет
однозначные, конечные и непрерывные решения
при любых положительных значениях полной
энергии: Е>0 (свободный электрон) ;
но лишь при дискретных отрицательных значениях
полной энергии: E<0 (связанный электрон).
Результат решения:
собственные
значения энергии
me Z 2e 4 1
En 2 2 2
8h 0 n
n = 1,2,3,…
Совпадает с Еn, полученной Бором (!!). Но здесь получается из ур-я Шредингера без
каких либо дополнительных предположений (типа постулатов Бора).
10.
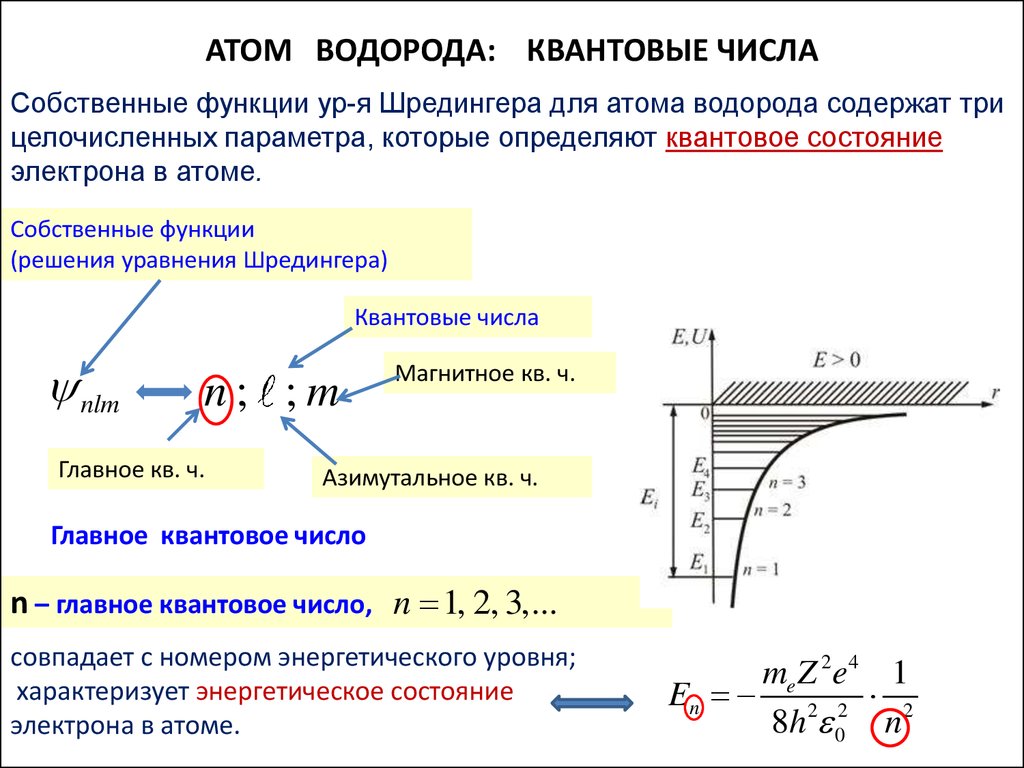
АТОМ ВОДОРОДА: КВАНТОВЫЕ ЧИСЛАСобственные функции ур-я Шредингера для атома водорода содержат три
целочисленных параметра, которые определяют квантовое состояние
электрона в атоме.
Собственные функции
(решения уравнения Шредингера)
Квантовые числа
nlm
n; ;m
Главное кв. ч.
Магнитное кв. ч.
Азимутальное кв. ч.
Главное квантовое число
n – главное квантовое число, n 1, 2, 3,...
совпадает с номером энергетического уровня;
характеризует энергетическое состояние
электрона в атоме.
me Z 2e 4 1
En 2 2 2
8h 0 n
11.
АТОМ ВОДОРОДА: КВАНТОВЫЕ ЧИСЛАnlm
n; ;m
Азимутальное квантовое число
– азимутальное квантовое число
0,1, 2, ....n 1
определяет величину (модуль) момента импульса электрона в атоме:
L
Величина момента импульса квантована
( 1)
n 1 l 0, L 0
(!)
В отличие от модели Бора (!!)
l 0, L 0
n 2
l 0, L 0
l 1, L 2
n 3 l 1, L 2
l 2, L 6
n 4. .............
12.
АТОМ ВОДОРОДА: КВАНТОВЫЕ ЧИСЛАnlm
n; ;m
Магнитное квантовое число
m – магнитное квантовое число m 0, 1, 2,...
m определяет проекцию момента импульса на выделенное
направление (например, направление магнит. или электр. поля)
Lz m
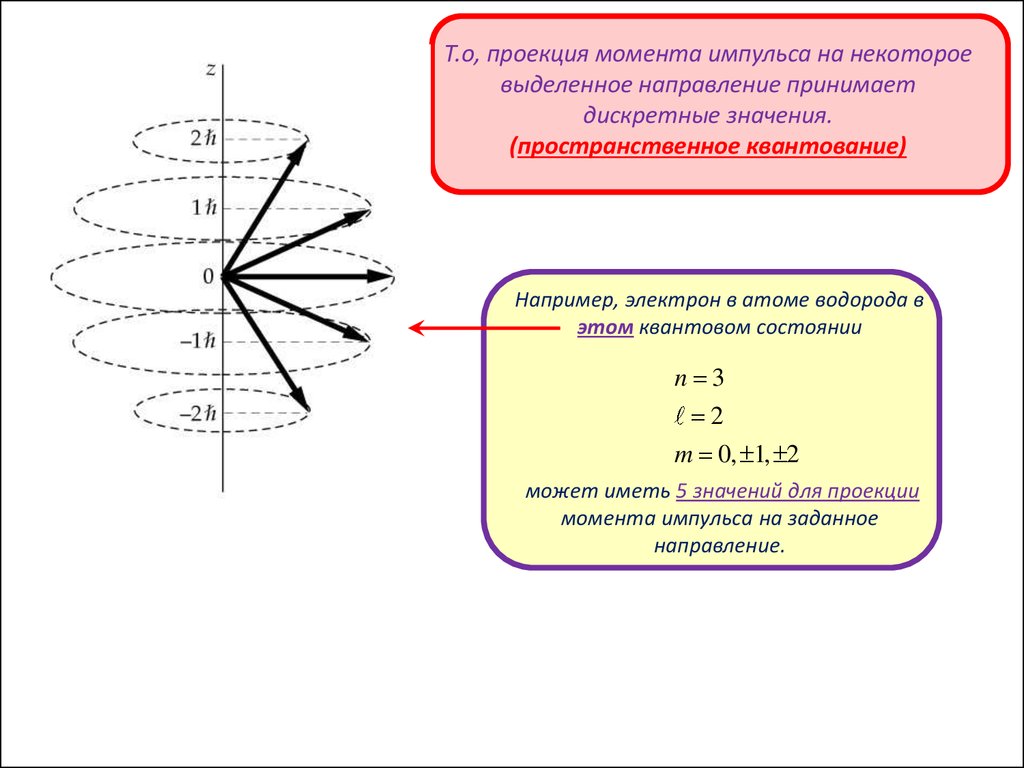
Т.е. проекция момента импульса на некоторое
выделенное направление принимает
дискретные значения - пространственное
квантование.
Например, электрон в атоме водорода в
квантовом состоянии n 3, l 2 L
L 6
6
m 0, 1, 2
может иметь 5 значений для проекции момента
импульса на заданное направление.
13.
АТОМ ВОДОРОДА: ВЫРОЖДЕННЫЕ СОСТОЯНИЯnlm
n – главное квантовое число,
n; ;m
n 1, 2, 3,...
– азимутальное квантовое число
m – магнитное квантовое число
me Z 2e 4 1
En 2 2 2
8h 0 n
0,1, 2, ....n 1
m 0, 1, 2,...
Энергия зависит только от n
Одному энергетическому состоянию может соответствовать несколько
квантовых состояний электрона – вырожденные состояния.
Число вырожденных состояний – кратность вырождения .
1 2(n 1) 1
(2 1)
n n2
2
0
n 1
n2
14.
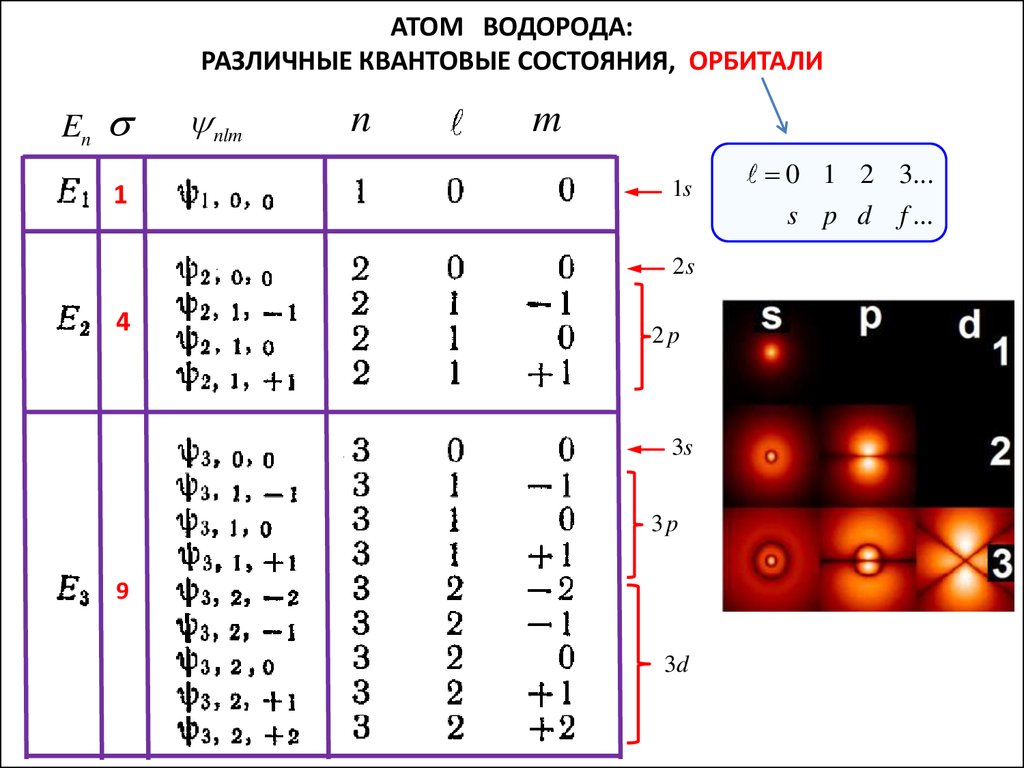
АТОМ ВОДОРОДА:РАЗЛИЧНЫЕ КВАНТОВЫЕ СОСТОЯНИЯ, ОРБИТАЛИ
En
1
nlm
n
m
1s
s p d
2s
4
0 1 2 3...
2p
3s
3p
9
3d
f ...
15.
Атом водорода: распределение плотности вероятностинахождения электрона по r
(1s)
Зависимость плотности
вероятности нахождения
электрона на расстоянии r
от ядра в единицах 1-го
боровского радиуса r1
Определяется главным
квантовым числом
(2p)
(3d)
n
Т.о., радиусы боровских
орбит совпадают с
наиболее вероятными
расстояниями электрона от
ядра.
16.
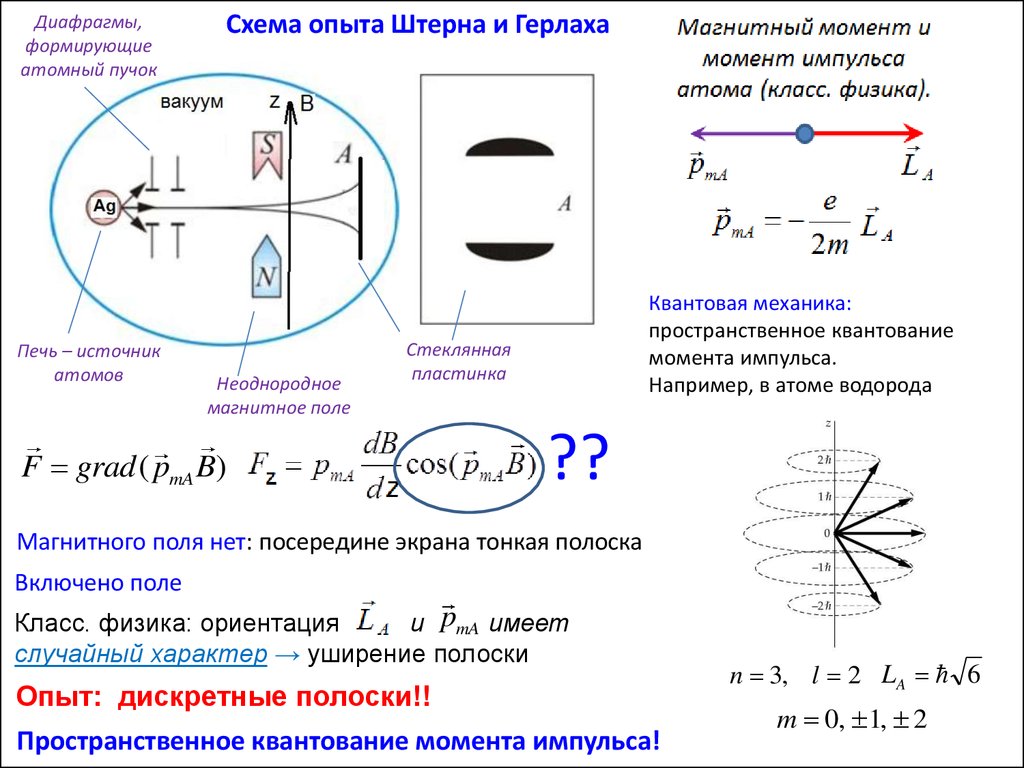
1922 г.17.
Диафрагмы,формирующие
атомный пучок
Печь – источник
атомов
Схема опыта Штерна и Герлаха
Неоднородное
магнитное поле
Квантовая механика:
пространственное квантование
момента импульса.
Например, в атоме водорода
Стеклянная
пластинка
F grad ( pmA B)
??
Магнитного поля нет: посередине экрана тонкая полоска
Включено поле
Класс. физика: ориентация
и pmA имеет
случайный характер → уширение полоски
Опыт: дискретные полоски!!
Пространственное квантование момента импульса!
n 3, l 2 LA 6
m 0, 1, 2
18.
Собственный магнитный момент электрона - спинПри отсутствии у атома магнитного момента (щелочные металлы, Ag) в
опыте Штерна и Герлаха не должно наблюдаться расщепление
атомного пучка.
Опыт
расщепление есть – на 2 полоски!!
Гоудсмит и Уленбек (1925г):
У электрона существует собственный момент импульса ( спин ) S
и спиновый магнитный момент ps , который связан со спином
соотношением:
e
ps S
m
в отличие от
pmA
e
LA
2m
Проекция спина на выделенное направление принимает всего
два значения:
1
S z ms , где ms
2
спиновое
квантовое число
19.
Первое начало термодинамики. Теплоёмкость идеального газа. Уравнение Майера.Работа, совершаемая идеальным газом, при различных физических процессах
(работа в изопроцессах).
Второе начало термодинамики. Закон возрастания энтропии и необратимое
расширение газа в вакуум в качестве примера. Статистический смысл энтропии.
Формула Больцмана. Третье начало термодинамики. Основное уравнение
термодинамики для обратимых процессов. Энтропия идеального газа. К.п.д.
тепловой машины. К.п.д. цикла Карно для идеального газа.
Интерференция света. Условия максимумов и минимумов интенсивности света.
Опыт Юнга. Временная и пространственная когерентность.
Дифракция света. Метод зон Френеля. Дифракция на круглом отверстии, диске.
Дифракционная решетка. Угловая дисперсия и разрешающая способность
дифракционной решетки (самостоятельно).
Законы излучения абсолютно чёрного тела.
Явления квантовой оптики. Гипотеза и формула Планка.
Фотоэффект и его трактовка Эйнштейном. Фотон, энергия, масса и импульс фотона.
Корпускулярно - волновой дуализм.
Закономерности в атомных спектрах. Обобщенная формула Бальмера. Постулаты
Бора. Атом водорода по Бору. Недостатки модели атома Бора.
Гипотеза де-Бройля. Опыты по дифракции электронов. Волновые свойства
микрочастиц. Принцип и соотношение неопределенности Гейзенберга.
20.
Волновая функция. Уравнение Шредингера. Стационарное уравнение Шредингера.Физический смысл и свойства волновой функции. Микрочастица в бесконечно глубокой
одномерной потенциальной яме.
Квантово-механическая теория атома водорода. Квантовые числа.
Пространственное квантование и спин электрона – опыты Штернаи Герлаха
21.
22.
Распределение электронов по энергетическим уровням вмногоэлектронных атомах. Принцип Паули.
1) Квантовое состояние каждого электрона в атоме характеризуется
4-мя квантовыми числами:
n 1, 2,....
l 0,1,...n 1
m 0, 1,... l
mS 1
2
Данному n соответствует n2 состояний, в которых могут
находится не более 2n2 электронов (в слое).
2) Энергия квантового состояния в основном зависит от кв.числа
слабее от l , еще слабее от m и еще слабее от mS .
n
3) В нормальном ( невозбужденном ) состоянии атома электроны
располагаются на самых низких доступных для них энергетических
уровнях.
4) Принцип Паули: в любой квантово-механической системе не
может быть даже 2-х электронов, обладающих одинаковой
совокупностью 4-х квантовых чисел.
,
23.
ЭЛЕКТРОННАЯ ОБОЛОЧКА -совокупность электронов в атоме, состояниякоторых характеризуются определёнными гл. квантовым числом n и
орбитальным квантовым числом l.
Согласно принципу Паули, макс. значение числа электронов для данной
электронной оболочки 2(2l+1).
ЭЛЕКТРОННЫЙ СЛОЙ - совокупность электронов с определённым п.
Данному n соответствует n2 состояний, в которых могут находится не
более 2n2 электронов (в слое).
n =1
n =2
n =3
n =4
n =5
2 электрона
8 электронов
18 электронов
32 электрона
50 электрона
К -слой
L - слой
M - слой
N - слой
O - слой
24.
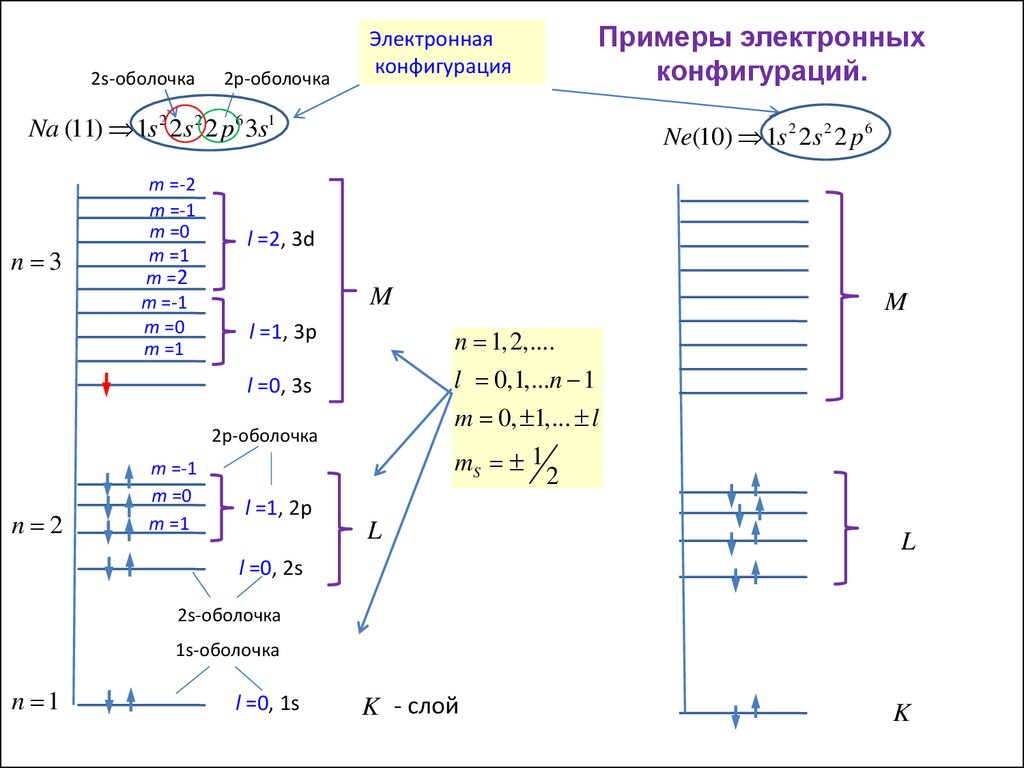
2s-оболочка2p-оболочка
Электронная
конфигурация
Примеры электронных
конфигураций.
Na (11) 1s 2 2s 2 2 p6 3s1
n 3
m =-2
m =-1
m =0
m =1
m =2
m =-1
m =0
m =1
Ne(10) 1s 2 2s 2 2 p 6
l =2, 3d
M
l =1, 3p
n 1, 2,....
l 0,1,...n 1
m 0, 1,... l
mS 1
2
l =0, 3s
2p-оболочка
n 2
m =-1
m =0
m =1
M
l =1, 2p
L
L
l =0, 2s
2s-оболочка
1s-оболочка
n 1
l =0, 1s
K - слой
K
25.
Квантовая механика:периодичность свойств элементов
n 3
H
He
Li
1s1
1s2
1s22s1
3d
n 3
3d
n 3
Be
Ne
1s22s2
1s22s8
3d
n 3
M
3d
M
M
3p
3p
3p
3p
3p
1s
1s
1s
1s
1s
2p
L
n 2
1s
2p
L
n 2
2s
2s
n 1
B, C, N, O, F
n 3
M
M
n 2
3d
Пропускаем
K
n 1
1s
2p
L
n 2
2s
K
Химия: стремление к
заполненному электронному слою
(электронная структура атомов
инертных газов)
n 1
1s
2p
L
n 2
n 1
1s
L
2s
2s
K
2p
K
n 1
1s
Периодичность хим. свойств элементов:
восстановители, окислители, инертные газы и
т.п.
K
26.
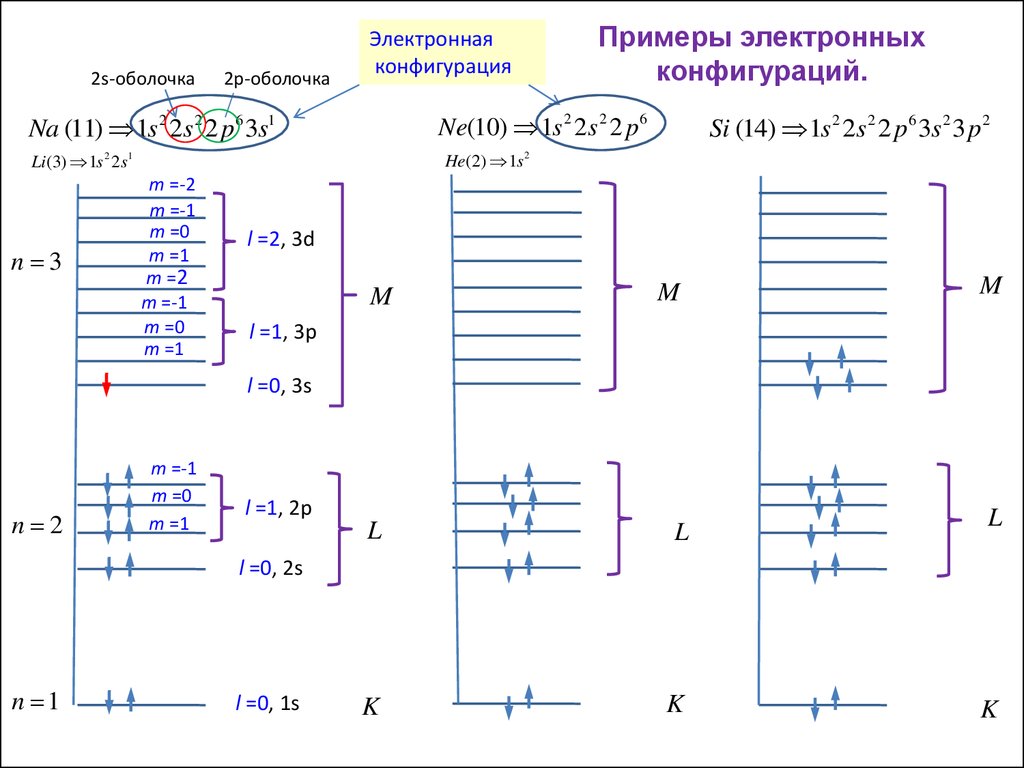
2s-оболочка2p-оболочка
Электронная
конфигурация
Ne(10) 1s 2 2s 2 2 p 6
Na (11) 1s 2 2s 2 2 p6 3s1
Si (14) 1s 2 2s 2 2 p6 3s 2 3 p 2
He(2) 1s 2
Li (3) 1s 2 2s1
n 3
Примеры электронных
конфигураций.
m =-2
m =-1
m =0
m =1
m =2
m =-1
m =0
m =1
l =2, 3d
M
M
M
l =1, 3p
l =0, 3s
n 2
m =-1
m =0
m =1
l =1, 2p
L
L
K
K
L
l =0, 2s
n 1
l =0, 1s
K
27.
28.
Самостоятельно:ВСЁ, ЧТО БЫЛО УКАЗАНО В ЛЕКЦИЯХ :
Закон зеркального отражения (самостоятельно)
Зеркала Френеля
Бипризма Френеля
Интерференция света отражённого от тонких пластинок (плёнок)
Полосы равного наклона.
Полосы равной толщины
Интерференция на клине
Кольца Ньютона
Дифракционная решетка.
Угловая дисперсия и разрешающая сила дифракционной решетки.
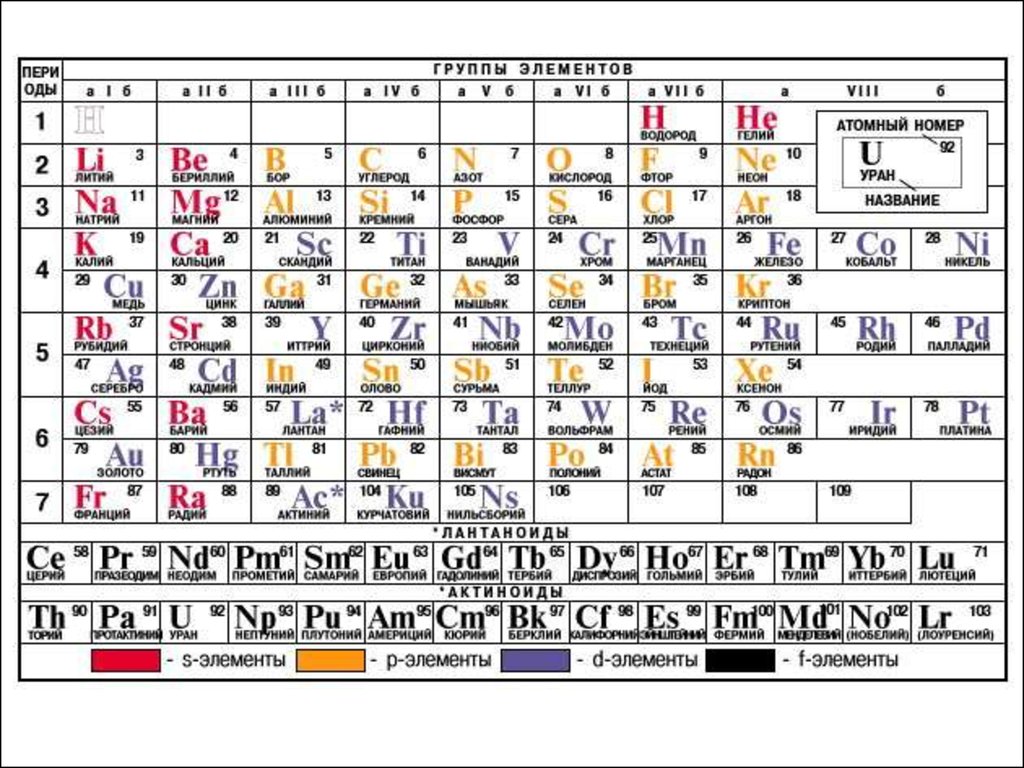
Периодическая система элементов (более детально, включая переходные металлы элементы побочных подгрупп в атомах которых появляются электроны на d- и fорбиталях.
29.
Данномуn
соответствует
не более
n=1
n=2
n=3
n=4
n=5
n2
состояний, в которых могут находится
2n 2
электронов (в слое).
2 электрона
8 электронов
18 электронов
32 электрона
50 электронов
K – слой
L – слой
M – слой
N – слой
O – слой
Для полностью заполненной оболочки и, соответственно, слоя характерно
равенство нулю суммарного орбитального и спинового моментов.
n=1
n=2
2 электрона
8 электронов
K – слой
L – слой
30.
Состояния с различными значениями азимутального квантового числаотличаются
величиной момента импульса и формой распределения плотности вероятности:
L
( 1)
0,1,2...n 1
Т.о, модуль момента импульса принимает дискретные значения:
E1 L 0
E2 L 0; 2
E3 L 0; 2 ; 6
Проекция момента импульса на некоторое выделенное направление определяется
магнитным квантовым числом т :
Lz m
Lz L m
l (l 1) max m l
m 0, 1, 2,...
31.
Т.о, проекция момента импульса на некотороевыделенное направление принимает
дискретные значения.
(пространственное квантование)
Например, электрон в атоме водорода в
этом квантовом состоянии
n 3
2
m 0, 1, 2
может иметь 5 значений для проекции
момента импульса на заданное
направление.
32.
n 10
m 0
n 2; 0; m 0
n 2; 1; m 0
n 2; 1; m 1
33.
34.
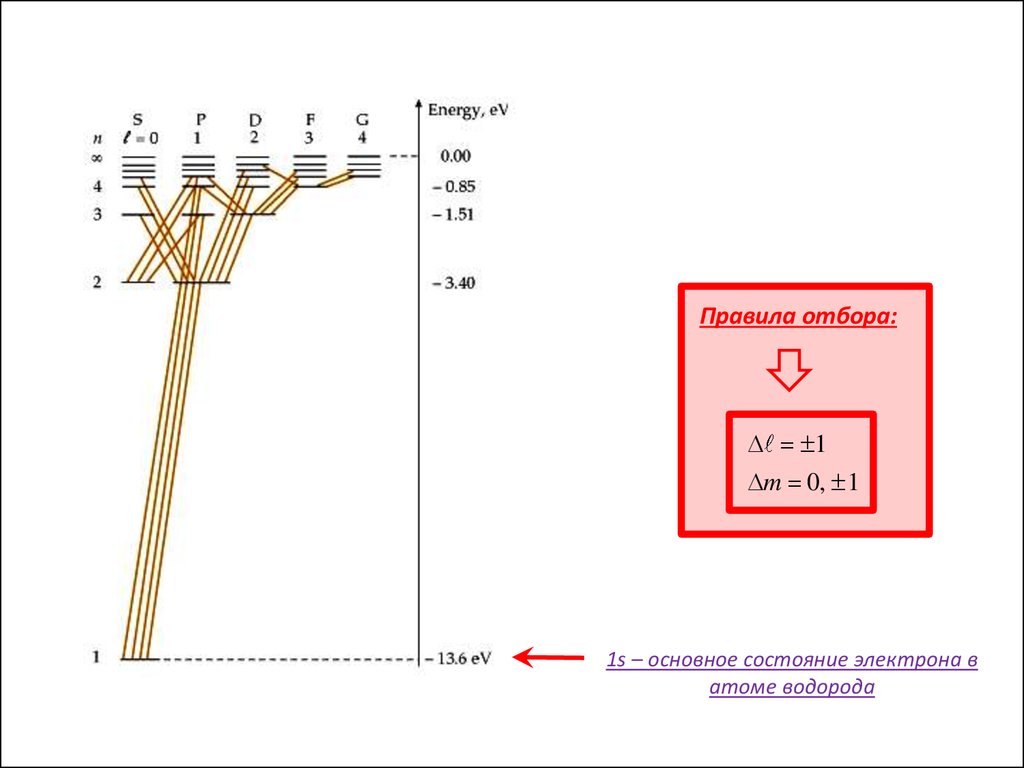
Правила отбора:1
m 0, 1
1s – основное состояние электрона в
атоме водорода
35.
m=3 – серия ПашенаE 0
E4
E3
E2
m=2 – серия Бальмера
3,40 eV
m=1 – серия Лаймана
E1
13,6 eV
E 0
Соответствует
электрону….
E>0
Соответствует
электрону….
36.
EnlmСильные электрические поля – снятие
вырождения – эффект Штарка.
Сильные магнитные поля – снятие
вырождения – эффект Зеемана.
37.
3.Стационарное уравнение Шредингера.
Если силовое поле, в котором движется частица, стационарно, т.е. не
зависит от времени, то решение ур-ия Шредингера ищут в виде:
( x , y , z , t ) ( x, y , z ) e
2
2m
2
2m
U i
( x, y, z ) e
2
2m
2
2m
( x, y, z )
t
E
i t
E
U ( x, y, z ) e
E
i t
- Координатная часть
волновой функции
- Полная энергия
частицы
i ( x, y, z ) ( i
E
)e
E
i t
( x, y, z ) U ( x, y, z ) ( x, y, z ) E
( x, y, z ) ( E U ) ( x, y, z ) 0
2
E
i t
2
Не зависит от времени
Стационарное
уравнение Шредингера.
38.
22m
( x, y, z ) ( E U ) ( x, y, z ) 0
Уравнение Шредингера имеет решения при определенных значениях Е
– «собственные значения».
En
«Собственным значениям» соответствуют «собственные
функции», характерные для определенного состояния частицы
(квантово-механической системы).
n
Квадрат модуля «собственной функции» определяет вероятность
этого состояния.
39.
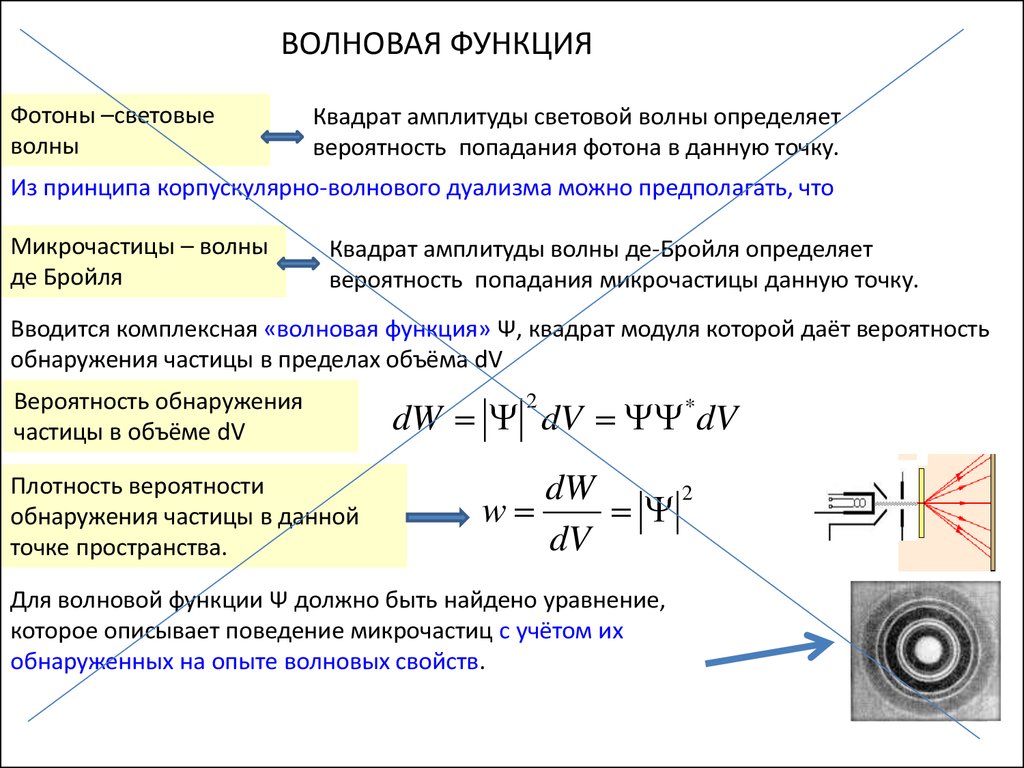
ВОЛНОВАЯ ФУНКЦИЯФотоны –световые
волны
Квадрат амплитуды световой волны определяет
вероятность попадания фотона в данную точку.
Из принципа корпускулярно-волнового дуализма можно предполагать, что
Микрочастицы – волны
де Бройля
Квадрат амплитуды волны де-Бройля определяет
вероятность попадания микрочастицы данную точку.
Вводится комплексная «волновая функция» Ψ, квадрат модуля которой даёт вероятность
обнаружения частицы в пределах объёма dV
Вероятность обнаружения
частицы в объёме dV
Плотность вероятности
обнаружения частицы в данной
точке пространства.
dW dV *dV
2
dW
2
w
dV
Для волновой функции Ψ должно быть найдено уравнение,
которое описывает поведение микрочастиц с учётом их
обнаруженных на опыте волновых свойств.
40.
Вопросы1. Микрочастицы обладают свойствами корпускулярности: масса, размеры, заряд неделимы. Но заряд то в атоме
размазан – облако?? Нет, в статистической интерпретации волновой функции (Борн, в отличие от
Шредингера) облако даёт вероятность обнаружения электрона с его неделимым зарядом.
2. Какова плотность вероятности для электрона в атоме водорода для различных состояний? Например, для
состояний с n≥2 эта плотность равномерно распределена по площади соответствующего эллипсу (кругу) или
плотность максимальна в районе линии эллипса («траектории»)?
3. Как интерпретировать момент импульса? Тот же вопрос и относительно импульса (скорости)? Т.е. если в
масштабах атома теряет смысл понятие траектории (есть только плотность вероятности, электрон размазан), то
что такое скорость, импульс, момент импульса?
4. Ответ по п. 3. Есть разница между импульсом и моментом импульса в смысле законов сохранения. В
классической механике в центрально симметричном поле импульс постоянно меняется под действием
центральной силы, а момент импульса сохраняется. Законы сохранения остаются в квантовой механике.
Поэтому, при том что импульс не определён (по Гейзенбергу), момент импульса =const и соответственно
должен быть точно определён и, соответственно, определяется из уравнения Шредингера для центрального
поля. Определённость момента импульса означает определённость произведения rp, но отнюдь не r и p по
отдельности. Таким образом, определённость момента импульса может отнюдь не противоречить принципу
неопределённости, что по-видимому где-то и доказывается. Из сказанного следует, что момент импульса можно
не связывать с траекторией, в частности в классической механике одному и тому же моменту импульса
соответствует бесконечное множество траекторий.
41.
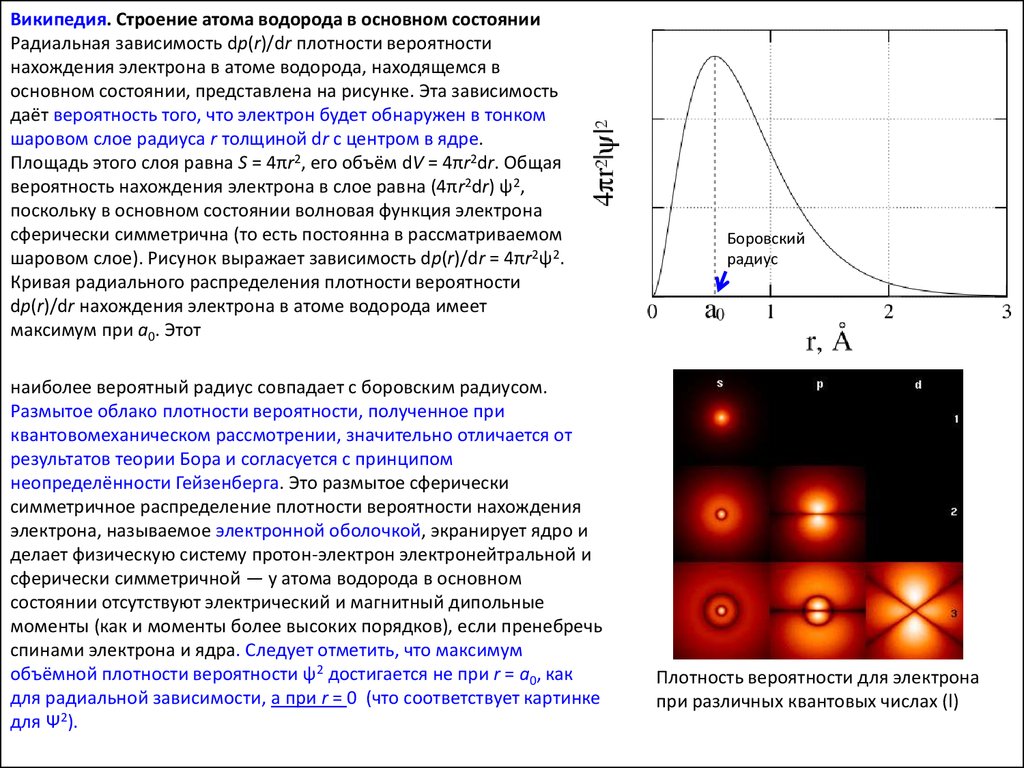
Википедия. Строение атома водорода в основном состоянииРадиальная зависимость dp(r)/dr плотности вероятности
нахождения электрона в атоме водорода, находящемся в
основном состоянии, представлена на рисунке. Эта зависимость
даёт вероятность того, что электрон будет обнаружен в тонком
шаровом слое радиуса r толщиной dr с центром в ядре.
Площадь этого слоя равна S = 4πr2, его объём dV = 4πr2dr. Общая
вероятность нахождения электрона в слое равна (4πr2dr) ψ2,
поскольку в основном состоянии волновая функция электрона
сферически симметрична (то есть постоянна в рассматриваемом
шаровом слое). Рисунок выражает зависимость dp(r)/dr = 4πr2ψ2.
Кривая радиального распределения плотности вероятности
dp(r)/dr нахождения электрона в атоме водорода имеет
максимум при a0. Этот
наиболее вероятный радиус совпадает с боровским радиусом.
Размытое облако плотности вероятности, полученное при
квантовомеханическом рассмотрении, значительно отличается от
результатов теории Бора и согласуется с принципом
неопределённости Гейзенберга. Это размытое сферически
симметричное распределение плотности вероятности нахождения
электрона, называемое электронной оболочкой, экранирует ядро и
делает физическую систему протон-электрон электронейтральной и
сферически симметричной — у атома водорода в основном
состоянии отсутствуют электрический и магнитный дипольные
моменты (как и моменты более высоких порядков), если пренебречь
спинами электрона и ядра. Следует отметить, что максимум
объёмной плотности вероятности ψ2 достигается не при r = a0, как
для радиальной зависимости, а при r = 0 (что соответствует картинке
для Ψ2).
Боровский
радиус
Плотность вероятности для электрона
при различных квантовых числах (l)
42.
Визуализация орбиталей атома водородаИзображение справа показывает первые несколько орбиталей
атома водорода (собственные функции гамильтониана). Они
представляют собой поперечные сечения плотности вероятности,
величина которой отражена цветом (чёрный цвет соответствует
минимальной плотности вероятности а белый — максимальной).
Квантовое число углового момента l обозначено в каждой колонке,
используя обычные спектроскопические обозначения (s означает l =
0; p: l = 1; d: l = 2). Главное квантовое число n (= 1, 2, 3…) отмечено
справа от каждого ряда. Для всех картин магнитное квантовое число
m равно 0, и сечение взято в плоскости — XZ, Z — вертикальная ось.
Плотность вероятности в трёхмерном пространстве получается при
вращении картинки вокруг оси Z.
Основное состояние, то есть состояние самой низкой энергии, в
котором обычно находится электрон, является первым, состоянием
1s (n = 1, l = 0). Изображение с большим количеством орбиталей
доступно до более высоких чисел n и l. Отметим наличие чёрных
линий, которые появляются на каждой картинке, за исключением
первой. Это узловые линии (которые являются фактически узловыми
поверхностями в трёх измерениях). Их общее количество всегда
равно n − 1, которое является суммой числа радиальных узлов
(равного n − l − 1) и числа угловых узлов (равного l).
Орбиталь –термин, специально введённый, чтобы не
говорить орбита. Орбиталь -это распределение
плотности которое даёт ур-е Шредингера.
Плотность вероятности для электрона
при различных квантовых числах (l)
43.
Рис. 2-7. Примерно такую форму в волновой модели атома имеют "областивероятности" существования электронов: s- и p-орбитали (d-орбитали имеют
более сложную форму).
44.
Радиальное распределение плотности вероятности для атомных орбиталей приразличных n и l.
45.
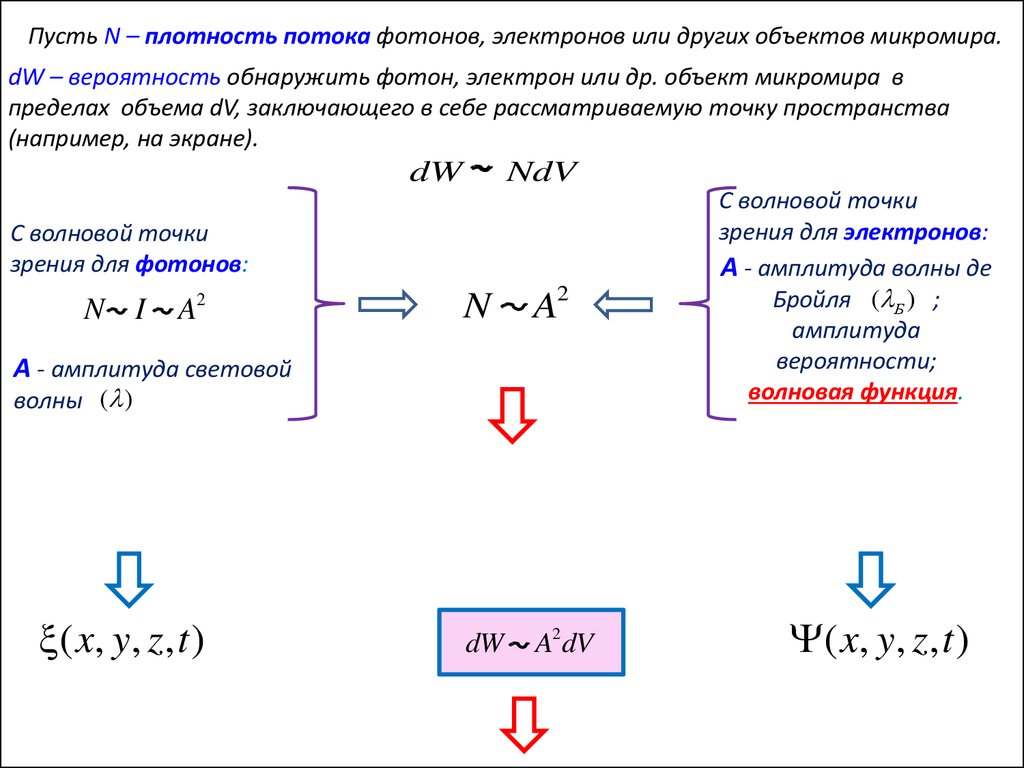
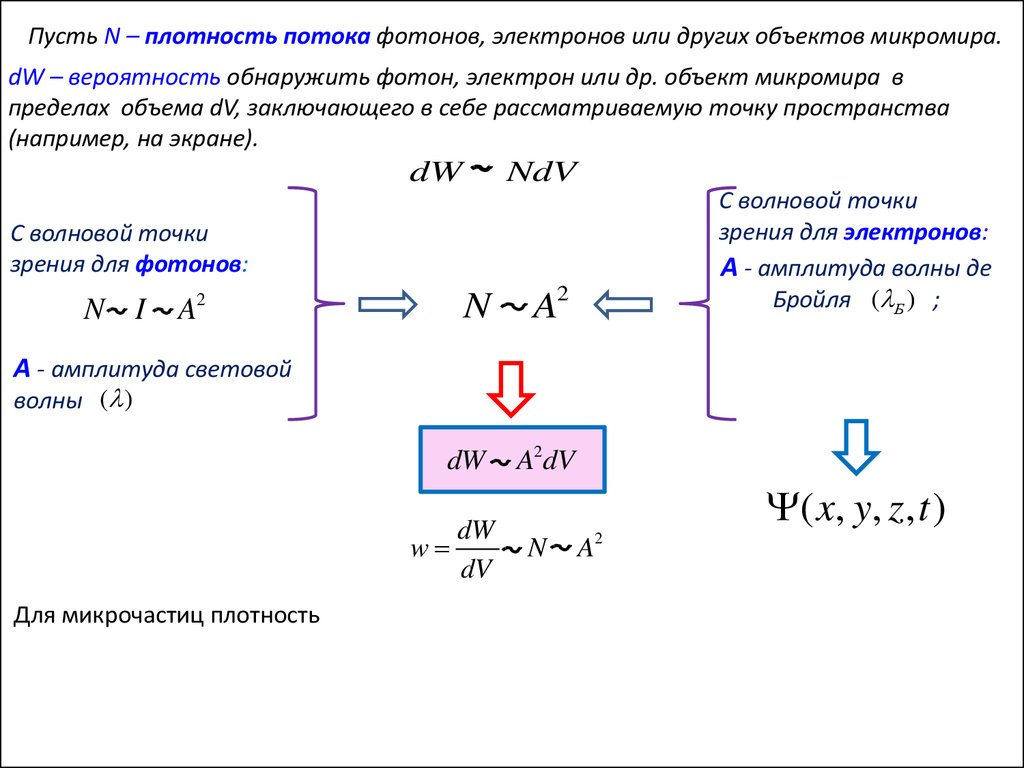
Пусть N – плотность потока фотонов, электронов или других объектов микромира.dW – вероятность обнаружить фотон, электрон или др. объект микромира в
пределах объема dV, заключающего в себе рассматриваемую точку пространства
(например, на экране).
dW
NdV
С волновой точки
зрения для фотонов:
N I
2
A
N
A2
dW
A2dV
А - амплитуда световой
волны ( )
( x, y, z, t )
С волновой точки
зрения для электронов:
А - амплитуда волны де
Бройля ( Б ) ;
амплитуда
вероятности;
волновая функция.
( x, y, z, t )
46.
Пусть N – плотность потока фотонов, электронов или других объектов микромира.dW – вероятность обнаружить фотон, электрон или др. объект микромира в
пределах объема dV, заключающего в себе рассматриваемую точку пространства
(например, на экране).
dW
NdV
С волновой точки
зрения для электронов:
А - амплитуда волны де
Бройля ( Б ) ;
С волновой точки
зрения для фотонов:
N I
2
A
N
A2
dW
A2dV
А - амплитуда световой
волны ( )
dW
w
dV
Для микрочастиц плотность
( x, y, z, t )
N
A2
47.
Плотность вероятностиw
dW
dV
N
A2
w A2
w
2
Квадрат амплитуды волны, квадрат модуля волновой функции
определяет плотность вероятности того, что фотон, электрон или
др. объект микромира будет обнаружен в рассматриваемой точке
пространства.
48.
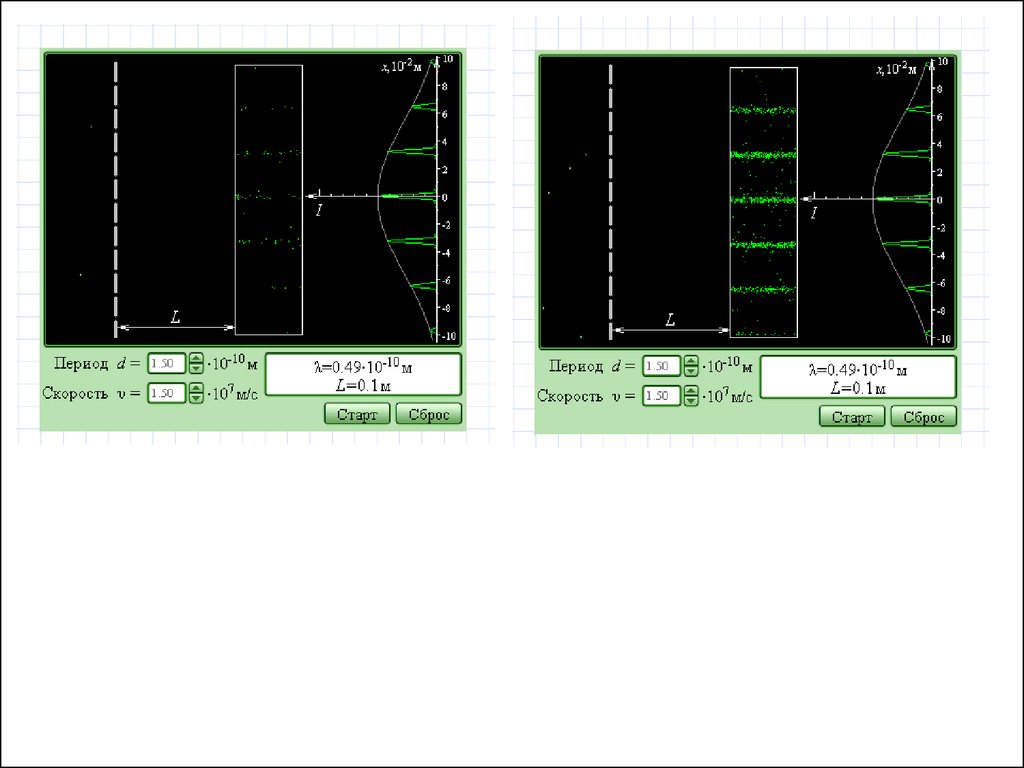
«Интерференция света на 2-х щелях»«Опыты по дифракции электронов»
Х
Монохром.
ист-к волн
Электронная
пушка
S
S1
1
S2
2
Экран
Экран
I
I I1 I 2 2 I1I 2 cos( 1 2 )
2
1
I1 a
I2
2
2
W
W W1 W2
a
Пролет эл-на через 1 или 2
не являются
несовместимыми
событиями: понятие
траектории теряет
смысл.
Х
I
a2
W
???
49.
2.Выводы. Корпускулярно-волновой дуализм объектов микромира.
1. «Волновыми» свойствами обладает
каждая частица в отдельности: ее
обнаружение в том или ином месте
пространства носит случайный
характер.
2. Закономерности, связанные с
большим числом частиц, носят
статистический, вероятностный
характер.
3. Универсальность корпускулярно-волнового дуализма
позволяет рассуждать об электронах, фотонах и других
объектах микромира с общей точки зрения и, таким
образом, понять его суть.
50.
51.
ПРИМЕР возможных «приключений» электрона, вылетевшего из катода,когда на сетке: U=+10 В
1. Электрон, не встретив на своём пути атом ртути и преодолев
задерживающую разность потенциалов 0,5 В, долетает до анода с
энергией 10- 0.5=9,5 эВ ;
или
2. Электрон неупруго взаимодействует с атомом ртути, успевает
снова ускориться и, преодолев задерживающую разность
потенциалов 0,5 В, с энергией 10-4,9-0,5 =4,6 эВ достигает анода;
или
3. Электрон неупруго взаимодействует с атомом ртути, успевает
ускориться, снова неупруго взаимодействует с другим атомом
ртути и с энергией 0,2 эВ (10-4,9-4,9=0,2 эВ) и не может преодолеть
задерживающую разность потенциалов 0,5 В.
Т.о. анодный ток уменьшается…..
52.
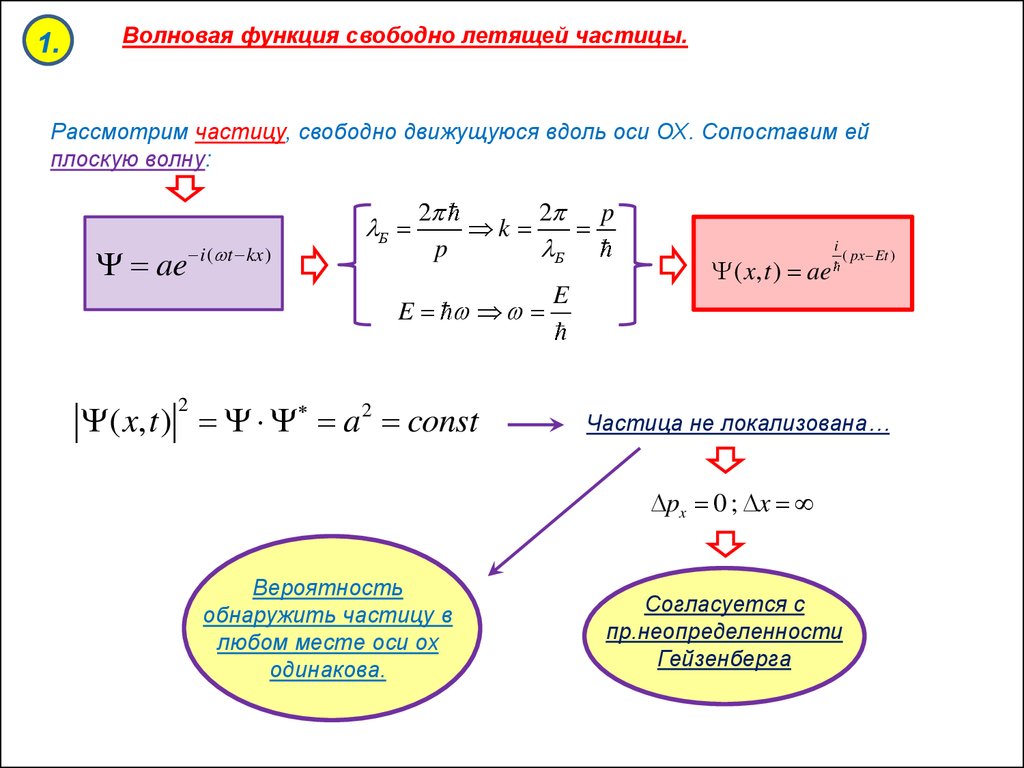
1.Волновая функция свободно летящей частицы.
Рассмотрим частицу, свободно движущуюся вдоль оси ОХ. Сопоставим ей
плоскую волну:
ae
i ( t kx )
Б
2
2 p
k
p
Б
E
( x, t ) a 2 const
2
( x, t ) ae
i
( px Et )
E
Частица не локализована…
px 0 ; x
Вероятность
обнаружить частицу в
любом месте оси ох
одинакова.
Согласуется с
пр.неопределенности
Гейзенберга
53.
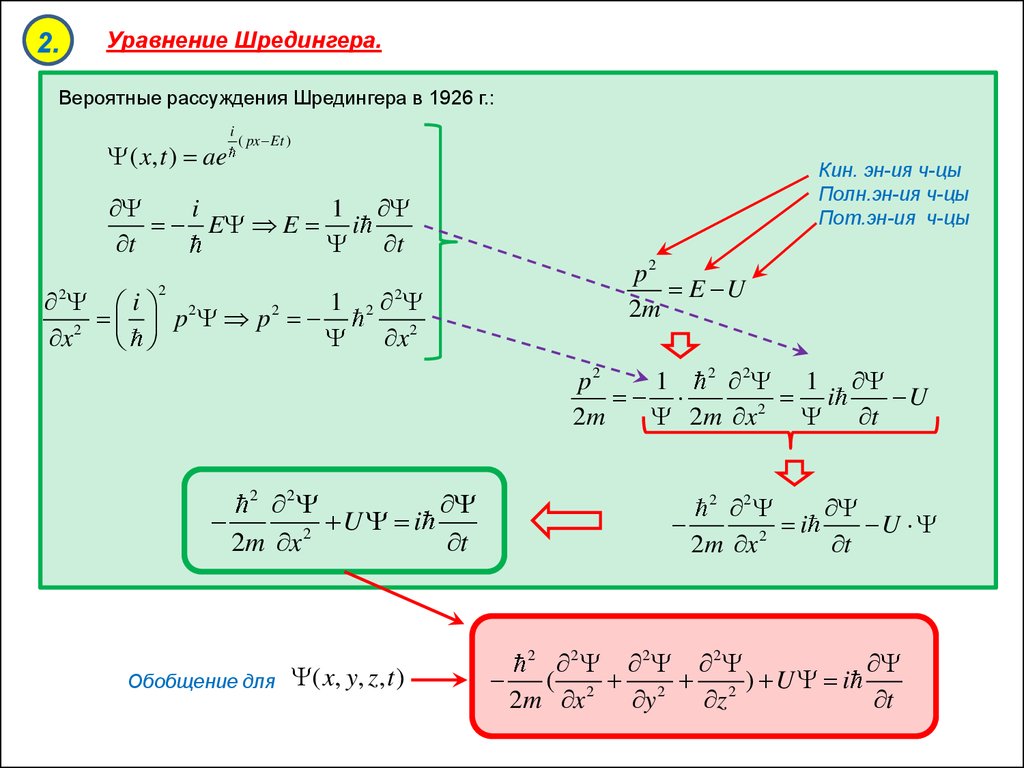
2.Уравнение Шредингера.
Вероятные рассуждения Шредингера в 1926 г.:
( x, t ) ae
i
( px Et )
Кин. эн-ия ч-цы
Полн.эн-ия ч-цы
Пот.эн-ия ч-цы
i
1
E E i
t
t
2 i 2
1
2
p
p
x 2
2
2
p2
E U
2m
2
x 2
2
p2
1
2 1
i
U
2m
2m x 2 t
2
U
i
2m x 2
t
2
Обобщение для
( x, y, z, t )
2
i
U
2
2m x
t
2
2 2 2
( 2 2 2 ) U i
2m x
y
z
t
2
54.
Должен ли диполь (магнитный или электрический) ориентироваться по полю? Пусть макроскопический диполь(постоянный магнит) с дипольным моментом p находится в пространстве, в котором в момент t=0 включается
однородное поле B, направленное по z. У диполя появляется потенциальная энергия -pzB и возникает пара сил,
которая его поворачивает в направлении поля. Диполь получает вращательное ускорение и приобретает
максимальную угловую скорость, достигая сонаправленности с полем (где энергия имеет минимум -pB) и далее
продолжает вращение, пока его потенциальная энергия не достигнет начального значения, а угловая скорость не
станет равной 0. Таким образом возникнут незатухающие вращательные колебания вокруг центра инерции, в
которых изменения проекции px и py в среднем 0, а среднее значение pz окажется больше, чем pz до включения
поля, хотя «ориентации по полю» в чистом виде нет. В частности, если в начальный момент было pz < 0 (диполь
ориентировался против поля), то хотя среднее pz станет больше начального, среднее значение pz может быть
отрицательным. Таким образом в целом при отсутствии диссипации произойдёт «поляризация» макромагнитов
(способных свободно во всех направлениях вращаться без потери энергии).
Пусть теперь включается неоднородное поле направленное по z и имеющее dB/dz. Тогда наряду с парой
сил возникнет сила действующая на центр масс (pz)срdB/dz, которая, в зависимости от начальной ориентации будет
одни магниты втягивать в область сильного поля, а другие в область слабого, однако, в силу указанной поляризации,
втягивание в область сильного поля должна преобладать.
Микро-диполи (электроны в атомах) отличаются тем, что их магнитный момент обусловлен
механическим моментом импульса. В результате при включении магнитного поля их (суммарный момент атома)
магнитный и механический моменты не колеблются, а прецессируют. В этом случае их начальная pz вообще не
меняется и никакой поляризации непосредственно при включении поля не происходит. Однако, когда
устанавливается статистическое равновесие, в соответствии с распределением Больцмана преобладает ориентация
в направлении поля, поскольку она соответствует минимальной потенциальной энергии и, соответственно, какие-то
механизмы (столкновения?) приводят всё таки к поляризации (теория парамагнетизма, Ланжевен-Сивухин) и
парамагнетики втягиваются в область сильного поля! Но в атомных пучках нет столкновений, равновесие в
магнитном поле не устанавливается, соответственно распределение ориентаций остаётся начальным и пучок
парамагнитных атомов в неоднородном поле не смещается, а симметрично уширяется.
55.
Почему парамагнетики втягиваются в область сильного магнитного поля, а от пучкапарамагнитных атомов в опыте Штерна-Герлаха классическая физика ожидает лишь
уширения, но не отклонения? Т.е. по кл. физике парамагнитные атомы должны
равновероятно как втягиваться в сильное магн поле , так и выталкиваться из него.
Потому, что механический/магнитный момент атома, согласно классис физике,
при включении поля начинает прецессировать вокруг направления поля, но отнюдь при
этом не ориентироваться по полю. Ориентация по полю (поляризация) парамагнетиков
происходит лишь при установлении статистического равновесия вследствие того, что при
этом потенциальная энергия минимальна и в соответствии с распределением Больцмана
(Ланжевен-Сивухин, парамагнетики), а механизм установления равновесия, по-видимому
столкновительный (когда возможно изменение момента импульса). Но в пучках нет
столкновений, новое равновесие в магнитном поле не устанавливается и поляризация не
происходит).
\







































 Физика
Физика








