Похожие презентации:
Металлическая и водородная связь
1.
МЕТАЛЛИЧЕСКАЯИ
ВОДОРОДНАЯ СВЯЗЬ
2.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬАтомы большинства металлов на внешнем
энергетическом уровне содержат небольшое
число электронов и значительно больше
свободных орбиталей. Поэтому электроны
могут переходить из одной орбитали в другую.
Тем самым электроны принимают участие в
образовании связи между всеми атомами
кристалла металла.
3.
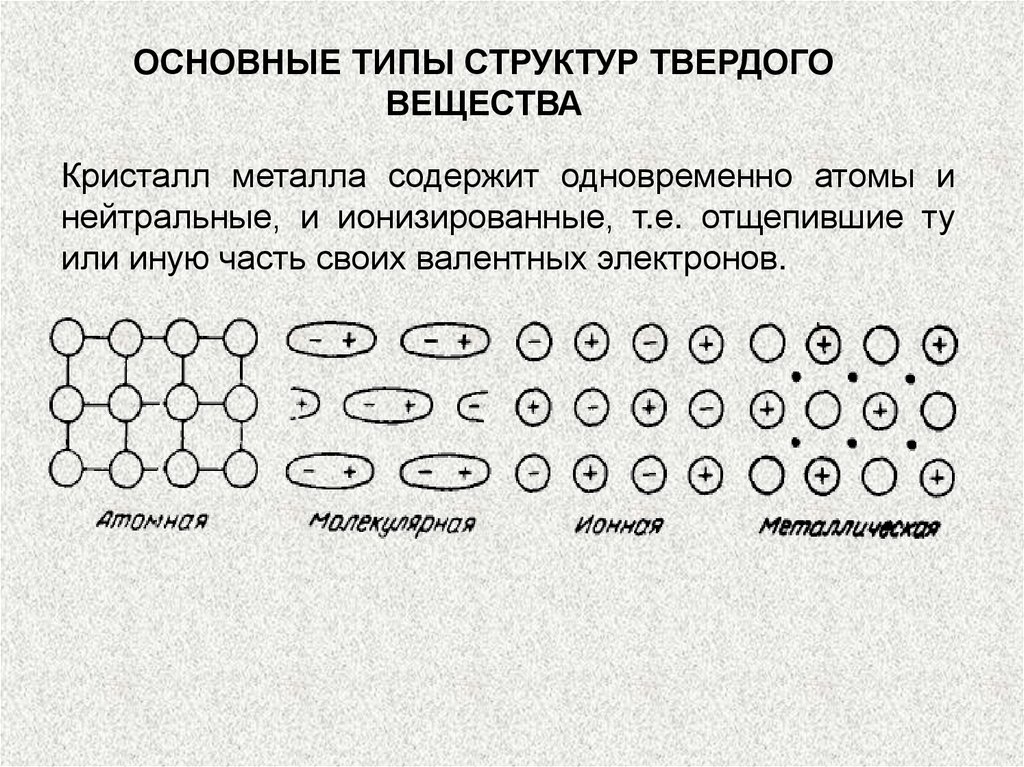
ОСНОВНЫЕ ТИПЫ СТРУКТУР ТВЕРДОГОВЕЩЕСТВА
Кристалл металла содержит одновременно атомы и
нейтральные, и ионизированные, т.е. отщепившие ту
или иную часть своих валентных электронов.
4.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬОбразование молекулярных орбиталей из атомных
Таким образом, в отличие от ковалентных и
ионных соединений в металлах небольшое
число электронов одновременно связывает
большое число атомных ядер, а сами электроны
могут перемещаться в металле.
Иначе говоря, в металлах имеет место
сильно делокализованная химическая связь
5.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬПри взаимодействии двух одинаковых атомов
вместо двух энергетически равноценных исходых
АО образуются две молекулярные орбитали,
отвечающие разным уровням энергии. Если
взаимодействуют три атома, причем их валентные
орбитали заметно перекрываются, то возникают
три МО, принадлежащие всем трем атомам
(делокализованные орбитали) и характеризующиеся тремя различными уровнями энергии.
6.
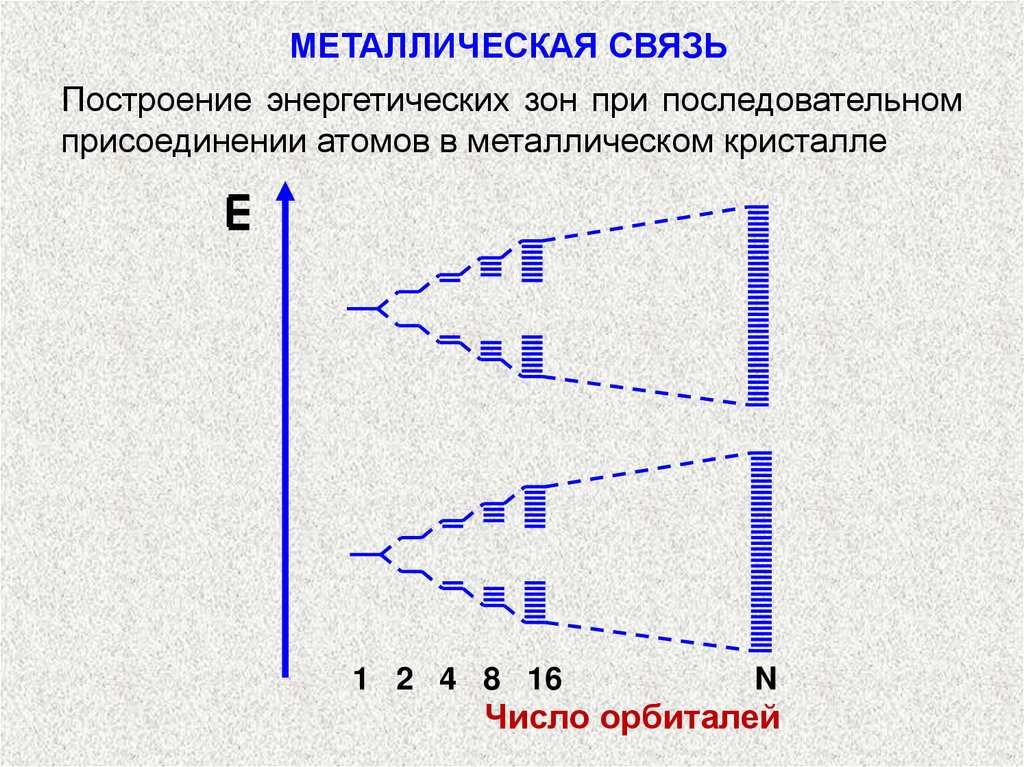
МЕТАЛЛИЧЕСКАЯ СВЯЗЬОбразование молекулярных орбиталей из атомных
При последовательном увеличении числа взаимодействующих атомов добавление каждого из них
приводит к образованию еще одного энергетического
уровня и к дальнейшей делокализации молекулярных орбиталей (т. е. к распространению их на
большее число атомов);
Общее число энергетических уровней будет при этом
равно числу взаимодействующих атомов. Схема
подобного процecca представлена на след. рис.
7.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬПостроение энергетических зон при последовательном
присоединении атомов в металлическом кристалле
1 2 4 8 16
N
Число орбиталей
8.
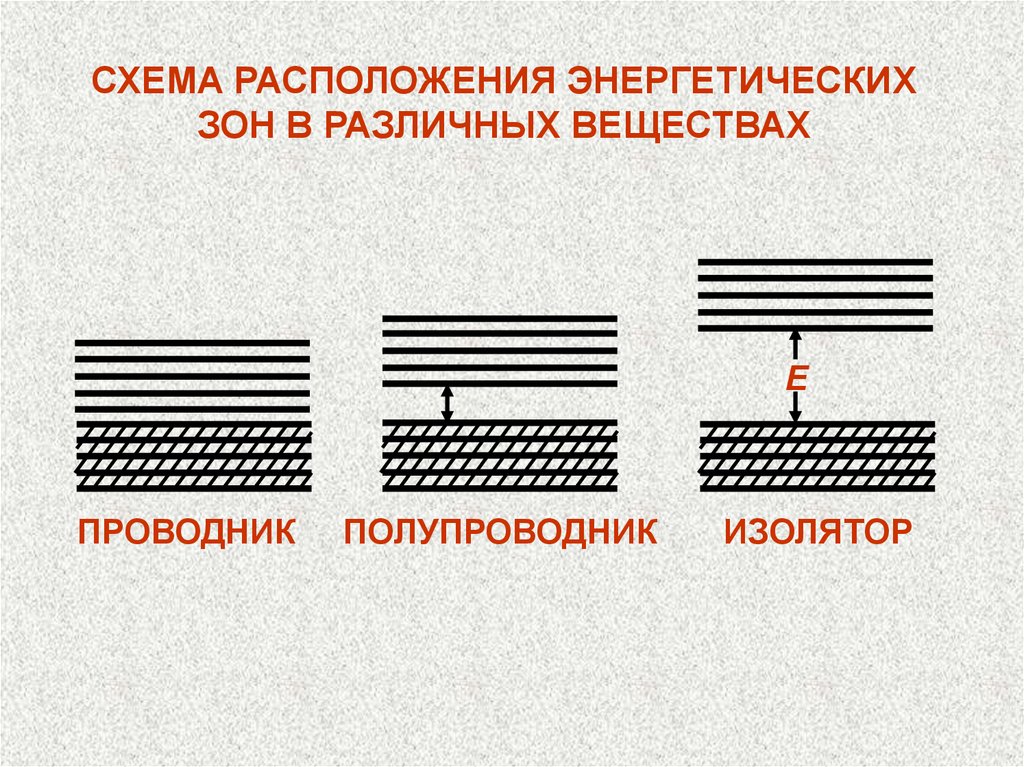
СХЕМА РАСПОЛОЖЕНИЯ ЭНЕРГЕТИЧЕСКИХЗОН В РАЗЛИЧНЫХ ВЕЩЕСТВАХ
Е
ПРОВОДНИК
ПОЛУПРОВОДНИК
ИЗОЛЯТОР
9.
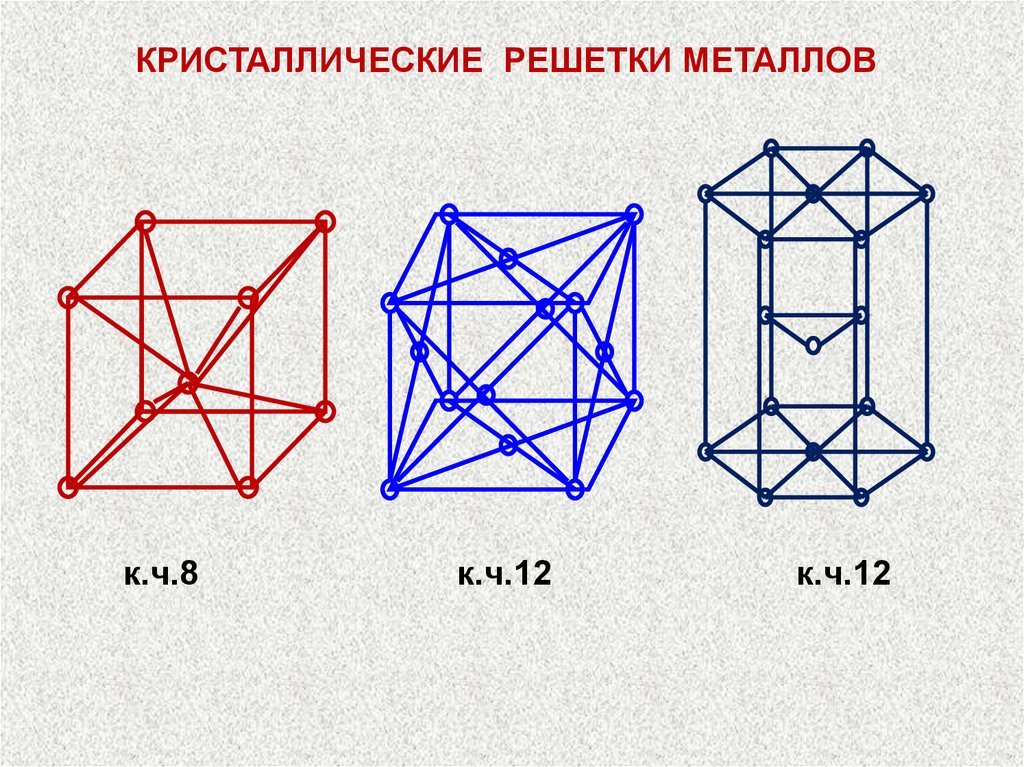
КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ МЕТАЛЛОВк.ч.8
к.ч.12
к.ч.12
10.
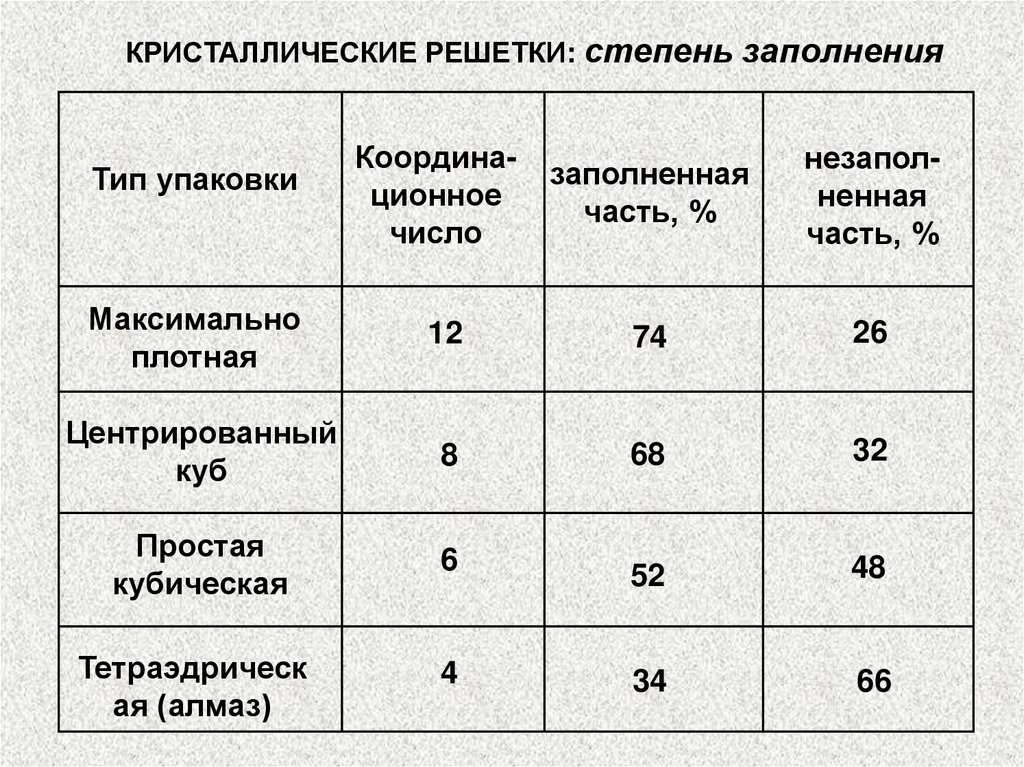
КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ: степень заполненияКоординационное
число
заполненная
часть, %
незаполненная
часть, %
Максимально
плотная
12
74
26
Центрированный
куб
8
68
32
Простая
кубическая
6
52
48
Тетраэдрическ
ая (алмаз)
4
34
66
Тип упаковки
11.
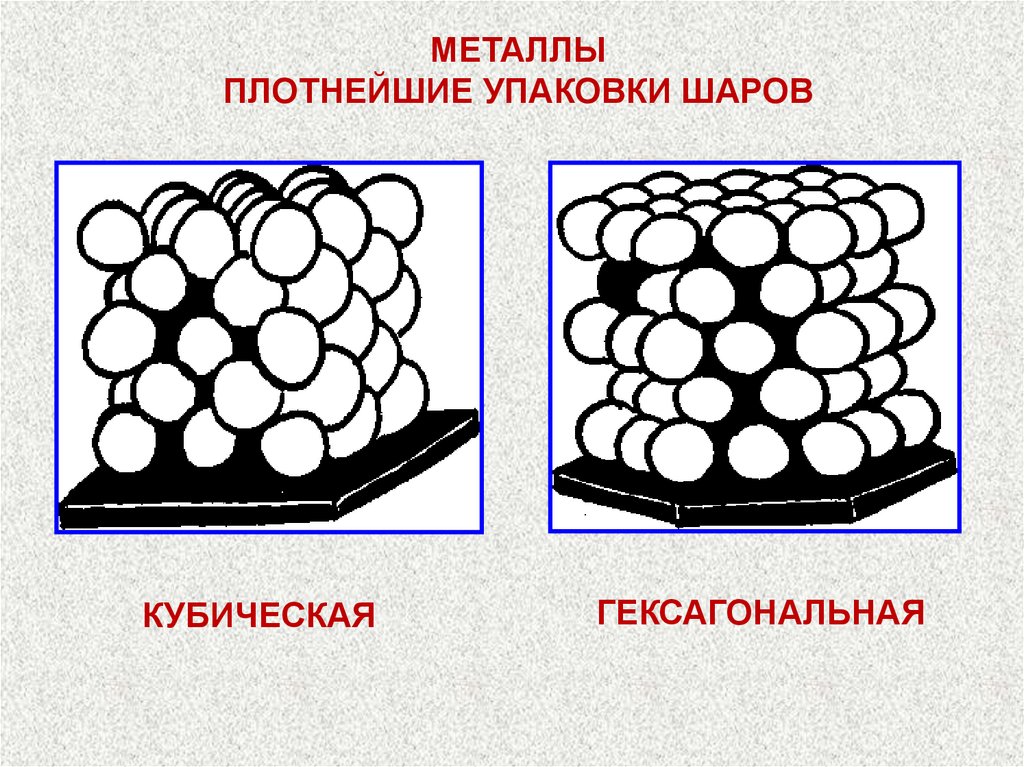
МЕТАЛЛЫПЛОТНЕЙШИЕ УПАКОВКИ ШАРОВ
КУБИЧЕСКАЯ
ГЕКСАГОНАЛЬНАЯ
12.
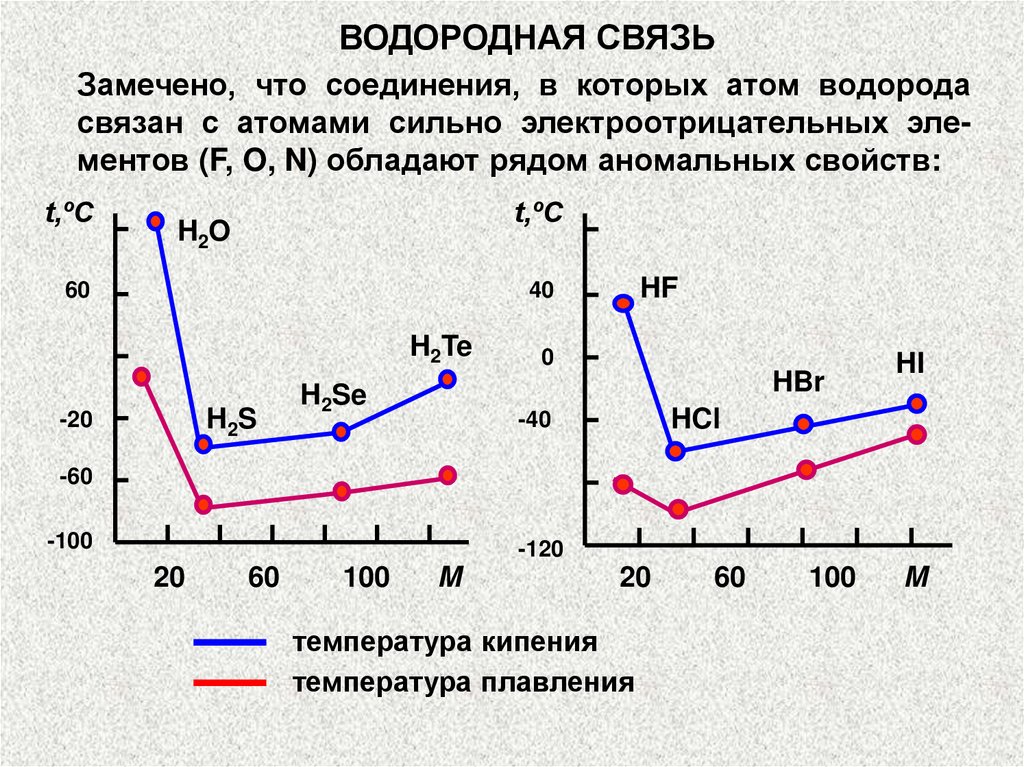
ВОДОРОДНАЯ СВЯЗЬЗамечено, что соединения, в которых атом водорода
связан с атомами сильно электроотрицательных элементов (F, O, N) обладают рядом аномальных свойств:
t,ºC
t,ºC
H 2O
60
HF
40
H2Te
H 2S
-20
0
HBr
H2Se
HI
HCl
-40
-60
-100
-120
20
60
100
M
20
температура кипения
температура плавления
60
100
M
13.
ВОДОРОДНАЯ СВЯЗЬВодородная связь – своеобразный гибрид электростатического
и
донорно-акцепторного
взаимодействий. Ее возникновение обязано ничтожно малому
размеру иона (H+), способного внедряться в электронную
оболочку соседнего (ковалентно с ним не связанного)
атома.
δδ+
.. δ-
δ+
.. δ-
δ+
..
δ-
H – F: - - - H – F: - - - H – F:
··
нп
··
водородная связь
··
δ+
δ-
δ+
14.
ТИП ХИМИЧЕСКОЙ СВЯЗИ, СТРУКТУРАИ ФИЗИЧЕСКИЕ СВОЙСТВА
Общий вывод заключается в следующем:
Металлы и ионные соединения существуют в виде
кристаллов с координационной решеткой из
одинаковых химических связей.
Простые вещества и соединения с ковалентным
типом связи существуют в виде молекулярных
кристаллов, где молекулы связаны между собой
слабыми межмолекулярными силами, либо в виде
координационных ковалентных кристаллов, которые
можно рассматривать как гигантские молекулы –
макромолекулы.
15.
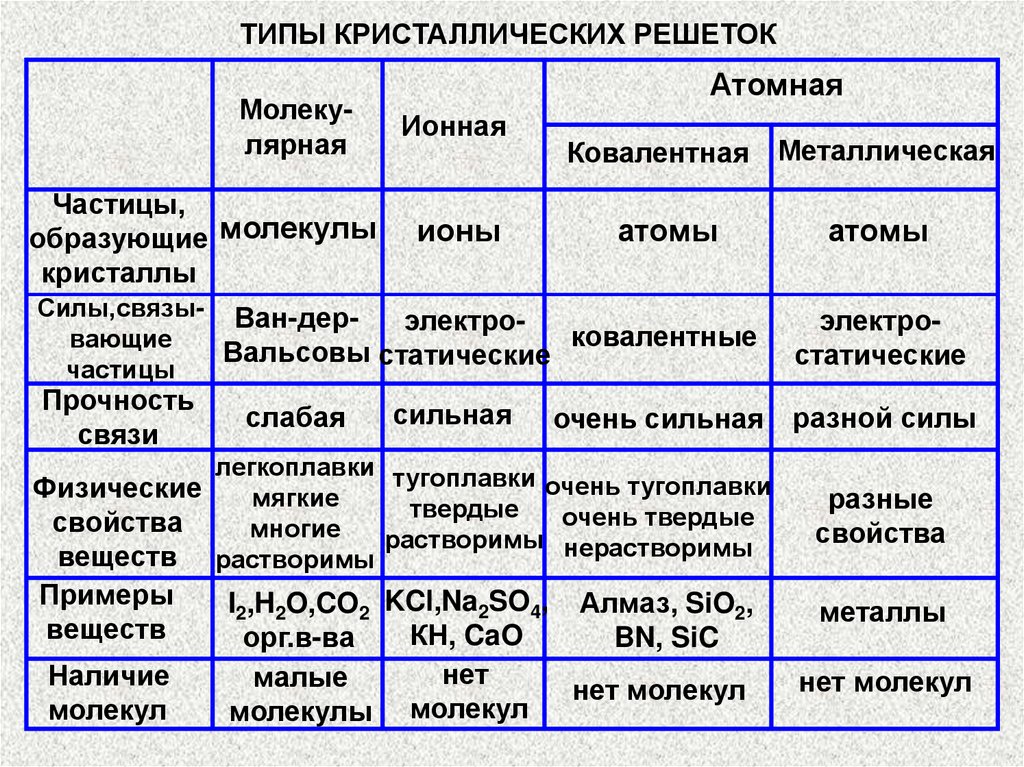
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОКМолекулярная
Частицы,
образующие молекулы
кристаллы
Атомная
Ионная
ионы
Ковалентная Металлическая
атомы
Силы,связы- Ван-дерэлектроковалентные
вающие
Вальсовы статические
частицы
Прочность
связи
слабая
сильная
атомы
электростатические
очень сильная разной силы
легкоплавки тугоплавки
очень тугоплавки
Физические
мягкие
твердые
очень твердые
свойства
многие
растворимы нерастворимы
веществ растворимы
разные
свойства
Примеры
веществ
металлы
Наличие
молекул
I2,H2O,CO2 KCl,Na2SO4, Алмаз, SiO2,
КН, CaO
орг.в-ва
BN, SiC
нет
малые
нет молекул
молекулы молекул
нет молекул
16.
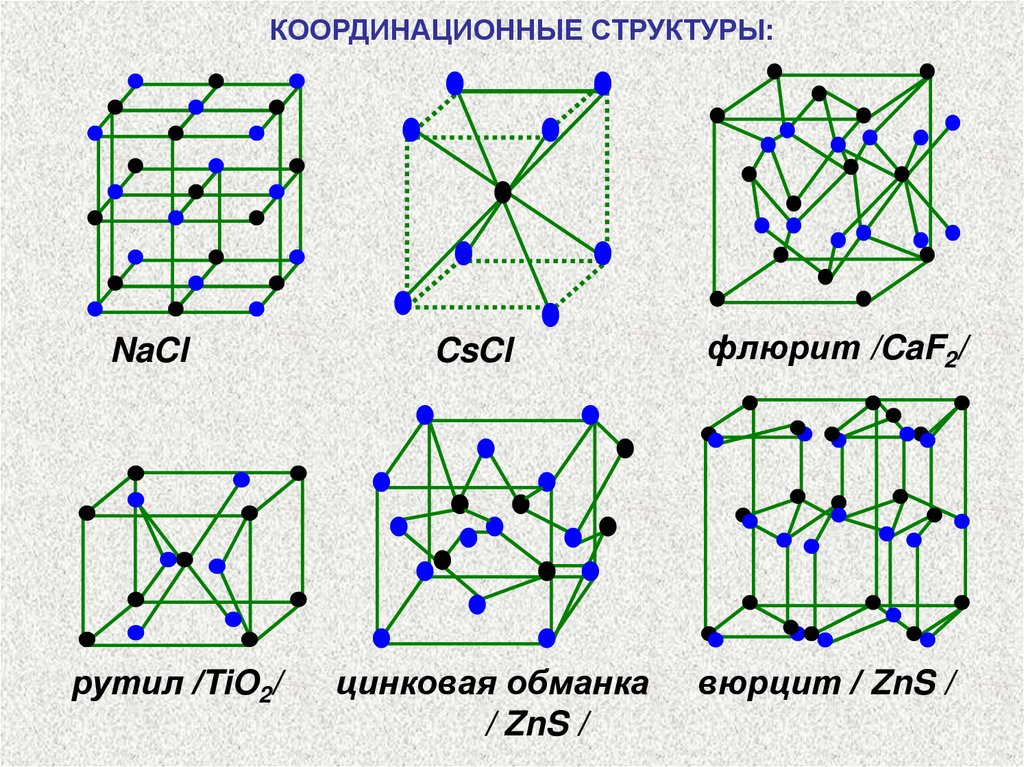
КООРДИНАЦИОННЫЕ СТРУКТУРЫ:NaCl
рутил /TiO2/
CsCl
цинковая обманка
/ ZnS /
флюрит /CaF2/
вюрцит / ZnS /
17.
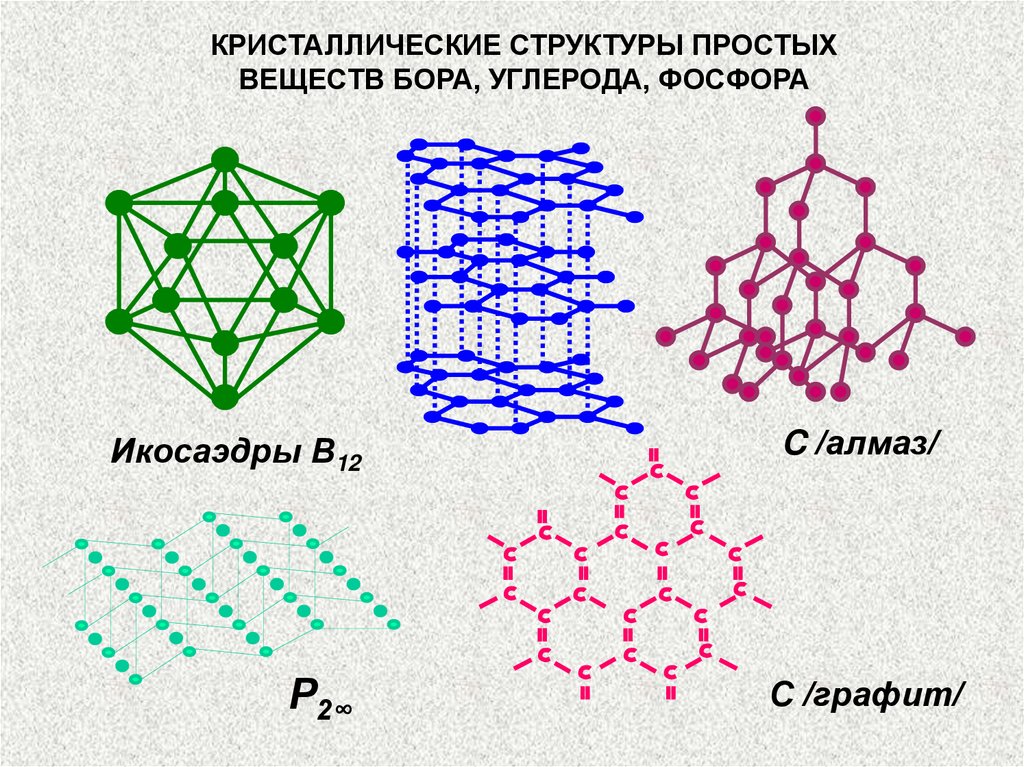
КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ ПРОСТЫХВЕЩЕСТВ БОРА, УГЛЕРОДА, ФОСФОРА
Икосаэдры В12
Р2∞
C /алмаз/
С /графит/







 Химия
Химия








