Похожие презентации:
Стехиометрия. Стехиометрические расчеты
1.
СТЕХИОМЕТРИЯ.Стехиометрические расчеты
2.
СТЕХИОМЕТРИЯСтехиометрия – раздел химии, который
изучает состав химических соединений и
количественные изменения в ходе химических
превращений.
В ходе химической реакции количества,
массы всех веществ (реагентов и продуктов)
изменяются в строго определенных для данной
реакции отношениях, которые называют
стехиометрическими соотношениями.
3.
Стехиометрическиекоэффициенты.
Количественное (молярное) отношение
веществ, участвующих в реакции, равно
отношению коэффициентов при формулах
веществ в уравнении химической реакции.
Эти коэффициенты называют стехиометрическими коэффициентами.
4.
Стехиометрические расчетыПусть имеется химическое уравнение общего вида:
k1X1 + k2X2 = k3X3 + k4X4 + …
k1 : k2 : k3 :
k4
стехиометрические коэф-ты;
молярное отношение;
объемное отношение (при
одинаковых значениях Р и Т).
Если в задаче известно количество (или объем) одного из
веществ, вступившего в реакцию или полученного в ходе
реакции, то количества других участников реакции легко
вычислить из молярных отношений:
1(X1) : 2(X2) : 3(X3) : 4(X4) = k1 : k2 : k3 : k4
5.
СООТНОШЕНИЕ МАСССоотношение масс реагирующих веществ не равно
отношению стехиометрических коэффициентов, но
его можно рассчитать, умножив молярную массу
каждого вещества на его стехиометрический
коэффициент:
m1 : m2 : m3 : m4 = k1М(Х1): k2М(Х2): k3М(Х3) : k4М(Х4)
6.
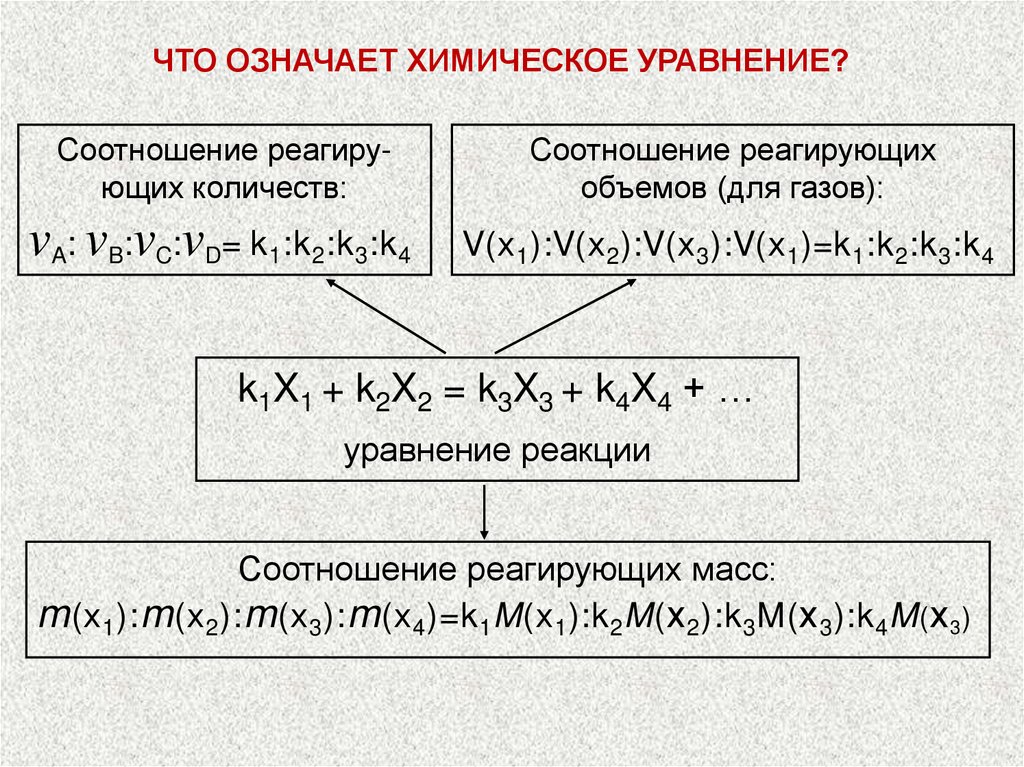
ЧТО ОЗНАЧАЕТ ХИМИЧЕСКОЕ УРАВНЕНИЕ?Соотношение реагирующих количеств:
Соотношение реагирующих
объемов (для газов):
vA: vB:vC:vD= k1:k2:k3:k4
V(х 1 ):V(х 2 ):V(х 3 ):V(х 1 )=k 1 :k 2 :k 3 :k 4
k1X1 + k2X2 = k3X3 + k4X4 + …
уравнение реакции
Соотношение реагирующих масс:
m (х 1): m (х 2): m (х 3): m (х 4)=k 1M(х 1):k 2M( х 2):k 3M( х 3):k 4M ( х 3)
7.
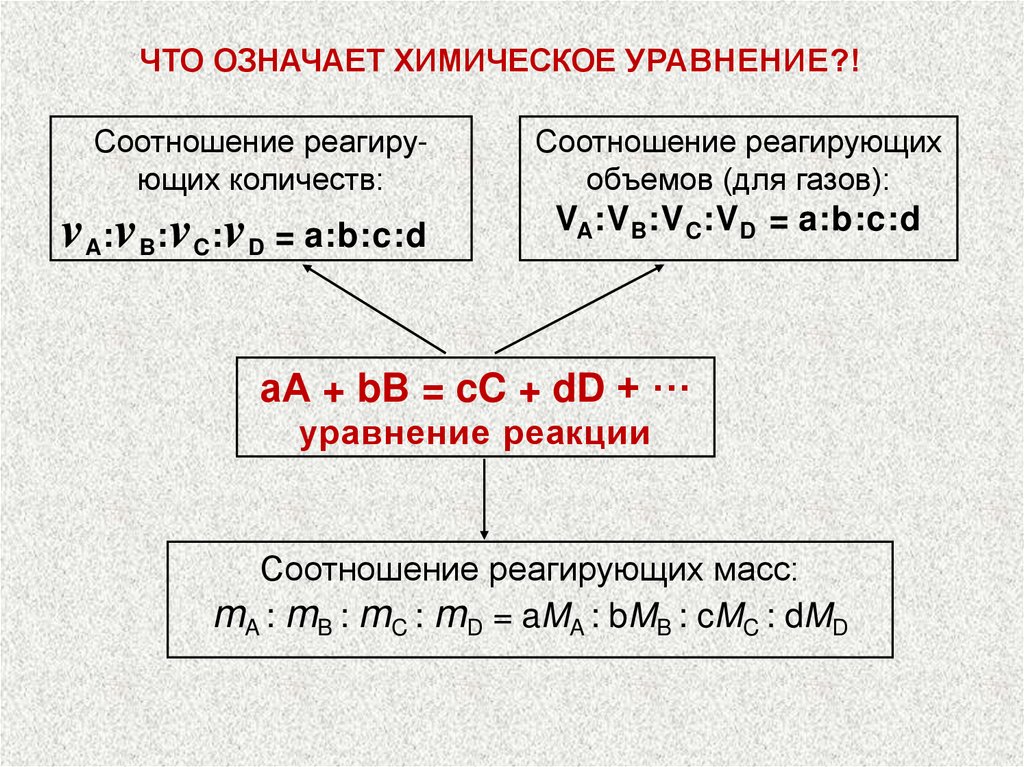
ЧТО ОЗНАЧАЕТ ХИМИЧЕСКОЕ УРАВНЕНИЕ?!Соотношение реагирующих количеств:
vA:vB:vC:vD = a:b:c:d
Соотношение реагирующих
объемов (для газов):
VA:V B:V C:V D = a:b:c:d
аА + bB = cC + dD + ···
уравнение реакции
Соотношение реагирующих масс:
mA : mB : mC : mD = aMA : bMB : cMC : dMD
8.
КОЛИЧЕСТВО ВЕЩЕСТВА ( , моль)Количество вещества ( , моль) – физическая
величина, определяемая числом структурных единиц
(частиц), из которых состоит данное вещество
(молекул, атомов, ионов, электронов и др.). Единицей
количества вещества является моль.
Моль – количество вещества, включающее число
структурных единиц (реальных или условных частиц),
равное числу атомов углерода в 12 г вещества,
состоящего только из изотопов 12С.
9.
Постоянная АвогадроЧисло структурных единиц, содержащихся в 1
моле вещества (число Авогадро) равно:
NA = 6,02 1023 моль-1
Формулы для вычисления
количества вещества:
m
;
M
V0
0;
Vm
PV
;
RT
10.
МОЛЯРНЫЙ ОБЪЕМ ГАЗА(Vm, дм3/моль или л/моль)
Молярный объем газа (Vm, л/моль) – объем одного
моля газа.
При нормальных условиях молярный объем равен
Vm0 = 22,4 л/моль
Нормальные условия (н.у.):
Р = 101325 Па (760 мм рт. ст., 1 атм);
Т = 273 К (0оС)
11.
УРАВНЕНИЕКЛАЙПЕРОНА-МЕНДЕЛЕЕВА:
PV = RT
Единицы измерения в системе СИ:
Р(Па), V(м3), (моль), Т(К),
R = 8,31 [Дж/(моль К)].
12.
ПРИМЕР 1.2NO + O2 = 2NO2
2 : 1 : 2 – стехиометрические коэффициенты;
молярное отношение;
объемное отношение (при одинаковых значениях Р и Т).
Если в задаче известно количество (или объем) одного из
веществ, вступившего в реакцию или полученного в ходе
реакции, то количества других участников реакции легко
вычислить из молярных отношений:
(NO): (O2) = 2:1;
(NO): (NO2) = 2:2 =1:1;
(O2): (NO2)= 1:2.
13.
ПРИМЕР 2. Вычисление количественных (молярных)отношений веществ, участвующих в двух и более
химических реакциях.
Предположим, что в результате реакции раствора
соли FeCl3 с водным раствором аммиака NH3 H2O
ионы Fe3+ количественно (полностью) осадили в виде
труднорастворимого гидроксида Fe(OH)3, который
затем отфильтровали, прокалили и полученный оксид
Fe2O3 взвесили.
Требуется рассчитать массу FeCl3 в исходном
растворе.
14.
ПРИМЕР 2 (продолжение)Для решения задачи необходимо знать молярное
отношение, в котором находятся в процессе реакции
два вещества FeCl3 и Fe2O3. Для этого не обязательно
составлять уравнения реакций.
Это может быть выражено следующей стехиометрической схемой:
2FeCl3 Fe2O3 (число атомов железа равно).
Далее алгоритм решения задачи таков:
а) расчет ( Fe2O3);
( Fe2O3) = m(Fe2O3):M(Fe2O3);
б) расчет ( FeCl3);
( FeCl3) : ( Fe2O3) = 2:1;
( FeCl3) = 2 ( Fe2O3);
в) расчет m(FeCl3);
m(FeCl3) = ( FeCl3) M(FeCl3).
15.
ПРИМЕР 3Навеску металла цинка массой 2,62 г поместили в колбу
и добавили 200 мл 0,3 М раствора соляной кислоты.
1) Какое из веществ и в каком количестве не прореагирует полностью?
2) Какой объем займет выделившийся в ходе реакции
газ при нормальных условиях?
3) Какова молярность соли в растворе после реакции,
если раствор разбавили дистиллированной водой до
конечного объема 500 мл?
16.
Решение 3.Во многих случаях очень удобной формой записи решения
задачи является таблица под уравнением реакции:
Zn + 2HCl = ZnCl2 + H2
1
:
2
:
1
:
1
- молярное отношение;
0
- исход. количества, моль
0,04
0,06
0
0,03
0,06
0,03
0,03 - Прореагировало (образовалось) в ходе реакции, моль
0,01
0
0,03
0,03 - Конечные колич-ва, моль
Сисх = С + Скон
Расчет исходных количеств цинка и хлороводорода:
(Zn) = m/M = 2,62/65,4 = 0,04 моль;
(HCl) = C V = 0,3 0,2 = 0,06 моль
17.
Решение 3 (продолжение)Итак, окончательные ответы на вопросы задачи:
а) металл цинк взят в избыточном количестве,
равном 0,04 – 0,03 = 0,01 моль;
б) выделившийся газ водород в количестве 0,03 моль
будет занимать объем при нормальных условиях,
равный V0 = (H2) Vm0 = 0,03 22,4 = 0,672 л;
в) образовавшаяся соль ZnCl2 находится в растворе,
конечный объем которого 500 мл или 0,5 л. Тогда
молярная концентрация соли С = /V = 0,03/0,5 = 0,06
моль/л или 0,06 М.
18.
ПРИМЕР 4В сосуд вместимостью 40 л поместили два газа SO2 и О2.
Исходные объемы газов, измеренные при нормальных
условиях, следующие: V0(SO2) = 5л; V0(O2) = 15л. В
результате реакции прореагировало 40% SO2, и в сосуде
установилось давление 111,3 кПа. Какова температура
газовой смеси в сосуде? Какова молярная доля SO2 до и
после реакции?
19.
Решение 4. Задачу можно решать, используя объемыгазов при одинаковых условиях. В данной задаче удобно
взять нормальные условия (н.у.).
2SO2 + O2 = 2SO3
2
:
1
:
2
- молярное и объемное отношения;
5
15
0
- исход. объемы, л (н.у.)
?
?
?
- изменение объемов в ходе реакции,
л (н.у.)
?
?
?
- конечные объемы, л (н.у.)
По условию задачи прореагировало 40% SO2, что
составит 5 0,4 = 2 л; из объемного отношения, что
кислорода прореагирует в 2 раза меньше, т.е. 1л.
объем образующегося SO3 равен объему SO2 , т.е. 2л.
20.
Решение 4. Задачу можно решать, используя объемыгазов при одинаковых условиях. В данной задаче удобно
взять нормальные условия (н.у.).
2SO2 + O2 = 2SO3
2
:
1
:
2
- молярное и объемное отношения;
5
15
0
- исход. объемы, л (н.у.)
2
1
2
- изменение объемов в ходе реакции,
л (н.у.)
3
14
2
- конечные объемы, л (н.у.)
По условию задачи прореагировало 40% SO2, что
составит 5 0,4 = 2 л; из объемного отношения, что
кислорода прореагирует в 2 раза меньше, т.е. 1л.
объем образующегося SO3 равен объему SO2 , т.е. 2л.
21.
Решение 4. Теперь можно рассчитать количество каждогогаза или их сумму:
V 0 (SO2, O2, SO3) = 3 + 14 + 2 = 19 л;
T = PV/(R ) = 111,3 103 40 10-3/(8,31 0,85) =
630,3 К (или 357,30С);
Молярная доля XM:
XM(SO2) = XV = 5 л/(5+15) л = 0,25 (или 25%) –
до реакции;
XM(SO2) = XV = 3 л/(3+14+2) л = 0,16 (или 16%)
– после реакции.



















 Химия
Химия








