Похожие презентации:
Химические эквиваленты простых и сложных веществ
1. ХИМИЧЕСКИЕ ЭКВИВАЛЕНТЫ ПРОСТЫХ И СЛОЖНЫХ ВЕЩЕСТВ
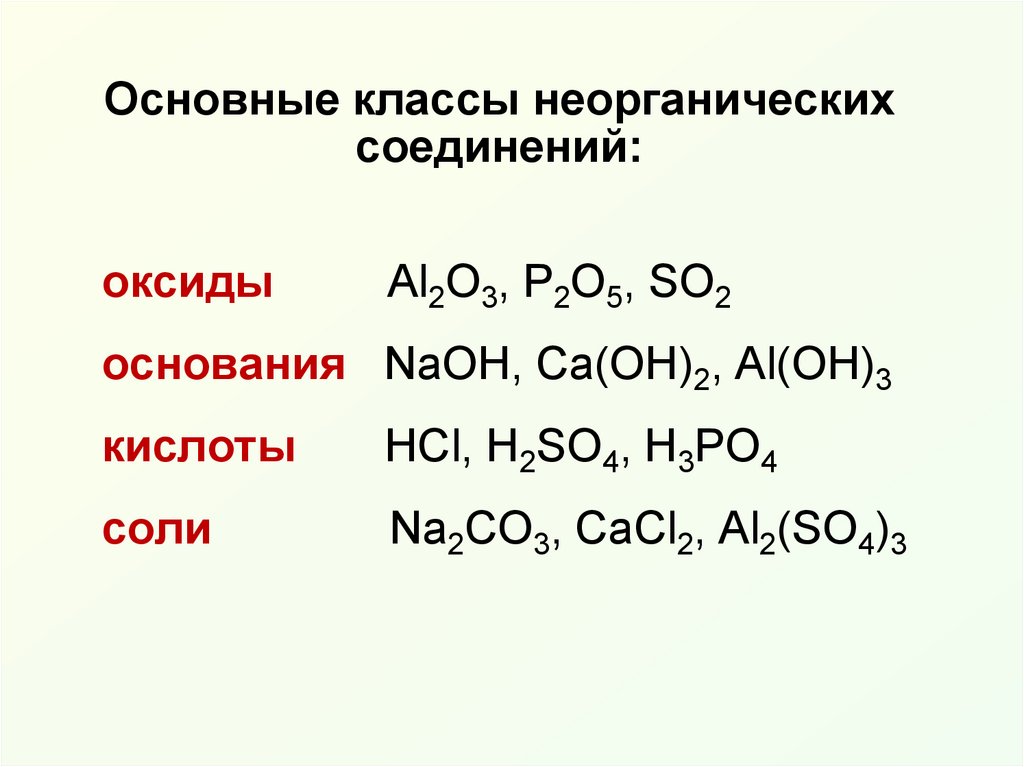
2. Основные классы неорганических соединений:
оксидыAl2O3, Р2O5, SO2
основания NaOH, Ca(OH)2, Al(OH)3
кислоты
HCl, H2SO4, H3РO4
соли
Na2CO3, CaCl2, Al2(SO4)3
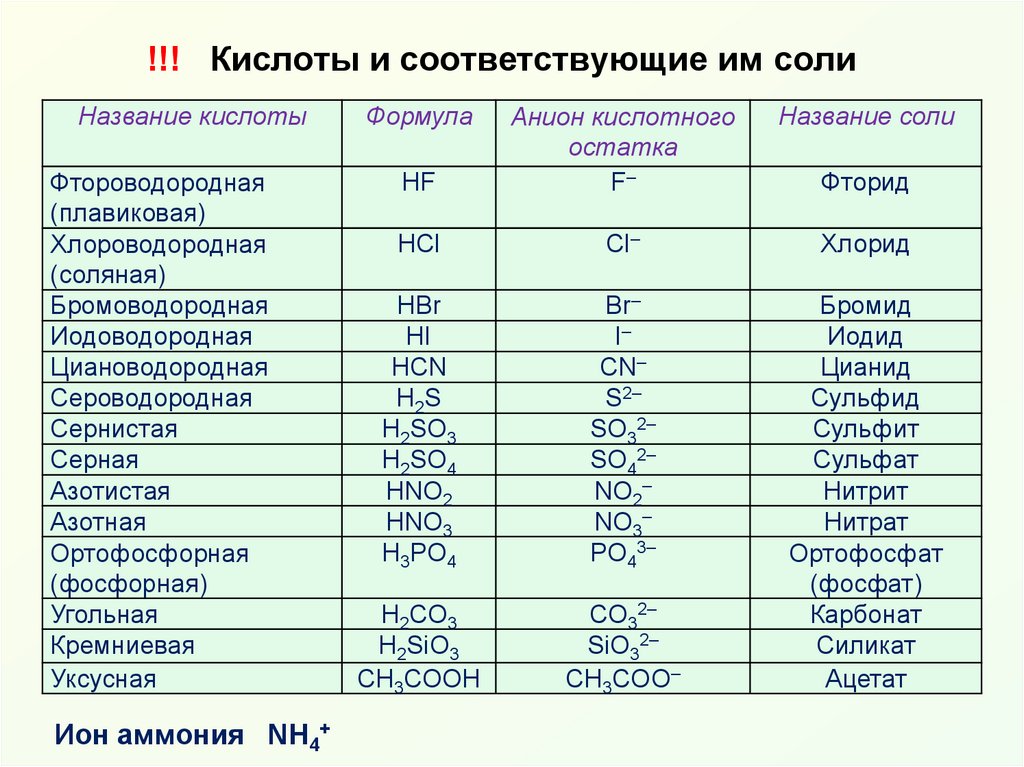
3. !!! Кислоты и соответствующие им соли
Название кислотыФтороводородная
(плавиковая)
Хлороводородная
(соляная)
Бромоводородная
Иодоводородная
Циановодородная
Сероводородная
Сернистая
Серная
Азотистая
Азотная
Ортофосфорная
(фосфорная)
Угольная
Кремниевая
Уксусная
Ион аммония NH4+
Формула
Название соли
HF
Анион кислотного
остатка
F–
HCl
Cl–
Хлорид
HBr
HI
HCN
H2S
H2SO3
H2SO4
HNO2
HNO3
H3PO4
Br–
I–
СN–
S2–
SO32–
SO42–
NO2–
NO3–
PO43–
H2CO3
H2SiO3
CH3COOH
CO32–
SiO32–
CH3COO–
Бромид
Иодид
Цианид
Сульфид
Сульфит
Сульфат
Нитрит
Нитрат
Ортофосфат
(фосфат)
Карбонат
Силикат
Ацетат
Фторид
4. ОСНОВНЫЕ ПОНЯТИЯ
Раздел химии, изучающий количественныйсостав
веществ
и
количественные
соотношения (массовые, объемные) между
реагирующими
веществами,
называется
стехиометрией.
Расчеты количественных соотношений
между элементами в соединениях или между
веществами
в
химических
реакциях
называются
стехиометрическими,
а
коэффициенты перед формулами веществ в
уравнениях реакций – стехиометрическими
коэффициентами.
5.
Уравнение химической реакции — это условнаязапись химической реакции при помощи химических
формул.
Химическая формула — это условная запись,
отражающая качественный и количественный состав
вещества.
2H2 O2 2H2O
исходные в-ва
реагирующие
продукты р-ции
вещества
2,1,2 — стехиометрические коэффициенты в
уравнении реакции – показывают молярные
соотношения между исходными веществами и
продуктами реакции.
6.
Для выполнения стехиометрических расчетов нарядус единицами массы и объема в химии используют физическую величину количество вещества.
Количество вещества n –
размерная физическая величина,
определяемая числом
содержащихся в этом веществе
структурных частиц (атомов,
молекул, ионов, электронов).
Единица количества вещества – моль.
7.
Моль – количество вещества, вкотором содержится число частиц
любого вида (атомов, молекул,
ионов), равное числу Авогадро
NA = 6,02 ∙1023 моль-1.
При использовании термина «моль»
следует указывать частицы, к которым
относится
этот
термин:
«моль
молекул», «моль атомов» и т.д.
8.
Молярная массаM – масса
1 моля вещества (или масса
6,02∙1023 частиц вещества).
Равна отношению массы вещества
m к количеству вещества n:
m
М= ,
n
г/моль.
9.
Молярный объем VМ – это объем, которыйзанимает один моль любого газа
(6,02∙1023
молекул)
при
нормальных
условиях. Равен отношению объема газа V0
при н.у. к количеству вещества n:
V0 , л/моль.
VM =
n
!!!
VМ = 22,4 л/моль.
Н.у. для газов:
Р0 = 1 атм = 101,325 кПа = 760 мм рт. ст.
Т0 = 0оС = 273 K
10. Для приведения объема газа к нормальным условиям используют уравнение состояния идеального газа:
ЛР 1,опыт
№1
Для приведения объема газа к нормальным
условиям
используют
уравнение
состояния идеального газа:
P V P0 V0
,
T
T0
или
P V T0
V0
,
T P0
где V – объем газа, измеренный при
реальных условиях, т. е. при атмосферном
давлении Р и температуре Т;
V0 – объем газа при нормальном давлении
Р0 и температуре Т0 .
Т (K) = t (оС) + 273
11. эквивалент и эквивалентнАЯ массА ПРОСТЫХ И СЛОЖНЫХ ВЕЩЕСТВ
ЭКВИВАЛЕНТ И ЭКВИВАЛЕНТНАЯМАССА ПРОСТЫХ И СЛОЖНЫХ
ВЕЩЕСТВ
При протекании химических реакций во
взаимодействие
вступают молекулы,
атомы или ионы исходных веществ.
Для того, чтобы они прореагировали
полностью, их необходимо брать в
эквивалентных
(равноценных)
количествах.
12.
Эквивалент (Э) – такое количество вещества,которое соединяется с 1 молем атомов
водорода или ½ моля атомов кислорода в
химических реакциях.
Эквивалент выражается в молях.
Эквивалент – реальная или условная частица,
которая в данной кислотно-основной р-ции,
в р-ции ионного обмена равноценна одному
атому или одному иону водорода, а в ОВР –
одному электрону. Под «реальной» частицей
понимают реально существующие соединения
(H2SO4, O2), под «условной» частицей – доли
этих реальных частиц (½ H2SO4, ¼ O2).
13.
Пример. Определите эквиваленты веществ в р-ции:H 2SO4 2NaOH Na 2SO4 2H 2O
Решение.
В данной р-ции участвуют два иона водорода, а на
один ион водорода приходится:
1 H SO NaOH 1 Na SO H O
2
2
2
4
2
4
2
Э(H2SO4) = ½ моль молекул H2SO4
Э(NaOH) = 1 моль молекул NaOH
Поскольку
молекулярные
соответствуют
молярным,
утверждение:
…
соотношения
справедливо
Э(H2SO4) = ½ моль молекул H2SO4 = ½ М H2SO4
Э(NaOH) = 1 моль молекул NaOH = 1 М NaOH
14.
Эквивалентная масса (Эвещ) –масса
одного
эквивалента
вещества, г/моль.
ЭH2SO4 1 2 MH2SO4 1 2 98 49 г / моль
Эквивалентный объем (VЭ) –
объем 1 эквивалента газообразного
вещества
при
нормальных
условиях.
15.
В качестве исходных величин при определениихимических
эквивалентов
веществ
приняты
эквивалент водорода и эквивалент кислорода.
Э(H 2 ) 1 моль атомов водорода
Э H 2 1 г/моль
VЭ(Н 2 ) 11, 2 л/моль
!!!
Э(O 2 ) 1 / 2 моля атомов кислорода
Э О2 8 г/моль
VЭ(O2 ) 5,6 л/моль
16.
Для вычисления эквивалентного объема газовнеобходимо знать число эквивалентов в одном
моле газа. Напр-р, для водорода
что в два раза меньше массы 1 моля, след-но,
объем эквивалента водорода в два раза меньше
объема 1 моля, т.е.
Аналогично:
ЭH2 1г / моль,
VЭ(H2 ) 22,4 : 2 11,2 л/моль.
ЭO2 1 4 M O2 32 : 4 8 г/моль, VЭ(О2 ) 22,4 : 4 5,6 л/моль.
17.
Эквивалентная массаэлемента:
М
Э= ,
В
где М – молярная масса атомов, г/моль;
В – валентность.
Например: МCa= 40 г/моль; В = 2;
ЭCa= 40 / 2 = 20 г/моль;
Э(Са) = ½ моля атомов Са = ½ М Са.
18.
Элемент, проявляющий в соединениях переменную валентность, имеет несколькозначений эквивалентов.
Пример.
В соединении CuO:
ЭCu 64 / 2 32 г / моль и Э Cu 1 2 М Cu
В соединении Cu2O:
ЭCu 64 / 1 64 г / моль и Э Cu 1 М Cu
19.
Эквивалентная массаоксида:
М
Э=
,
n В
где М – молярная масса оксида, г/моль;
В – валентность элемента;
n – число атомов элемента в оксиде.
Эокс Э эл 8
Эокс, Ээл – эквивалентные массы оксида и
элемента, г/моль
8 – эквивалентная масса кислорода, г/моль
20.
Пример.Э Al2O3
Э Al2O3
M Al2O3
BAl n Al
102
17 г / моль;
3 2
27
Э Al 8
8 17 г / моль
3
21. Эквивалентные массы сложных веществ (кислот, оснований, солей)
М кислМ осн
М соли
Экисл =
, Эосн =
, Эсоли =
,
n H+
n OH
n Ме ВМе
где Мкисл, Мосн, Мсоли – молярные массы
соответственно кислоты, основания, соли, г/моль;
nH+, nОH- – число ионов водорода (гидроксильных
групп), вступивших в реакцию;
nме – число атомов металла в молекуле соли;
Вме – валентность металла.
22.
Экислоты Э H + Экисл. остаткаЭоснования Э Ме Э OH
Эсоли Э Ме Экисл. остатка
Эквивалентная масса кислотного остатка
рассчитывается делением молярной массы
на его заряд.
23.
Примеры:Э H 2SO4
ЭCa OH
2
Э Al2 SO4
3
M H2SO4
98
49 г/моль
2
n H
M Ca OH
n OH
M Al2 SO4
3
BAl n Al
2
74
37 г/моль
2
342
57 г/моль
3 2
24. !!! Эквиваленты сложных веществ могут иметь различные значения в зависимости от того, в какую реакцию обмена они вступают.
Пример. Рассчитайте эквивалентную массу сернойкислоты в указанных реакциях:
H 2SO4 NaOH NaHSO4 H 2O
H 2SO4 2NaOH Na 2SO4 2H 2O
В первой реакции участвует один ион водорода серной
кислоты, поэтому
M H SO
98
ЭH SO
98 г/моль.
2
2
4
n H
4
1
Во второй реакции участвуют оба иона водорода
серной кислоты, поэтому
Э H 2SO4
M H2SO4
n H
98
49 г/моль.
2
25.
ЗАКОН ЭКВИВАЛЕНТОВМассы веществ m1, m2 , реагирующих друг с другом или
получающихся в результате реакции, пропорциональны
их эквивалентным массам Э1, Э2 :
m1 Э1
.
m2 Э 2
Если одно или оба вещества находятся в газообразном
состоянии, закон эквивалентов записывается в виде:
V1 VЭ1
m1 Э1
,
или
V V
V2
VЭ2
2
Э2
V1, V2 – объемы взаимодействующих газообразных
веществ при н.у.;
VЭ1 ,VЭ2 – эквивалентные объемы газообразных
веществ при н.у.
26.
Число моль эквивалентов nэ вещества равно:m
nЭ
,
Э
V
nЭ
VЭ
Учитывая определение nэ, закон эквивалентов
можно записать в виде:
m1 m 2
,
Э1 Э2
или
m1 V2
,
Э1 VЭ2
V1
V2
,
VЭ1 VЭ2
n Э1 n Э2 .
Закон эквивалентов можно сформулировать следующим образом:
число моль эквивалентов всех участвующих
в данной реакции веществ одинаково.
27.
Примеры:1. При взаимодействии 11,17 г железа с
кислородом образовалось 15,97 г оксида.
Определить формулу образовавшегося оксида
железа.
m Fe m O
Э Fe
2
ЭO2
2. Мышьяк образует два оксида – с массовой
долей мышьяка 65,2 % и 75,7 %. Определите
эквивалентную массу и валентность мышьяка
в оксидах и напишите формулы оксидов.
mAs mO2
Э As ЭO2

























 Химия
Химия








